应激性心肌病心电图的再认识
赵运涛
应激性心肌病心电图的再认识
赵运涛
应激性心肌病(Stress induced cardiomyopathy)指在严重精神或躯体应激(包括疾病)下出现一过性左室功能障碍的疾病。1990年Sato等描述了此综合征,称为Tako-Tsubo心肌病,其主要特征为一过性心尖部室壁运动异常,呈气球样变,故也称心尖气球样变综合征。称其为Tako-Tsubo是因为左室形状似窄颈圆底的日本章鱼捕捉篓。2006年美国心脏病学会正式将其归为获得性心肌病。应激性心肌病在提示有急性心梗症状的患者中发生率为0.7%~2.5%[1]。尽管患者存在严重左室功能障碍但冠脉无严重病变。左室功能障碍几乎均为可逆性,几天或几周内恢复正常,预后一般较好。
1 病因
本病发病突然,患者发病前均伴有明显的精神或躯体应激,精神应激如:受到惊吓、争吵、愤怒、亲人亡故、劳累等;躯体应激的范畴更加广泛,根据目前全球文献报道,几乎涵盖了各种内外科疾病,如脑卒中、胰腺炎、胃肠炎、肠梗阻、脓毒血症、甲亢、外科手术及起搏器手术等等。有趣的是,女性患者的应激性心肌病诱因多为精神因素,而男性则多为躯体应激,也就是疾病本身作为应激因素诱发了应激性心肌病。尤其值得注意的是,进入重症监护室的28%患者并发应激性心肌病。约50%严重脓毒血症者可并发累及左右心室的应激性心肌病[2]。神经内分泌瘤(嗜铬细胞瘤)以及外源性儿茶酚胺的使用(如多巴胺、多巴酚丁胺、肾上腺素、β受体激动剂等)均可导致应激性心肌病。严重缺血性脑血管事件、蛛网膜下腔出血或脑外伤亦可引起可逆性的心室功能障碍,称神经源性应激性心肌病[3],而其心电图表现就是我们已经熟知的Niagara 瀑布样T波改变。
2 诊断
不仅在ST段抬高的患者,在所有怀疑心源性胸痛的患者,尤其是绝经后女性,均应考虑应激性心肌病的可能。目前应激性心肌病有多家制订的诊断标准[4],但一般参照修订的2008年Mayo标准[5],此标准应符合以下4点:①左室中部伴/不伴心尖部出现一过性运动减低、无运动或矛盾运动,局部室壁运动异常超过单一冠脉供血区以外的心肌;经常有应激因素,但也可以没有应激因素;②冠脉造影未提示阻塞性病变或急性斑块破裂,老年患者可同时存在轻度冠脉狭窄;③新出现的心电图异常(ST段抬高和/或T波倒置)或心肌肌钙蛋白轻度或中度升高;④不存在心肌炎和嗜铬细胞瘤。以上4条标准必须同时具备。但头部外伤、脑出血或嗜铬细胞瘤均可引起儿茶酚胺增加,引起一过性左室壁运动障碍,故也属于应激性心肌病的范畴,其中国内外文献大量报道了以应激性心肌病为首发表现的嗜铬细胞瘤病例[6-10],所以Mayo标准的第4条排除标准尤其值得警惕,以免漏诊嗜铬细胞瘤。对拟诊为急性心肌梗死的和广泛T波倒置的患者进行鉴别诊断时,必须考虑到应激性心肌病的可能,尤其是在心电图所反映的心肌缺血范围超出了心肌标记物所反映的心肌坏死范围,以及冠脉造影未显示有意义的冠状动脉狭窄时。
必须说明的是,随着应激性心肌病病例报告的增多,对应激性心肌病的受累心腔和受累心腔节段的认识也越来越深刻。传统的应激性心肌病是以前常说的左室心尖球囊综合征或Tako-Tsubo心肌病,但也有其它特殊类型,比如左室受累节段并非是心尖部,而是心室中部[11],甚至是仅仅局限于基底部[12]。还有的患者不是左室受累,而是右室受累[13,14],更有双室同时受累的应激性心肌病[15]。本文所讲的应激性心肌病心电图仅限于经典的应激性心肌病,即左室心尖球囊综合征。
3 心电图鉴别诊断
应激性心肌病最常见的心电图表现为ST段抬高(49%~90%)、T波倒置(44%~83%)、Q波(27%~32%)[16]。其中ST段抬高和T波倒置在2008年Mayo应激性心肌病的诊断标准里具有重要的价值[5],而这些心电图异常遵循一定的时间顺序。Mitsuma等将应激性心肌病的心电图改变分为4期:①即刻的ST段抬高;②第1~3 d出现第1次T波倒置;③第2~6 d出现倒置T波的短暂恢复;④进展至巨大T波倒置伴QT延长,直至完全恢复,持续约2个月(表1、图1)。由于应激性心肌病心电图表现与左前降支急性闭塞所致的急性前壁心肌梗死心电图相类似,这种鉴别诊断对于选择正确的治疗策略显得尤为重要,尤其是在急性期,是否选择行再灌注治疗是至关重要的。12导联心电图是目前最简单、最广泛应用同时也是可以床边实时进行鉴别的方法。掌握心电图对应激性心肌病与急性前壁心肌梗死的鉴别诊断方法具有不可估量的价值,而鉴别的方法分别是基于T波、ST段、和QRS波群的改变。下面将从心电图的复极(T波和ST段)到除极(QRS波群)逐一论述,最后综合起来判断。
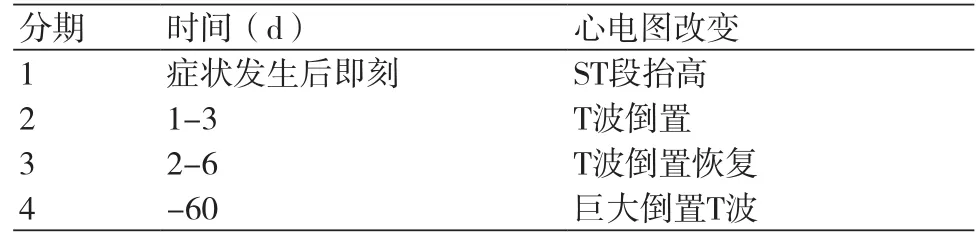
表1 应激性心肌病的心电图分期
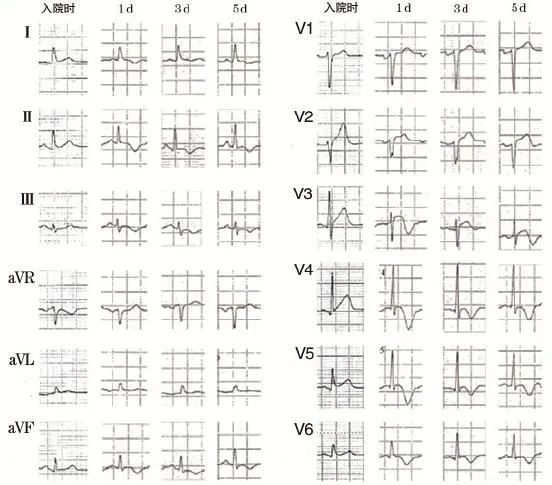
图1 应激性心肌病心电图分期
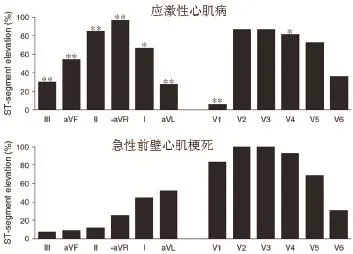
图2 应激性心肌病和急性前壁心肌梗死ST段抬高导联分布特征
3.1 基于ST段抬高的鉴别诊断 在应激性心肌病的极早期(症状出现数小时内),ST段抬高是最常见的心电图表现。Tsuchihashi报道,应激性心肌病出现症状的6~9 h内,ST段抬高的发生率高达90%。ST段抬高的导联分布特征和幅度对应激性心肌病和急性前壁心肌梗死具有重要的鉴别价值。如图2所示:应激性心肌病ST段抬高肢体导联最常见于下壁导联,特别是Ⅱ导联,而ST段压低肢体导联最常见于aVR导联。急性前壁心肌梗死与之不同,肢体导联ST段抬高多见于侧壁导联。应激性心肌病胸导联ST段抬高多见于V2~V5导联,而V1导联很少出现ST段抬高。急性前壁心肌梗死胸导联ST段抬高多见于V2~V4导联(特别是V2~V3导联)。综上可见,应激性心肌病ST段抬高的导联分布比急性前壁心肌梗死分布更加广泛,不仅前壁受累,下壁和侧壁均受累,这也与应激性心肌病左室心尖部受累的特征相对应。尤其需要指出的是-aVR导联是aVR导联的反向导联,导联轴指向30°,也就是说,-aVR导联面对的是左室心尖部和下侧壁区域。所以如图2所示,应激性心肌病-aVR导联100%出现ST段的抬高,即aVR导联100%出现ST段的压低。急性前壁心肌梗死aVR导联ST段压低很少见,是由于左前降支很少绕过心尖部,所以左前降支闭塞导致的急性前壁心肌梗死很少心尖部受累,反映在心电图上即为aVR导联ST段压低很少见,而应激性心肌病为环左室心尖部受累,超出了左前降支的血液供应范围,所以这一点与其急性前壁心肌梗死的鉴别诊断非常重要。从上面的分析可知,心电图无法对左前降支优势型远段闭塞进行心电图鉴别,因为左前降支优势型冠脉包绕心尖部,引起的ST段改变与应激性心肌病难以鉴别。另外,由图2可见,胸导联上应激性心肌病和急性前壁心肌梗死的最大差别在于应激性心肌病很少出现V1导联ST段抬高,其原因是由于V1导联探查的是右室前壁和室间隔基底部,而应激性心肌病主要为左室心尖部受累,很少累及左室基底部,所以V1导联很少出现ST段抬高。aVR压低≥0.5 mV联合V1导联ST段不抬高对于诊断应激性心肌病的灵敏性为91%,特异性为96%。
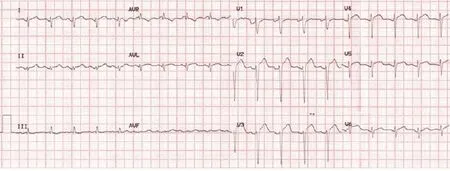
图3 应激性心肌病心电图68岁女性,与人争吵后出现持续胸痛和气短入院,心电图:窦性心律,心率118 次/min,II导联、V2~V6导联ST段抬高0.1~0.3 mV
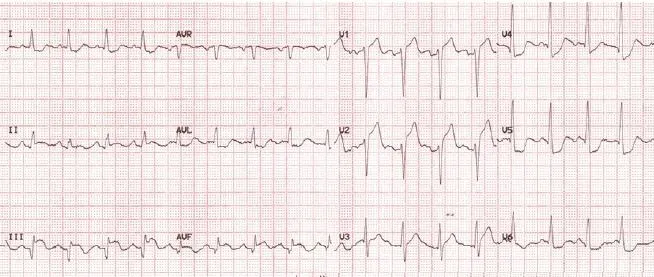
图4 左前降支中段与回旋支中段同时急性闭塞心电图
另外,图2显示,应激性心肌病下壁导联多出现ST段抬高。下面结合冠脉分布及向量进行解释。左前降支近段闭塞下壁导联可以出现ST段的压低,这可以解释为前壁导联ST段抬高的对应改变。左前降支中段或远段闭塞下壁导联ST段一般无明显变化,其原因是由于中段或远端闭塞导致左室前壁ST段向量指向左前方,几乎与额面下壁垂直,所以ST段向量在下壁导联投影接近0。但如果上述情况发生于左前降支优势型冠脉,即左前降支包绕心尖部,供应下壁血供,中段或远端闭塞会导致左室前壁及下壁缺血,所以ST段向量指向左前下方,所以在下壁导联投影会出现ST段抬高。
还有更加罕见的情况,比如左前降支及回旋支同时闭塞,也会导致下壁导联和前壁导联ST段同时抬高。图3为我院诊断的1例应激性心肌病的病例,入院后第1份心电图示:Ⅱ导联ST段抬高幅度>Ⅲ导联,同时合并V2~V6导联ST段抬高,凭借这2个特征,第一时间考虑应激性心肌病,行急诊冠脉造影排除冠脉狭窄,行心室造影证实左室心尖球囊样改变特征。从而确诊应激性心肌病。我们在临床工作中一定要注意前壁导联合并下壁导联ST段抬高的鉴别诊断要点,应激性心肌病ST段抬高的额面电轴约60°,也就是Ⅱ导联ST段抬高幅度>Ⅲ导联的原因所在。而急性前壁心肌梗死更多出现Ⅲ导联ST段抬高幅度>Ⅱ导联。诊断的准确性为81%[17]。图4为我院收治的1例左前降支中段和回旋支中段同时急性闭塞患者的心电图。图中肢体Ⅲ导联ST段抬高幅度>Ⅱ导联,伴V1~V3导联ST段抬高。冠脉造影证实左前降支及回旋支同时闭塞(图5)。
3.2 基于T波倒置特征的鉴别诊断 有些胸痛患者入院时已经过了急性期,心电图仅遗留T波倒置改变。而T波倒置既可以出现在应激性心肌病患者,也可以出现在急性前壁心肌梗死患者。所以二者的鉴别很值得重视。相对于ST段改变对于应激性心肌病和急性前壁心肌梗死的鉴别来说,T波倒置对二者的鉴别诊断就比较容易了。图6是Zorzi A等[18]总结出来的应激性心肌病和急性前壁心肌梗死T波倒置的导联分布特征。由图可知,在肢体导联急性前壁心肌梗死最容易发生T波倒置的导联是侧壁,aVR导联很少发生T波直立,而在胸导联,最容易发生倒置的导联是V1~V5导联。应激性心肌病除aVR导联100%发生T波直立外,其它肢体导联均会发生T波倒置,而在胸导联,除V1导联很少发生T波倒置外,其它胸导联均容易发生T波倒置。推测两种疾病导联分布特征不同的机制在于:急性前壁心肌梗死多累及左室侧壁,而这由左前降支血管分布特征决定,左前降支发出对角支,对角支发出前严重狭窄或闭塞,会导致前壁合并侧壁缺血,所以多出现侧壁及前壁T波倒置。而应激性心肌病是左室心尖部球囊样改变,所以面对左室心尖部的aVR导联必然出现T波直立,而其它肢体导联都会出现T波倒置。由于应激性心肌病室间隔基底部很少受累,故V1导联很少出现T波倒置。
T波倒置及动态改变的机制:2011年,Migliore F等[19]对T波倒置动态改变的机制应用心脏磁共振显像进行研究表明,T波倒置动态改变与心肌水肿的恢复在时间上平行一致,而与心室机械功能异常的恢复无关。2013年,同一组研究人员[20]应用心脏磁共振研究表明,心尖部和基底部的水肿梯度是T波倒置和QT延长的原因所在。以上2项研究第1次运用心脏磁共振成像技术将心脏的结构改变(心尖部水肿)和心室复极改变(T波倒置)联系了起来。也第1次使我们从左室的结构改变上来认识T波改变,将结构(structure)和电功能(function)融为了一体,推进了我们对T波倒置原因的认识。
图7为我院因与人争吵收入院的另外1名73岁女性,肢体导联aVR导联T波明显直立,aVL导联T波直立;胸导联V1导联T波浅倒,V2~V6导联T波深倒,当时考虑应激性心肌病,行冠脉造影检查未见冠脉明显狭窄和斑块。左室造影如图8所示。
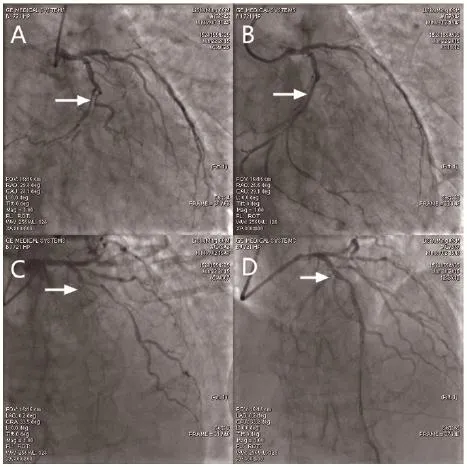
图5 急性冠脉闭塞造影图
3.3 基于QRS波群的鉴别诊断 由于心脏磁共振成像技术检测到心肌水肿的存在,顺理成章的自然想到心肌水肿不但会影响心肌复极,更会影响心肌除极,即QRS波[21,22]。Madias等[21]基于这个假设发现,在应激性心肌病患者,以肢体导联<5 mm、胸导联<10 mm来定义低电压的话,200例应激性心肌病患者中,10.5%的患者12导联均呈低电压,23.5%的患者肢体导联低电压,26%的患者胸导联低电压。从图3和图7 2例应激性心肌病心电图可以看出,肢体导联完全符合低电压诊断标准。另外Looi JL等[23]通过入院第2 d对比应激性心肌病和急性前壁心肌梗死心电图发现,急性前壁心肌梗死无一例外均进展为Q波,而应激性心肌病无一例Q波形成。所以如果ST段和T波未能完全将应激性心肌病与急性心肌梗死鉴别开来,可以在第2 d行心电图检查,观察Q波的形成情况,从而支持或否定之前的诊断。
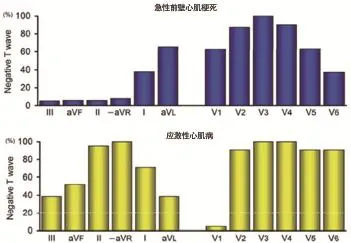
图6 应激性心肌病和急性前壁心肌梗死T波倒置导联分布特征
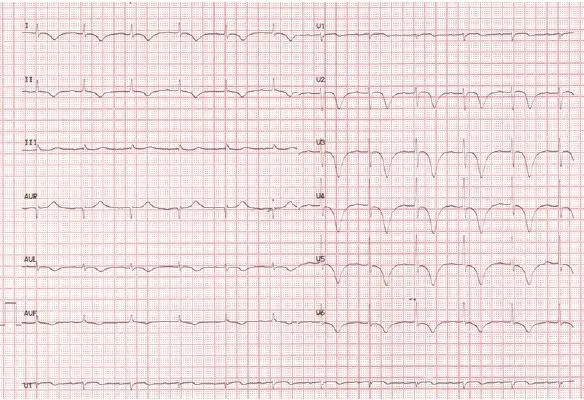
图7 应激性心肌病T波倒置心电图
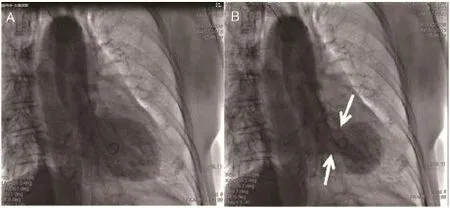
图8 应激性心肌病患者左室造影
结语:我们通过复习全球经典的应激性心肌病心电图发现,无论患者应激因素如何复杂多变,对应激性心肌病心电图了然于胸是最好也是最快的鉴别手段。我院就诊的应激性心肌病病例均为根据床边心电图检查第一时间考虑应激性心肌病,冠脉造影排除冠脉病变,左室造影证实心尖球囊样变。另外,对临床医生而言,除了第一时间根据心电图做出应激性心肌病的诊断外,也要注意以下2个不匹配的存在:①肌钙蛋白升高程度与心电图ST段抬高的导联范围或T波倒置的导联范围不匹配,即心电图改变的导联范围广,但肌钙蛋白升高幅度远远低于预想的幅度;②肌钙蛋白升高程度与室壁运动异常节段的广泛程度不匹配,即肌钙蛋白升高幅度远远低于室壁运动异常范围相匹配的肌钙蛋白水平。所以无论是仅仅依靠心电图,还是同时结合临床资料,深刻领会上述应激性心肌病的特征性心电图改变,则应激性心肌病就非常容易被识别出来。
[1]Nef HM,Mollmann H,Akashi YJ,et al. Mechanisms of stress (Takotsubo) cardiomyopathy. Nat Rev Cardiol 2010,7(4):187-193.
[2]Bybee KA,Prasad A. Stress-Related Cardiomyopathy Syndromes. Circulation 2008,118(4):397-409.
研究得出数据通过SPSS19.0软件统计处理,以数(n)或率(%)表示计数资料,以χ2检验,P<0.05说明差异有统计学意义。
[3]Wittstein IS,Thiemann DR,Lima JA,et al. Neurohumoral features of myocardial stunning due to sudden emotional stress. N Engl J Med 2005,352(6):539-548.
[4]Madias JE. Why the current diagnostic criteria of Takotsubo syndrome are outmoded: a proposal for new criteria. Int J Cardiol 2014,174(3):468-470.
[5]Prasad A,Lerman A,Rihal CS: Apical ballooning syndrome (Tako-Tsubo or stress cardiomyopathy): A mimic of acute myocardial infarction. Am Heart J, 155(3):408-417.
[6]De Souza F,Altenburg Odebrecht Curi Gismondi R,Henriques Cunha Neto S,et al. Tako-tsubo-like cardiomyopathy and extraadrenal pheochromocytoma: case report and literature review. Clin Res Cardiol 2008,97(6):397-401.
[7]Agarwal V,Kant G,Hans N,et al. Takotsubo-like cardiomyopathy in pheochromocytoma. Int J Cardiol 2011,153(3):241-248.
[8]Zhu D,Yu J,Li X, Jiang X,et al. Takotsubo-like cardiomyopathy in a giant pheochromocytoma. Int J Cardiol 2014, 176(3):e113-116.
[9]Viskin S,Fish R,Roth A,et al. Clinical problem-solving. QT or not QT? N Engl J Med 2000, 343(5):352-356.
[10]Satendra M,de Jesus C,Bordalo e Sá AL,et al. Reversible catecholamine-induced cardiomyopathy due to pheochromocytoma: Case report. Revista Portuguesa de Cardiologia (English Edition) 2014, 33(3):177.e171-177.e176.
[11]Kurisu S,Kato Y,Mitsuba N,et al. Comparison of Electrocardiographic Findings Between the Midventricular Ballooning Form and Apical Ballooning Form of Takotsubo Cardiomyopathy. Clinical Cardiology,2011, 34(9):555-559.
[12]Ashrafpoor G,Puymirat E,Sabbah L,et al. Inverted stress (Takotsubo) cardiomyopathy following caesarean section: insights from cardiac magnetic resonance. Int J Cardiol 2013, 165(2):e38-39.
[13]Burgdorf C,Hunold P,Radke PW,et al. Isolated right ventricular stress-induced ("Tako-Tsubo") cardiomyopathy. Clin Res Cardiol 2011, 100(7):617-619.
[14]Haghi D,Athanasiadis A,Papavassiliu T,et al. Right ventricular involvement in Takotsubo cardiomyopathy. Eur Heart J 2006, 27(20):2433-2439.
[15]Joe BH,Hwang HJ,Park CB,et al. Takotsubo cardiomyopathy recurrence with left ventricular apical ballooning following isolated right ventricular involvement: A case report. Exp Ther Med 2013, 6(1):260-262.
[16]Duran-Cambra A,Sutil-Vega M,Fiol M,et al. Systematic review of the electrocardiographic changes in the takotsubo syndrome. Ann Noninvasive Electrocardiol 2015, 20(1):1-6.
[17]Vervaat FE,Christensen TE,Smeijers L,et al. Is it possible to differentiate between Takotsubo cardiomyopathy and acute anterior ST-elevation myocardial infarction? J Electrocardiol 2015.
[18]Kosuge M,Ebina T,Hibi K,et al. Differences in negative T waves among acute coronary syndrome, acute pulmonary embolism, and Takotsubo cardiomyopathy. Eur Heart J Acute Cardiovasc Care 2012, 1(4):349-357.
[19]Migliore F,Zorzi A,Marra MP,et al. Myocardial edema underlies dynamic T-wave inversion (Wellens' ECG pattern) in patients with reversible left ventricular dysfunction. Heart Rhythm 2011, 8(10):1629-1634.
[20]Perazzolo Marra M,Zorzi A,Corbetti F,et al. Apicobasal gradient of left ventricular myocardial edema underlies transient T-wave inversion and QT interval prolongation (Wellens' ECG pattern) in Tako-Tsubo cardiomyopathy. Heart Rhythm 2013, 10(1):70-77.
[21]Madias JE. Transient attenuation of the amplitude of the QRS complexes in the diagnosis of Takotsubo syndrome. Eur Heart J Acute Cardiovasc Care 2014, 3(1):28-36.
[22]Guerra F,Giannini I,Pongetti G,et al. Transient QRS amplitude attenuation is associated with clinical recovery in patients with takotsubo cardiomyopathy. Int J Cardiol 2015, 187:198-205.
[23]Looi JL,Wong CW,Lee M,et al. Usefulness of ECG to differentiate Takotsubo cardiomyopathy from acute coronary syndrome. Int J Cardiol 2015, 199:132-140.
R542.2
A
2095-4220(2015)02-0065-06
2015-01-06)
(本文编辑:许原)
100049 北京,北京航天中心医院

