利福平通过抑制小胶质细胞活化对大鼠全脑缺血发挥保护作用①
谌贝贝 曹惠敏 李 蓉 承欧梅 (重庆医科大学附属第一医院神经内科,重庆 400016)
利福平是从利福霉素B 中得到的一种半合成抗生素,在神经变性疾病的体外实验研究中发现利福平能抑制脂多糖(Lipopolysaccharide,LPS)诱导的炎症相关因子TNF-α、IL-1β 和COX-2 等的产生,从而减轻神经毒性,对神经元产生保护作用[1]。在中枢神经系统中,利福平对全脑缺血再灌注损伤后的保护作用尚未见报道。小胶质细胞是脑中的巨噬细胞,也是脑实质中唯一的一种免疫细胞,它们清除受损的神经组织、吞噬微生物和细胞碎片[2,3]。小胶质细胞受到刺激以后产生多种炎性细胞介质如IL-1β、IL-6 和TNF-α[4,5]。越来越多的证据表明活化的小胶质细胞产生的毒性物质参与了脑缺血的病理生理过程[6,7]。因此,调控小胶质细胞的活化进而抑制中枢神经系统的炎症反应可能是治疗脑缺血的重点。基于之前的体外实验研究结果,我们推测,在全脑缺血再灌注损伤后利福平可能通过调控小胶质细胞活化从而抑制小胶质细胞介导的炎症反应,进而在全脑缺血后发挥神经保护作用。因此本实验我们通过建立大鼠全脑缺血动物模型,观察利福平在全脑缺血中是否具有保护作用,并分析其对小胶质细胞活化的影响。
1 材料与方法
1.1 实验动物 SPF 级健康雄性SD 大鼠,体重250~300 g,购自重庆医科大学实验动物中心。实验条件下饲养7 d 适应环境后开始实验。在手术前所有实验动物禁食12 h,手术后饲养直至处死,饲养条件同手术前。
1.2 主要药品与试剂 利福平粉针剂(维夫欣)购自重庆华邦制药股份有限公司,以生理盐水溶解为10 mg/ml,每次现配现用。IBA-1 单克隆抗体购自美国GENETEX 公司(货号:GTX101495),SABC 试剂盒购自北京中山金桥公司(货号:SP-9000),IL-1β、IL-6 和TNF-α ELISA 试剂盒购自武汉贝茵莱生物科技有限公司。
1.3 实验设计及动物分组 实验大鼠随机分为:假手术组(S)、全脑缺血/再灌注组(I/R)、全脑缺血/再灌注+利福平处理组(I/R+RFP),每组14 只。I/R+RFP 组大鼠在再灌注完成后30 min,按照20 mg/kg 体重剂量给予利福平腹腔注射(i.p),之后每日给予利福平腹腔注 射1 次(上午9 点)直至处死。假手术组及模型组在相同时间点给予等量的生理盐水腹腔注射(i.p)。
1.4 建立大鼠全脑缺血/再灌注模型 采用双侧颈总动脉夹闭合并系统性低血压建立全脑缺血/再灌注大鼠模型[8]。实验动物经腹腔注射3.5%的水合氯醛(1 ml/100 g)麻醉后,仰卧固定,利用眼科剪在颈部做一切口,用玻璃分针游离双侧颈总动脉和右侧颈总静脉,将3F 硬膜外导管插入右侧颈总静脉至右心房,回抽血液(2.5 ml/100 g),采用微型动脉夹夹闭双侧颈总动脉,20 min 后取下动脉夹,缓慢回输血液,缝合手术切口,将动物放入恒温箱直至苏醒。假手术组动物仅分离右侧颈总静脉和两侧颈总动脉,但不夹闭双侧颈总动脉及抽取血液,余步骤同上。
1.5 石蜡组织取材 各组大鼠在术后第7 天深度麻醉后,剪开胸腔从心尖部插入灌注针至左心室,止血钳固定针头,然后先用生理盐水(4℃)200 ml 冲净脑内血液,再用4%多聚甲醛溶液(4℃)200 ml 灌注固定,断头取脑,置于4%多聚甲醛溶液中后固定48 h,修剪脑组织后脱水包埋,在背侧海马(即前囟3.3~4.5 mm)行连续冠状位切片,片厚4 μm,每隔9 张贴片一张,中间9 张组织切片丢弃,即每10 张切片取一张,之后行HE 及免疫组化染色。
1.6 新鲜组织取材 在术后第3 天将各组大鼠深度麻醉后断头处死,在冰盘上迅速取出大鼠海马组织,锡箔纸包好后做一标记,先用液氮速冻,之后放入-80℃冰箱保存以备ELISA 检测用。
1.7 Morris 水迷宫实验检测大鼠空间学习记忆能力 建模后第7 天进行Morris 水迷宫实验。该实验分为两个阶段,共历时6 d。第一阶段,定位测试(定位航行实验);第二阶段,记忆能力测试(空间探索实验)。定位测试开始前1 天让大鼠在水池中自由游泳2 min,正式训练时,将大鼠头对池壁,入水点随机选择水池四个象限其中之一,记录大鼠找到平台所需的时间(即逃避潜伏期)。如果超过60 s 大鼠仍未找到平台,引导动物至平台上停留15 s,并将逃避潜伏期记为60 s。记忆能力测试:在实验第6天撤除平台,开始60 s 的记忆能力测试,记录60 s动物在目标象限内的跨台次数。
1.8 HE 染色观察组织病理学形态 HE 染色后,显微镜下观察海马CA1 区神经元形态结构变化,在制备好的石蜡切片中,每隔5 张切片取1 张,共取5张作为一套。所有切片均在400 倍下随机取5 个非重叠视野,对各个视野的正常细胞进行计数,计算出每只大鼠海马CA1 区每个高倍镜视野下的平均正常细胞数。
1.9 免疫组织化学检测IBA-1 阳性细胞数目 免疫组化SP 法检测海马组织IBA-1 表达(IBA-1 标记活化的小胶质细胞),按试剂盒说明书(SP-9000,北京中山金桥)逐项操作。IBA-1 阳性细胞呈棕黄色,切片选择及细胞计数的方法同HE 染色,计算每只大鼠海马CA1 区每个高倍镜视野下的平均IBA-1阳性细胞数。
1.10 ELISA 测定海马组织中炎症因子IL-1β、IL-6和TNF-α 的表达 向预存脑组织中加入PBS 冰浴充分匀浆,3 500 r/min 离心15 min 后取上清液采用ELISA 法(双抗体夹心法)按照试剂盒说明书操作。先向待测样品孔中加入待测样品,洗涤后加一抗工作液,充分反应;洗涤后加酶标抗体工作液,充分反应;洗涤后加入底物工作液,充分反应后加入终止液,酶标仪450 nm 波长下读取吸光度值(OD 值),以标准品之OD 值绘制标准曲线,根据标准曲线公式换算出脑组织中 IL-1β、IL-6 和 TNF-α 含量(ng/L)。
2 结果
2.1 Morris 水迷宫实验检测全脑缺血/再灌注后大鼠认知功能的变化 在定位测试中,与S 组相比,I/R 组大鼠找到平台的时间显著延长(P<0.05),表明缺血再灌注后动物认知功能明显受损,模型建立成功;与I/R 组相比,I/R +RFP 组的寻台平均潜伏期明显缩短(P<0.05),表明在全脑缺血后,及时给予利福平能够改善大鼠受损的认知功能。见表1。
表1 利福平对全脑缺血/再灌注大鼠逃避潜伏期的影响(±s,秒)Tab.1 Effect of rifampin on escape latency after GCIR(±s,s)

表1 利福平对全脑缺血/再灌注大鼠逃避潜伏期的影响(±s,秒)Tab.1 Effect of rifampin on escape latency after GCIR(±s,s)
Note:1)P<0.05 vs s group;2)P<0.05 vs I/R group.

图1 空间探索试验典型轨迹图Fig.1 Track of space exploration test
表2 利福平对全脑缺血/再灌注大鼠跨台次数的影响(±s)Tab.2 Effect of rifampin on crossings over platform after GCIR(±s)

表2 利福平对全脑缺血/再灌注大鼠跨台次数的影响(±s)Tab.2 Effect of rifampin on crossings over platform after GCIR(±s)
Note:1)P<0.05 vs S group;2)P<0.05 vs I/R group.

图2 大鼠缺血再灌注7 d 后海马CA1 区病理形态学观察(HE,×200)Fig.2 Hippocampus CA1 area pathological morphology in rats after I/R 7 days (HE,×200)
表3 大鼠缺血再灌注7 d 后海马CA1 神经元细胞计数(±s)Tab.3 Count of hippocampus CA1 neurons in rats after I/R 7 days (±s)

表3 大鼠缺血再灌注7 d 后海马CA1 神经元细胞计数(±s)Tab.3 Count of hippocampus CA1 neurons in rats after I/R 7 days (±s)
Note:1)P<0.05 vs S group;2)P<0.05 vs I/R group.

图3 大鼠缺血再灌注7 d 后海马CA1 区IBA-1 免疫组化染色(SP,×200)Fig.3 Immunohistochemistry of IBA-1 in hippocampus CA1 in rats after I/R 7 days(SP,×200)
表4 大鼠缺血再灌注7 d 后海马CA1 区活化小胶质细胞计数(±s)Tab.4 Count of activation microglia in rats hippocampus CA1 after I/R 7 days (±s)
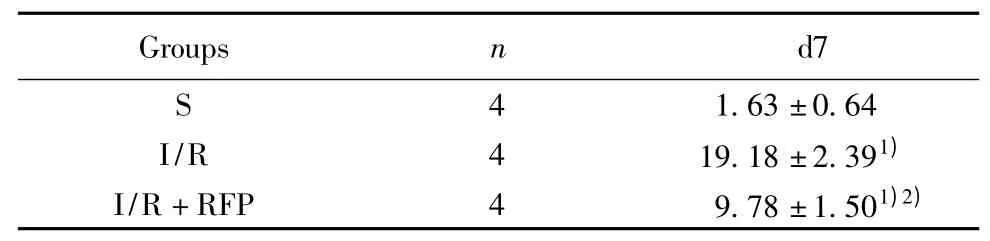
表4 大鼠缺血再灌注7 d 后海马CA1 区活化小胶质细胞计数(±s)Tab.4 Count of activation microglia in rats hippocampus CA1 after I/R 7 days (±s)
Note:1)P<0.05 vs S group;2)P<0.05 vs I/R group.
表5 利福平对全脑缺血/再灌注大鼠海马IL-1β、IL-6 和TNF-α 水平的影响(±s,ng/L)Tab.5 Effect of rifampin on expression of IL-1β,IL-6 and TNF-α in rats hippocampus after I/R(±s,ng/L)

表5 利福平对全脑缺血/再灌注大鼠海马IL-1β、IL-6 和TNF-α 水平的影响(±s,ng/L)Tab.5 Effect of rifampin on expression of IL-1β,IL-6 and TNF-α in rats hippocampus after I/R(±s,ng/L)
Note:1)P<0.05 vs S group;2)P<0.05 vs I/R group.
在记忆能力测试中,S 组及I/R+RFP 组跨台次数明显高于I/R 组(P<0.05),说明S 组及I/R +RFP 组中大鼠对原平台位置的空间记忆优于I/R组。I/R+RFP 组动物跨台次数高于I/R 组(P<0.05),接近S 组(P<0.05),表明利福平能一定程度上改善缺血大鼠的认知功能。见图1、表2。
2.2 HE 染色观察全脑缺血/再灌注后海马CA1 区病理学改变 S 组大鼠海马CA1 区神经元排列紧密,细胞呈圆形,结构清晰,核染色清晰,呈深蓝色;I/R 组出现明显核固缩,细胞结构不规则,排列松散,数目明显减少(P<0.05)。给予利福平后海马神经元损伤明显减轻,较I/R 组有了明显改善(P<0.05)。见图2、表3。
2.3 利福平对全脑缺血/再灌注大鼠脑组织小胶质细胞活化的影响 S 组大鼠海马CA1 区仅见零星少量IBA-1 阳性细胞,I/R 组CA1 区出现大量IBA-1阳性细胞(P<0.05)。给予I/R 组大鼠利福平处理后海马CA1 区IBA-1 阳性细胞明显减少(P<0.05)。见图3、表4。
2.4 利福平对全脑缺血/再灌注大鼠IL-1β、IL-6 和TNF-α 水平的影响 与I/R 组比较,I/R+RFP 组大鼠海马炎症因子IL-1β、IL-6 和TNF-α 水平明显下降(P<0.05),提示利福平能抑制大鼠全脑缺血再灌注损伤后海马组织内IL-1β、IL-6 和TNF-α 的表达。见表5。
3 讨论
大量研究表明利福平在神经变性疾病如阿尔茨海默病和帕金森氏病中具有神经保护作用[9]。Kilic等[10]发现利福平能明显增加MPP +作用后的多巴胺能神经元的存活数量。而近年的研究进一步表明这可能与利福平减少ROS 的生成,抑制胶质细胞的活化,进而减轻神经炎症反应相关[1,11]。本实验中我们发现给予利福平处理后,全脑缺血再灌注大鼠空间学习记忆能力有明显改善,海马神经元损伤减轻,活化胶质细胞数目及炎症因子的表达受到一定程度的抑制。因此,利福平改善大鼠缺血后认知功能、抑制海马神经元损伤,其机制可能与抑制炎症反应有关。
大鼠全脑缺血/再灌注模型模拟的是临床上心脏骤停、休克、窒息等疾病发生的病理生理过程。大鼠在经受全脑缺血再灌注后主要损伤的是对缺血敏感的海马,最后导致学习记忆能力的减退[12]。在建立动物模型的过程中我们发现,抽取完预定量的血液后,双侧颈总动脉阻断5 s 左右,动物的嘴唇及角膜变苍白,双侧瞳孔逐渐散大、直接及间接对光反射消失,翻正反射消失。行为学实验发现模型大鼠的空间记忆功能有明显的损伤,同时海马CA1 区神经元正常细胞数目明显减少、细胞结构不规则,核固缩。此外模型组大鼠海马CA1 区活化的小胶质细胞数目也显著增多,海马组织炎症因子IL-1β、IL-6和TNF-α 的表达水平明显升高。说明本实验中我们所建立的大鼠全脑缺血/再灌注损伤模型是成功的。
Morris 水迷宫实验结果显示,缺血再灌注组大鼠的平均逃避潜伏期较假手术组明显延长,利福平干预组大鼠找到平台的时间从第1 天起就低于缺血模型组,在第5 天找到平台的时间与假手术组相比没有明显的差异。在空间探索试验中,利福平干预组跨台次数也远多于模型组。表明利福平能够促进缺血后大鼠认知功能障碍的恢复。
全脑缺血/再灌注导致的大鼠认知功能障碍的主要原因是海马CA1 区神经元的迟发型坏死[13,14],既往的研究证实缺血再灌后3 d 就可以看到大量CA1 区锥体细胞明显破坏,海马神经元数目减少,形态不规则,细胞核固缩、乃至消失,胞浆嗜伊红深染,且在再灌后7 d CA1 区迟发型死亡达到高峰[8,15]。而CA3 区对缺血有较好的耐受性,大部分细胞损害不明显。因此本实验采用再灌7 d 作为海马神经元检测时间点,结果发现利福平干预组海马CA1 区锥体细胞明显增多,神经元细胞核固缩、胞浆深染受到了一定程度的抑制,提示利福平对缺血后的海马神经元损伤有一定的保护作用。
全脑缺血后海马CA1 区神经元的迟发型死亡与小胶质细胞的活化密切相关[16]。近年的研究提示利福平可以通过抑制脂多糖诱导的小胶质细胞的活化,从而提高神经元的存活率。本实验中我们发现,模型组大鼠海马CA1 区见大量小胶质细胞浸润,利福平干预组小胶质细胞的活化明显被抑制。此外,小胶质细胞活化后释放的大量炎症因子如IL-1β、IL-6 和TNF-α 可能是介导脑缺血后组织损伤的一个重要环节[17]。我们研究发现利福平处理后小胶质细胞的活化受到抑制的同时也伴随着IL-1β、IL-6 和TNF-α 因子的释放减少,因此这可能是利福平发挥脑缺血后保护作用的重要机制之一。
总之,本研究表明利福平对大鼠全脑缺血有明显的保护作用,其机制可能与抑制小胶质细胞的活化,减少IL-1β、IL-6 和TNF-α 炎症因子的释放有关,因此可为利福平治疗脑缺血提供一定的理论基础。
[1]Bi W,Zhu L,Wang C,et al.Rifampicin inhibits microglial inflammation and improves neuron survival against inflammation[J].Brain Res,2011,1395:12-20.
[2]Fumagalli S,Perego C,Pischiutta F,et al.The ischemic environment drives microglia and macrophage function[J].Front Neurol,2015,6:81-87.
[3]Gehrmann J,Matsumoto Y,Kreutzberg GW.Microglia:intrinsic immuneffector cell of the brain[J].Brian Res Brain Res Re,1995,20(3):269-287.
[4]Ritzel RM,Patel AR,Grenier JM,et al.Functional differences between microglia and monocytes after ischemic stroke[J].J Neuroinflammation,2015,12(1):106-115.
[5]Barakat R,Redzic Z.Differential cytokine expression by brain microglia/macrophages in primary culture after oxygen glucose deprivation and their protective effects on astrocytes during anoxia[J].Fluids Barriers CNS,2015,12(6):90-96.
[6]Ni J,Wang X,Chen S,et al.MicroRNA let-7c-5p protects against cerebral ischemia injury via mechanisms involving the inhibition of microglia activation[J].Brain Behavior Immun,2015,12(5):78-85.
[7]Ji Y,Zhou Y,Pan J,et al.Temporal pattern of Toll-like receptor 9 upregulation in neurons and glial cells following cerebral ischemia reperfusion in mice[J].Int J Neurosci,2015,20(7):1-9.
[8]Cheng O,Li Z,Han Y,et al.Baicalin improved the spatial learning ability of global ischemia/reperfusion rats by reducing hippocampal apoptosis[J].Brain Res,2012,1470(5):111-118.
[9]Yulug B,Hanoglu L,Kilic E,et al.RIFAMPICIN:An antibiotic with brain protective function[J].Brain Res Bull,2014,107:37-42.
[10]Kilic U,Kilic E,Lingor P,et al.Rifampicin inhibits neurodegeneration in the optic nerve transection model in vivo and after 1-methyl-4-phenylpyridinium intoxication in vitro[J].Acta Neuropathol,2004,108(1):65-68.
[11]Chen S,Sun Y,Zeng Z,et al.Rifampicin inhibits apoptosis in rotenone-induced differentiated PC12 cells by ameliorating mitochondrial oxidative stress[J].Neural Regen Res,2010,5(4):251-256.
[12]Wang R,Tu J,Zhang Q,et al.Genistein attenuates ischemic oxidative damage and behavioral deficits via eNOS/Nrf2/HO-1 signaling[J].Hippocampus,2013,23(7):634-647.
[13]Cheng O,Ostrowski R P,Wu B,et al.Cyclooxygenase-2 mediates hyperbaric oxygen preconditioning in the rat model of transient global cerebral ischemia[J].Stroke,2011,42(2):484-490.
[14]Kirino T,Tamura A,Sano K.Delayed neuronal death in the rat hippocampus following transient forebrain ischemia[J].Acta Neuropathol,1984,64(2):139-147.
[15]Kihara S,Shiraishi T,Nakagawa S,et al.Visualization of DNA double strand breaks in the gerbil hippocampal CA1 following transient ischemia[J].Neurosci Letters,1994,175 (1-2):133-136.
[16]Guan YZ,Jin XD,Guan LX,et al.Nicotine inhibits microglial proliferation and is neuroprotective in global ischemia rats[J].Mol Neurobiol,2015,51(3):1480-1488.
[17]Sriram K,O'callaghan J P.Divergent roles for tumor necrosis factor-alpha in the brain[J].J Neuroimmune Pharmacol,2007,2(2):140-153.