巨细胞病毒感染后新生鼠RORγt、IL-17 的表达及意义①
冯晶晶 李慧慧 孙婷婷 于 乔 王瑞妍 王 军 (徐州医学院附属医院儿科,徐州 221000)
巨细胞病毒(Cytomegalovirus,CMV)普遍存在于自然界,一旦侵入机体将终生携带。CMV 为机会性致病原,主要对免疫低下或缺陷者:如婴幼儿、新生儿、胎儿等产生危害,可导致全身播散性感染,且感染易形成持续及慢性化发展[1],其原因尚不明确。近年来新发现的Th17 细胞来源于CD4+T 细胞,Th17/Treg 细胞平衡的作用广受关注,研究表明此平衡的打破与炎症性疾病、自身免疫性疾病的发生发展密切相关[2]。维甲酸相关孤儿核受体(RORγt)是Th17 细胞的特异性转录调控因子,分布于淋巴细胞内,调节IL-17 的分泌。我们前期研究表明,在鼠巨细胞病毒(Murine cytomegalovirus,MCMV)肝炎新生鼠中IL-17、IL-23 呈现高表达,提示Th17 细胞可能参与MCMV 肝炎的发病[3],本实验继续从Th17 细胞的转录因子入手,采用RT-PCR 及Western blot 方法测定MCMV 新生鼠脾脏内RORγt及IL-17 的表达,为巨细胞病毒感染的发病机制及治疗提供实验依据。
1 材料与方法
1.1 细胞与病毒培养 小鼠胚胎成纤维细胞(3T3细胞)引自江苏省南京医科大学儿科实验室,MCMV Smith 株由山东省医学科学院微生物研究所友情提供,3T3 细胞按常规方法培养传代,病毒致半数细胞感染量(TCID50)=104.31/0.1 ml。
1.2 实验动物模型制备及分组 48 只健康BALB/c新生鼠随机分成病毒组(C 组)和对照组(V组)。病毒组按照文献[4]制备巨细胞病毒感染模型,对照组于相应时点腹腔注射等量无菌生理盐水,造模后第3、7、14 天处死小鼠,无菌法取脾脏组织,分置于冻存管中,-80℃保存备用。
1.3 PCR 检测 采用蛋白酶K 裂解法提取脾脏组织DNA 进行MCMV DNA PCR 检测,同时用RTPCR 法检测小鼠脾脏IL-17 mRNA,RORγt mRNA,反应体系:DNA 模板(脾脏提取)2 μl,上游引物1 μl,下游引物1 μl,Taq 酶12.5 μl,dd H2O 8.5 μl,共25 μl;反应条件:94℃预变性3 min;然后执行35个循环:94℃变性30 s,各目的基因的退火温度见表1,退火30 s,72℃延伸40 s;最后72℃总延伸5 min。电泳条件:100 mV 电泳40 min 以S1000 Thermal-Cycler PCR 扩增仪进行扩增,扩增片段见表1,扩增产物在2% 琼脂糖凝胶上进行电泳,以GIS-2008 型数码凝胶图像分析系统进行拍照记录。
1.4 Western blot 检测法测定脾脏组织中RORγt 蛋白表达水平 SDS-PAGE 结束后,采用半干转的方法将凝胶中的蛋白条带转移至NC 膜上,5%脱脂奶粉室温封闭3 h,将NC 膜分别与兔抗小鼠RORγt(1∶500)和β-actin(1∶1 000)多克隆抗体4℃孵育过夜,充分洗膜后加入辣根过氧化物酶标记羊抗兔IgG 抗体(1∶1 000)室温孵育4 h,加入底物BCIP/NBP 混合液显色。
2 结果
2.1 各组各时点脾脏组织中MCMV-DNA 的表达如图1 所示,病毒组感染后3 d 即出现阳性条带,说明存在巨细胞病毒DNA 表达,且随着感染时间的延长,其表达越来越多,而对照组则未出现阳性条带。
2.2 脾脏组织中RORγt 蛋白的表达 如图2,Western blot 分析显示,在蛋白相对分子质量为57及43 kD 处可见特异性阳性条带,分别是RORγt及β-actin 蛋白表达。病毒组脾脏组织中的RORγt蛋白表达较对照组相应时点明显增加(P <0.05),差异有统计学意义,且第14 天时表达量最高(见表2)。
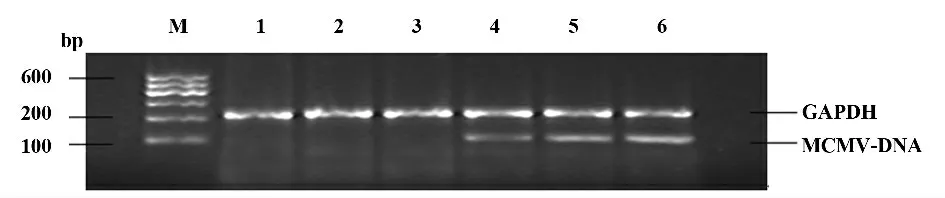
图1 MCMV 感染小鼠各时点脾脏MCMV DNA 电泳图Fig.1 MCMV DNA electrophoresis of different periods MCMV infection of spleen in newborn mice

表1 MCMV,IL-17,RORγt,GAPDH 及β-actin 引物序列Tab.1 Primer sequence of MCMV,IL-17,RORγt,GAPDH and β-actin
表2 不同时间点脾脏组织RORγt 蛋白表达量(n=8,±s)Tab.2 Expression of RORγt protein in spleen of newborn mice(n=8,±s)
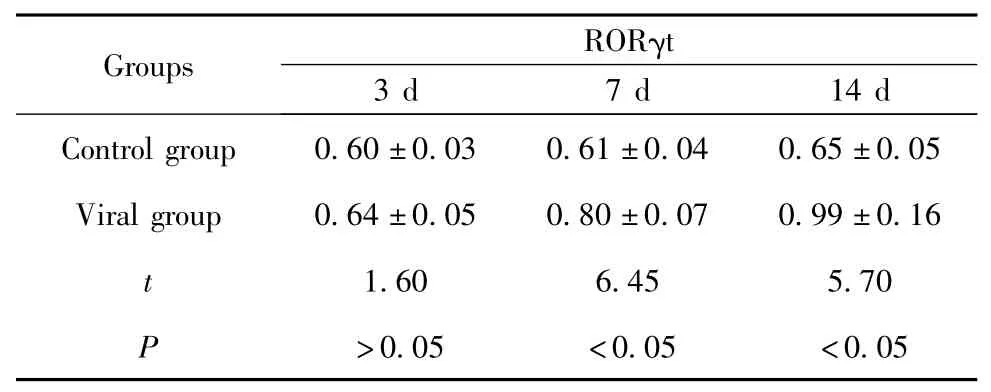
表2 不同时间点脾脏组织RORγt 蛋白表达量(n=8,±s)Tab.2 Expression of RORγt protein in spleen of newborn mice(n=8,±s)
Note:Viral group compared with the control group in the corresp-onding point.
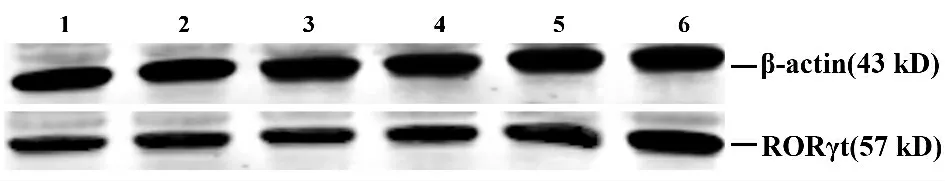
图2 脾脏RORγt 蛋白表达的Weston blot 分析Fig.2 Images of RORγt protein production in spleen of newborn mice
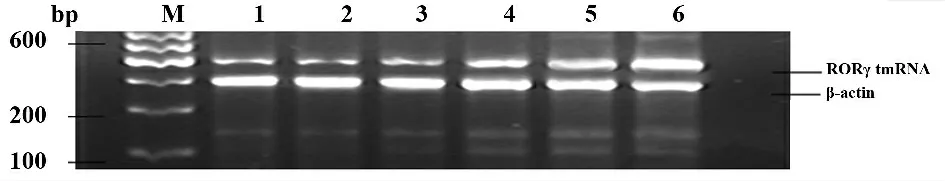
图3 各组新生鼠脾脏RORγt mRNA 电泳图Fig.3 Images of RORγt mRNA production in spleen of newborn mice
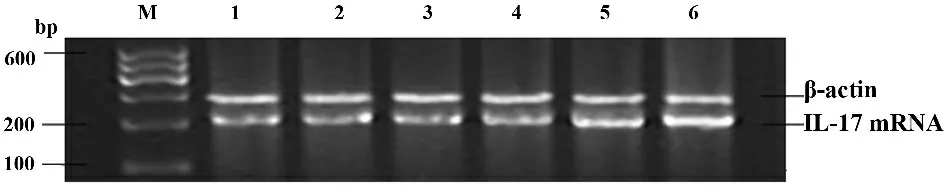
图4 各组新生鼠脾脏IL-17 mRNA 电泳图Fig.4 Images of IL-17 mRNA production in spleen of newborn mice
表3 小鼠脾脏组织RORγt mRNA、IL-17 mRNA 相对灰度值(n=8,±s)Tab.3 Expression of RORγt mRNA,IL-17 mRNA in spleen of newborn mice(n=8,±s)

表3 小鼠脾脏组织RORγt mRNA、IL-17 mRNA 相对灰度值(n=8,±s)Tab.3 Expression of RORγt mRNA,IL-17 mRNA in spleen of newborn mice(n=8,±s)
Note:Viral group compared with the control group in the corresponding point.
2.3 脾组织RORγt mRNA、IL-17 mRNA 表达水平变化(见表3,图3、4) 病毒组小鼠自感染第3d 脾脏组织中RORγt mRNA、IL-17 mRNA 表达水平均开始升高,至第7 天维持较高水平,直至第14 天达到峰值,且第7、14 天时表达量均高于对照组,两两比较差异有统计学意义(P <0.05);对照组各时点RORγt mRNA、IL-17 mRNA 表达水平差异无统计学意义(P >0.05)。
3 讨论
持续病毒感染造成的机体慢性感染性疾病是目前广受关注的世界性问题,而持续反复感染造成的机体慢性损伤与免疫系统调节密切相关。Th17 细胞是近年来新发现的一个T 细胞亚群,主要由CD4+T 淋巴细胞分泌产生,以分泌IL-17 因子为特征而不同于传统的Th1 和Th2 细胞[5]。IL-17 参与多种疾病的发生发展,在调节自身免疫及介导炎症反应和防御病原菌感染方面起着不可替代的作用。IL-17 通过上调凋亡分子表达来抑制病毒感染细胞的凋亡,并抑制细胞毒性T 细胞,从而降低其清除病毒的能力。我们的研究发现,在巨细胞病毒感染新生鼠体内,随着感染时间的延长,其MCMV-DNA表达量逐渐升高,而IL-17mRNA 的表达量变化与巨细胞病毒量具有明显的相关性,我们推测病毒的不断复制与IL-17 高表达引起的免疫功能失衡有关。
RORγt 是维甲酸相关孤儿核受体家族成员之一,表达于Th17 等细胞内,受STAT-3 的调控[6],它可引起IL-17A-IL-17F 基因座的染色质重塑,从而开放IL-17 的基因座位,并可直接结合到IL-17 启动子的ROR 反应原件上,诱导初始Th 细胞中的IL-17基因转录,在低浓度的IL-6 与TGF-β 协同作用下诱导Th17 细胞的生成。有研究表明,在初始T 细胞内转入编码RORγt 的逆转录病毒可以诱导其分化为Th17 细胞,分泌IL-17,相反在RORγt 基因敲除的小鼠中Th17 细胞分化严重受损[7],这证明了RORγt 在Th17 细胞分化中的重要作用。
本研究为探讨RORγt、IL-17 与鼠巨细胞病毒感染的关系,应用RT-PCR 法分析了MCMV 感染新生鼠与正常新生鼠脾脏组织中RORγt mRNA、IL-17mRNA 表达的差异,并进一步采用Western blot 法检测两组新生鼠脾脏中RORγt 蛋白的表达变化,结果显示,IL-17mRNA、RORγt mRNA 及蛋白在病毒组的表达明显高于对照组(P <0.05),且其表达在注射病毒后第14 天达到最高水平,这提示在巨细胞病毒感染急性期,尤其是在病毒血症期,病毒可以刺激脾脏组织中的单核巨噬细胞等分泌大量的炎症因子,如:IL-6、TGB-β,在炎症因子的协同作用下,引起CD4+T 细胞内RORγt 基因和蛋白高表达,进而诱导初始T 淋巴细胞向Th17 细胞分化,除此之外,RORγt 还可以诱导IL-23 受体表达,维持Th17 细胞的存活并促进其增殖[7],Th 细胞大量产生,分泌大量IL-17,后者与中性粒细胞、嗜酸性粒细胞、上皮细胞等炎性细胞表面的IL-17 受体结合后,使其释放各种趋化因子、炎症介质,诱导大量炎症细胞聚集至炎症部位[8],引起脾脏的病理损伤。
Th17 与巨细胞病毒的发生发展关系密切,通过抑制Th17 的分化可以减少巨细胞病毒的复制,而针对Th17 细胞的特异性转录因子RORγt 的干预手段将有可能抑制Th17 细胞,寻找RORγt 抑制剂可能成为治疗巨细胞病毒新靶点。
[1]刘玲玲,李旭芳,秦文卿,等.IL-17A 参与巨细胞病毒感染后脾脏病理改变的机制研究[J].中华微生物学和免疫学杂志,2013,33(3):188-192.
[2]Almolda B,Costa M,Montoya M,et al.Increase in Th17 and T-reg lymphocytes and decrease of IL22 correlate with the recovery phase of acute EAE IN rat[J].PloS One,2011,6(11):e27473.
[3]张恩胜,王 军,万雪媛,等.Th17 相关性细胞因子在新生小鼠MCMV 肝炎中的表达及意义[J].中国免疫学杂志,2013,29(1):57-61.
[4]张恩胜,王 静,王 军,等.新生小鼠巨细胞病毒肝炎模型的建立[J].中国新生儿科杂志,2013,28(5):339-342.
[5]刘高勤,吴鸿雅,张光波,等.人重组IL-17/His 蛋白的原核表达、纯化及其生物学活性[J].细胞与分子免疫学杂志,2007,23(8):715-718.
[6]Yang XO,Panopoulos AD,Nurieva R,et al.STAT3 regulates cytokine-mediated generation of inflammatory helper T cells.[J].J Biol Chem,2007,282(13):9358-9363.
[7]Ivanov II,McKenzie BS,Zhou L.The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+T helper cells[J].Cell,2006,126(06):1121-1133.
[8]胡斯明,罗雅玲,赖文岩,等.哮喘小鼠肺组织中转录因子RORγt 的表达与气道炎症的关系[J].中国免疫学杂志,2009,25(4):364-368.