Ⅱ型前胶原羧基末端前肽对骨性关节炎早期诊断价值的实验研究
李明宇,安 宇,侯利民(哈尔滨医科大学附属第一医院急诊外科,哈尔滨 150001)
·论 著·
Ⅱ型前胶原羧基末端前肽对骨性关节炎早期诊断价值的实验研究
李明宇,安 宇,侯利民△
(哈尔滨医科大学附属第一医院急诊外科,哈尔滨 150001)
目的 通过建立大鼠骨性关节炎(OA)模型,研究大鼠血清和关节液中Ⅱ型前胶原羧基末端前肽(PⅡCP)水平变化,探讨体液PⅡCP对早期OA的诊断价值。方法 将Wistar大鼠随机分成OA模型组和假手术组,用改良Hulth法诱导大鼠膝关节OA模型。分别于造模后1~5周,每周每组抽取6只大鼠取关节液、血清及关节标本,用ELISA检测体液PⅡCP水平,关节软骨行大体观察评分和组织病理学评分。所得数据用方差分析比较各时间点两组间的差异性,比较PⅡCP水平和软骨评分随时间的变化规律,用Pearson相关系数和线性回归分析来检验体液PⅡCP水平的相关性。结果OA模型组在术后第1周软骨组织学表现接近假手术组,从第2周开始逐渐出现明显的OA病理学改变,假手术组软骨组织学无明显改变。OA模型组体液PⅡCP水平从术后第1周开始较假手术组明显增高,并随时间推移差异性逐渐增大;假手术组体液PⅡCP始终维持在较低水平;血清与关节液PⅡCP水平具有良好相关性。结论 大鼠OA模型中,血清和关节液PⅡCP水平在软骨出现明显病理变化之前就已经升高,PⅡCP水平与OA病理变化相符合,关节液和血清PⅡCP水平可作为OA早期诊断的参考指标。
骨性关节炎; Ⅱ型前胶原羧基末端前肽; 软骨; 诊断
骨性关节炎(OA)是一种普遍流行的慢性疾病,是引起中老年人关节疼痛和功能障碍的常见原因之一,发病率高,影响大约40%年龄超过70岁的老年人[1],且随着老龄化及肥胖人口增多,其发病率将持续升高。OA起始阶段是隐匿的,症状出现时往往已至中晚期,不可逆转,所以如何早期诊断OA成为关键。现有OA检查方法如X线片、MRI、关节镜等由于本身缺陷或滞后性而不能早期诊断OA,因此寻找能早期诊断和监测病情的生物标记物已成为当今研究热点。
当OA发生、发展时关节软骨最先遭到破坏,软骨代谢失衡,代谢产物在体液中明显变化,所以软骨代谢标记物备受关注。其中Ⅱ型前胶原羧基末端前肽(PⅡCP)是关节软骨Ⅱ型胶原合成过程中的产物,体液PⅡCP水平能反映软骨分子水平的代谢情况,有研究证实OA患者血清和关节液PⅡCP水平高于健康人,且较影像学更敏感[2]。本实验旨在通过建立大鼠OA模型,研究OA早期大鼠血清及关节液PⅡCP水平的变化和关联,同时观测软骨组织学变化,探讨体液PⅡCP变化对早期OA的诊断价值。
1 材料与方法
1.1 实验动物及分组 取清洁级Wistar成年雄性大鼠60只,体质量250~300 g,购于吉林大学医学院,饲养于哈尔滨医科大学附属第一医院实验动物中心。将60只大鼠随机分成两组:OA模型组(30只),假手术组(30只)。
1.2 方法
1.2.1 造模方法 采用改良Hulth法即前交叉韧带切断术来诱导大鼠膝关节OA模型,10%水合氯醛按0.3 mL/100 g行腹腔注射麻醉,在无菌条件下于左膝髌旁内侧做纵行切口约1 cm,屈膝状态下切断前交叉韧带,逐层缝合伤口,待麻醉清醒后放回笼中。假手术组显露前交叉韧带后缝合关节囊,其余同模型组。
1.2.2 取材、处理及关节软骨大体评分 于造模后1~5周每周每组随机抽取6只大鼠,用心脏穿刺术采集血液约4 mL,注入血清管;用1 mL注射器吸取0.2 mL 0.9%生理盐水刺入关节腔,进行反复抽吸,将抽吸液注入血清管,记录稀释倍数。室温放置10 min后,离心机以3 000 r/min离心20 min,收集上清液于EP管,放入-20 ℃冰箱中冻存备用。处死大鼠取关节标本,肉眼观察软骨外观、色泽、边缘、透明度以及表面有无充血、软化、裂隙等情况,进行大体观察评分[3]。
1.2.3 关节软骨组织病理学检查 关节标本经多聚甲醛固定,常规脱钙,石蜡包埋,切片,行苏木精-伊红染色(HE)和阿利新蓝染色,在显微镜下观察软骨的组织学特征。病理检查由两位病理科专家进行,依据软骨结构、细胞、基质染色及潮线完整性进行Mankin评分分级[4]:0~1分正常,>1~6分轻度软骨损伤,>6~10分中度损伤,>10~14分重度损伤。 采用酶联免疫吸附试验(ELISA)试剂盒(美国R&D公司)检测血清及关节液PⅡCP水平,用酶标仪在450 nm波长测量各孔吸光度值并计算浓度。关节稀释液PⅡCP浓度乘以稀释倍数,得到关节液PⅡCP浓度。
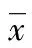
2 结 果
2.1 关节标本大体观察 各时间点假手术组软骨表面光滑,色泽明亮,呈淡蓝色。术后1周,OA模型组软骨同假手术组差异不大,大体评分约为0.3分;术后2周,软骨色泽稍淡,透亮度减低,约为0.5分;术后3周,软骨面灰暗、粗糙,见细小裂纹,约为1分;术后4周,软骨面苍白,粗糙加重,裂纹较多,出现溃烂,约为2分;术后5周,内外髁面凹凸不平,多个细小溃烂,未见明显软骨剥脱,约为2.5分(图1)。在不同时间点,比较大体评分(表1)示:OA模型组与假手术组相比差异均有统计学意义(P<0.05)。OA模型组大体评分随时间变化明显增加,差异有统计学意义(F=206.31,P<0.05)。

图1 各时间点大鼠关节软骨的大体观
2.2 关节软骨组织病理学观察 各时间点观察到假手术组软骨基质呈均匀蓝色,表面无粗糙改变、无裂隙,细胞无簇集现象。术后1周,OA模型组软骨组织学接近假手术组;术后2周,基质色泽改变,出现细胞排列紊乱、簇集;术后3周,出现粗糙及纤维化改变,基质染色不均,细胞排列紊乱加重,可见软骨陷窝,潮线基本完整;术后4周,表面粗糙、裂隙、纤维化,细胞散在增生及簇集明显,潮线不清;术后5周,表层出现缺损区及溃烂,局部潮线消失,软骨下骨骨小梁断裂、钙化层模糊,阿利新蓝染色部分层次失染(图2)。在不同时间点,比较Mankin评分(表2)示:OA模型组与假手术组比较差异均有统计学意义(P<0.05)。OA模型组Mankin评分随时间变化明显增加,差异有统计学意义(F=309.56,P<0.05)。
2.3 血清及关节液PⅡCP水平 血清及关节液PⅡCP浓度显示:在各时间点OA模型组血清及关节液PⅡCP浓度与假手术组相比差异均有统计学意义(P<0.05),见表3、4。OA模型组血清及关节液PⅡCP浓度随时间变化明显升高,差异有统计学意义(F=250.50,P<0.05)。模型组血清PⅡCP浓度随着关节液PⅡCP浓度的升高而升高,血清PⅡCP浓度为(8.06±3.13)ng/mL,关节液PⅡCP浓度为(42.21±15.56)ng/mL,两者相关分析说明关节液和血清PⅡCP水平呈明显正相关(r=0.919,P<0.05),可得出一般线性回归方程:血清PⅡCP浓度=0.197×关节液PⅡCP浓度-0.239;在各时间点假手术组血清和关节液PⅡCP始终处于较低水平,随时间变化不明显(P>0.05)。

表1 术后不同时间关节软骨的大体观察评分±s,分)
注:与假手术组比较,*P<0.05。
注:每周的两幅图片中,左边图片为HE染色(×100),右边图片为阿利新蓝染色(×40)。

图2 各时间点大鼠关节软骨的病理学观察
注:与假手术组比较,*P<0.05。

表3 大鼠血清中PⅡCP浓度变化±s,ng/mL)
注:与假手术组比较,*P<0.05。

表4 大鼠关节液中PⅡCP浓度变化±s,ng/mL)
注:与假手术组比较,*P<0.05。
3 讨 论
3.1 大鼠OA模型的建立OA造模方法有多种,最常用的为Hulth法:切断前后交叉韧带、内侧副韧带及内侧半月板,造成膝关节极不稳定,力学传导改变,诱导OA模型。Stoop等[5]在不同时间点对大鼠行前交叉韧带切断法诱导OA模型,发现关节软骨组织学变化符合早中期OA的特征。Hayami等[6]研究发现前交叉韧带切断法诱导大鼠OA模型能较好地反映OA的进展过程。本实验采用的是改良Hulth法,即单纯切断前交叉韧带,此法操作简单、创伤小,对关节结构改变较少,切除前交叉韧带可使力学传导产生改变,可诱发软骨退变,能较好地模拟OA病理变化。
本实验关节标本大体评分和组织学评分均与文献报道基本相符:术后1周,模型组与假手术组比较差异不明显;术后2周开始出现软骨色泽改变,细胞增生及排列紊乱;术后3周出现软骨表面粗糙及纤维化,基质染色不均,细胞簇集生长;术后4周出现软骨表面裂隙,细胞簇集生长明显,排列明显紊乱;术后5周软骨表面溃烂并出现软骨缺损区,局部潮线消失。改良Hulth法能较好地复制OA早中期组织学特征,比较适合OA发病机制和早期诊断方面的研究。
3.2 体液PⅡCP与软骨损伤和退变的关系 在正常软骨中,基质合成和分解代谢处于平衡状态;当OA发生、发展时,代谢平衡被打破,代谢速率相应加快。PⅡCP是Ⅱ型胶原合成过程中的产物,可在体液中通过免疫法进行浓度测定,在无软骨损伤或退变时体液PⅡCP浓度始终维持在较低水平。因Ⅱ型胶原特异性地表达在软骨组织中,所以PⅡCP能特异性地反映软骨代谢情况。Shinmei等[7]对中等程度膝关节OA患者进行研究,结果显示关节液PⅡCP浓度显著高于正常对照组,表明关节液PⅡCP水平能反映软骨Ⅱ型胶原的合成功能及软骨受损程度。Hotta等[8]研究兔OA模型的早期阶段PⅡCP关节液浓度与mRNA表达情况,结果表明在OA不同阶段软骨合成功能不同,中度OA时软骨细胞在退变区域的合成作用最强,退变加重时合成作用逐渐减低,但可观察到在OA晚期软骨修复仍存在。体液PⅡCP水平变化可反映OA发展的不同阶段。
本实验建立早期OA模型,通过研究发现术后1周时OA模型组大体评分及病理学评分均高于假手术组(P<0.05),OA模型组血清与关节液PⅡCP水平均明显高于假手术组(P<0.05),说明模型组在软骨出现轻微病理变化时体液PⅡCP水平就已明显升高;OA模型组在各时间点血清及关节液PⅡCP水平均明显高于假手术组(P<0.05),并随时间推移不断升高,其差异性与病理表现出的差异性相符,说明早期OA时软骨损伤逐渐加重,体液PⅡCP水平逐渐升高,表明体液PⅡCP水平能反映关节软骨情况。
3.3 体液PⅡCP与OA病情进展的关系 体液PⅡCP水平可用于预测OA进展。Lohmander等[2]发现膝关节OA患者关节液PⅡCP浓度明显增加,随诊结果发现关节液PⅡCP浓度逐渐升高,1~4年内达到峰值,这时X线片表现出OA改变,随着OA发展,软骨分解大于合成,关节液PⅡCP浓度逐渐下降,监测体液PⅡCP水平可作为预测OA进展的指标。Sugiyama等[9]对早期OA女性患者进行4年随访,结果表明体质量指数与PⅡCP水平轻度正相关,关节间隙狭窄程度与PⅡCP水平呈正相关,关节液PⅡCP水平能预测早期膝关节OA的影像学进展。Cibere等[10]研究发现高水平血清PⅡCP降低影像学OA的发生风险。
本实验从术后1~5周OA模型组与假手术组比较,软骨评分差异均逐渐增大(P<0.05),逐渐出现软骨色泽改变、细胞增生、排列紊乱,到表面凹凸不平、软骨缺损,符合OA早期组织学特征,而体液PⅡCP水平随OA进展逐渐升高(P<0.05),表明体液PⅡCP可用于预测OA进展。
3.4 体液PⅡCP对OA的早期诊断意义OA是普遍发病的退变性疾病,随着人口老龄化及肥胖人口增多,此病的发病率将持续升高,所产生的社会和经济负担将继续增加。由于OA症状出现时往往已发展至中晚期,不可逆转,早期诊断OA至关重要,现有的检查方法都是基于软骨形态学变化,敏感性及精确度都欠佳,对早期诊断OA存在滞后性。生物标记物能在影像学变化之前就反映出软骨代谢改变,且能识别高危人群、反映OA治疗效果。
软骨源性代谢产物能监测软骨合成和降解情况,在代谢过程中代谢产物进入体液中,利用生化检测法可特异性地检测出浓度,PⅡCP就是满足要求的生物标记物。实验发现OA软骨发生轻微组织学变化时,体液PⅡCP水平就已经升高,与假手术组差异显著。关节液PⅡCP浓度明显高于血清,且与血清PⅡCP具有良好相关性,提示血清PⅡCP来源于关节,而且体液PⅡCP水平随OA进展而逐渐升高,说明体液PⅡCP水平反映OA病理变化过程,可作为OA早期诊断及评价进展程度的指标。另外本实验只是检测一种软骨生物标记物,仅研究体液PⅡCP对大鼠OA的早期诊断价值,有可能忽略其他重要生物标记物。有研究报道患者与对照组生物标记物水平有重叠部分,表明当前研究的生物标记物在个体水平上用作诊断工具还不够敏感,可考虑标记物联合应用来提高诊断的精确性。体液PⅡCP与其他标记物联合应用提高OA诊断的准确性,以及PⅡCP对人类OA早期诊断价值的研究还有待进一步研究。
[1]OlivieroF,RamondaR,PunziL.Newhorizonsinosteoarthritis[J].SwissMedWkly,2010,140:w13098.
[2]LohmanderLS,YoshiharaY,RoosH,etal.ProcollagenⅡC-propeptideinjointfluid:changesinconcentrationwithage,timeafterkneeinjury,andosteoarthritis[J].JRheumatol,1996,23(10):1765-1769.
[3]PellerierJP,JovanovicD,FemandesJC,etal.Reducedprogressionofexperimentalosteoarthritisinvivobyselectiveinhibitionofinduciblenitricoxidesynthase[J].ArthritisRheum,1998,41(7):1275-1286.
[4]MankinHJ,DorfmanH,LippielloL,etal.Biochemicalandmetabolicabnormalitiesinarticularcartilagefromosteoarthritichumanhips[J].JBoneJointSurg,1971,53(3):523-537.
[5]StoopR,BumaP,KrannM,etal.TypeⅡcollagendegradationinarticularcartilagefibrillationafteranteriorcruciateligamenttransectioninrats[J].OsteoarthritisCartilage,2001,9(4):308-315.
[6]HayamiT,PickarskiM,ZhuoY,etal.Characterizationofarticularcartilageandsubchondralbonechangesintheratanteriorcruciateligamenttransectionandmeniscectomizedmodelsofosteoarthritis[J].Bone,2006,38(2):234-243.
[7]ShinmeiM,ItoK,MatsuyamaS,etal.JointfluidcarboxyterminaltypeⅡprocollagenpeptideasamarkerofcartilagebiosynthesis[J].OsteoarthritisCartilage,1993,1(2):121-128.
[8]HottaH,YamadaH,TakaishiH,etal.TypeⅡcollagensynthesisinthearticularcartilageofarabbitmodelofosteoarthritis:expressionoftypeⅡcollagenC-propeptideandmRNAespeciallyduringearly-stageosteoarthritis[J].JOrthopSci,2005,10(6):595-607.
[9]SugiyamaS,ItokazuM,SuzukiY,etal.ProcollagenⅡCpropeptidelevelinthesynovialfluidasapredictorofradiographicprogressioninearlykneeosteoarthritis[J].AnnRheumDis,2003,62(1):27-32.
[10]CibereJ,ZhangH,GarneroP,etal.Associationofbiomarkerswithpre-radiographicallydefinedandradiographicallydefinedkneeosteoarthritisinapopulation-basedstudy[J].ArthritisRheum,2009,60(5):1372-1380.
Experimental research of early diagnostic value of C-terminal propeptide of type Ⅱ procollagen for osteoarthritis
LIMing-yu,ANYu,HOULi-min△
(DepartmentofEmergencySurgery,FirstAffiliatedHospital,HarbinMedicalUniversity,Harbin,Heilongjiang150001,China)
Objective To study the diagnostic value of C-terminal propeptide of type Ⅱ procollagen(PⅡCP) in early osteoarthritis(OA) through monitoring the changes of PⅡCP in the synovial fluid and serum of the OA model rat.Methods Wistar rats were randomly divided into the OA model group and the sham operation group.The rat knee-joint OA model was induced by the improved Hulth surgery method.The synovial fluid,serum and joint specimens were weekly taken from 6 rats in each group at 1-5 weeks after modeling,the serum and synovial fluid PⅡCP levels were measured by ELISA.The general observation score and histopathological score of articular cartilage were obtained.The differences at various time points were compared between the two groups and the change rule of PⅡCP levels and cartilage scores with time was compared.The Pearson correlation coefficient and linear regression analysis were adopted to test the correlation between serum and synovial fluid PⅡCP levels.Results The histologic manifestations of cartilage at postoperative 1 week in the OA model group were similar to those in the sham operation group,and the obvious pathologic change gradually started to appear at postoperative 2 weeks.The cartilage histology of the sham operation group had no obvious change.Compared with the sham operation group,the serum and synovial fluid PⅡCP levels in the OA model group started to obviously increase at postoperative 1 week,and the difference was gradually increased with time lapse;the humoral PⅡCP levels of the sham operation group maintained a lower level from beginning to end;the serum PⅡCP level had a good correlation with the synovial fluid PⅡCP level.Conclusion In rat OA model,the serum and synovial fluid PⅡCP levels are increased before the cartilage appears obvious pathological change,and the PⅡCP levels are consistent with the OA pathological change,so the serum and synovial fluid PⅡCP levels could be used as the reference indicators of OA early diagnosis.
osteoarthritis; C-terminal propeptide of type Ⅱ procollagen; cartilage; diagnosis
李明宇,男,医师,硕士,主要从事急诊创伤及关节外科研究。△
,E-mail:houlimin1969@163.com。
10.3969/j.issn.1672-9455.2015.22.019
A
1672-9455(2015)22-3342-03
2015-05-12
2015-09-11)

