人外周血淋巴细胞染色体标本的制备研究
徐本锦,刘 玲
(山西医科大学汾阳学院,山西汾阳 032200 )
人外周血淋巴细胞染色体标本的制备研究
徐本锦,刘 玲
(山西医科大学汾阳学院,山西汾阳 032200 )
外周血淋巴细胞; 染色体; 分裂相; 秋水仙素
1960年,Moorhead等建立了一套比较完整的外周血体外培养和染色体制备方法,该技术能够清晰的显示染色体数目和结构上的变化,对于常见遗传性疾病的快速诊断,提高人口素质具有十分重要的作用,对我国优生优育工作意义重大[1]。但该技术对细胞的培养时间较长,使得实验易受温度、pH、溶血和凝血等因素影响而导致失败[2]。为了临床上能高效、快速、准确地诊断遗传性疾病,有学者已经报道了该技术的一些心得体会[3-5]。本研究立足于获得高质量的人外周血染色体标本和提高实验教学的可操作性,对该技术的4个影响因素进行了优化,现将研究结果报道如下。
1 资料与方法
1.1 一般资料 随机选取8名健康男性和8名健康女性进行外周血采集,使用肝素抗凝。
1.2 仪器与试剂 培养箱,光学显微镜,香柏油,乙醇灯,离心机,恒温培养箱,人外周血淋巴细胞培养液(湖南湘雅基因技术有限公司),秋水仙素(20 μg/mL),低渗液(0.075 mol/L 氯化钾溶液),固定液(甲醇∶冰醋酸=3∶1),Giemsa染液,500 U/mL肝素。
1.3 方法
1.3.1 实验方法 采血:采用10 mL一次性注射器吸取少量肝素润湿针管,将多余肝素排出。接种:在无菌条件下,用注射器针头刺透培养瓶橡皮塞,向培养瓶内注入成年男子全血26滴,或成年女子全血28滴,轻轻摇匀。培养:将培养瓶放入37 ℃恒温培养箱内培养72 h[6]。细胞同步化:外周血淋巴细胞培养68~70 h后,用5 mL注射器针头加入5滴20 μg/mL秋水仙素,然后接着培养3~4 h[6]。细胞收集:从培养箱拿出培养瓶,摇匀之后直接倒入10 mL刻度离心管,以2 000 r/min离心10 min。低渗:弃上清,用注射器加入8 mL 37 ℃水浴的低渗液,混匀后37 ℃恒温水浴30 min[6]。预固定:低渗结束后,立即加入1 mL固定液,混匀之后以2 000 r/min离心10 min。固定:弃上清,加入8 mL固定液,混匀后室温固定30 min,然后以2 000 r/min离心10 min,弃上清。再固定:加入8 mL固定液,用吸管吹打,充分混匀后室温静置30 min或过夜。滴片:再次以2 000 r/min离心10 min,弃上清,然后每个离心管里加入5~6滴新鲜配制的固定液,吹打混匀制成细胞悬液。将细胞悬液3滴,滴到冰冻的载玻片上,滴片高度30 cm,随即吹开,酒精灯上烘干,贴标签。染色:用1∶10 Giemsa染液37 ℃条件下染色10 min,自来水冲洗,晾干后镜检[6]。
1.3.2 实验原理 培养:人外周血淋巴细胞在体外培养72 h,大部分淋巴细胞处于增殖周期内。同步化:培养期间,利用秋水仙素对细胞进行同步化处理,使大部分细胞都停滞在有丝分裂的中期。低渗:淋巴细胞经低渗液处理,会吸水而胀破,释放出染色体。固定:利用低渗液对染色体进行固定,有助于维持其完整的形态。染色:利用Giemsa染液对染色体进行着色,便于显微镜下观察。
1.3.3 关键因素优化 通过文献资料和笔者长期的实验经验,本研究选取了4个影响实验结果的关键因素进行条件优化,分别对秋水仙素加入时间、低渗时间、固定时间和染色时间设定梯度,其他条件保持不变,通过多次尝试和反复摸索,找到最佳时间组合,确定最优实验条件。具体时间梯度如表1所示。
2 结 果
通过对秋水仙素加入时间、低渗时间、固定时间和染色时间进行优化,找到这4个影响因素的最佳作用时间分别为2.5 h、20 min、25 min和20 min。具体结果如图1所示。
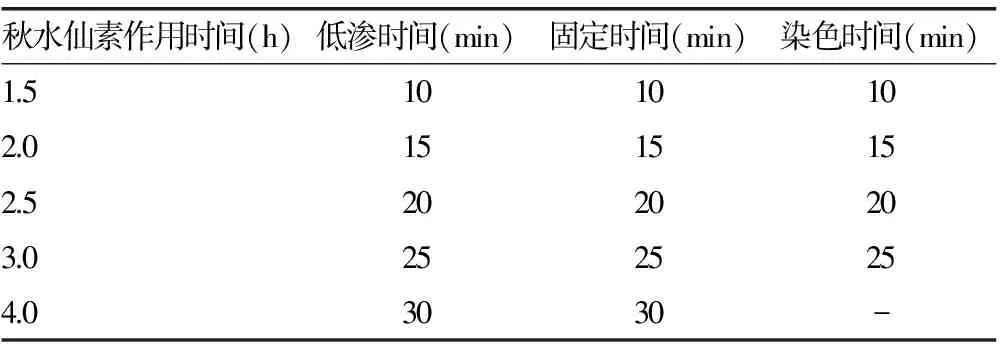
表1 4个关键因素的时间梯度
注:-表示无数据。
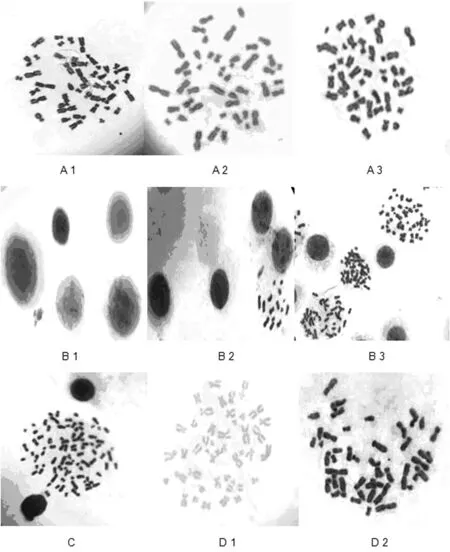
注:A1~A3表示优化后的染色体核型;B1~B2表示低渗时间小于或等于15 min;B3表示低渗时间等于20 min;C表示固定时间小于或等于20 min;D1表示染色时间小于或等于15 min;D2表示染色时间大于或等于25 min。
图1 各类条件下的实验结果(100×10)
3 讨 论
人外周血染色体分析技术在遗传性疾病的诊断中发挥着十分重要的作用,在一些医院的生殖医学科,该专门技术得到了广泛的应用。随着一些新的遗传性疾病的报道及产前产后诊断的日益广泛,诊断的高效率和准确结果的保障是该技术应用过程中亟待解决的问题。因此,有必要对影响实验结果的关键因素进行优化,使其更好地服务于教学实验或临床。
该技术对细胞进行同步化、低渗和固定处理,从而获得大量形态清晰、数目完整的优质分裂相。通过查阅文献和笔者长期的实验经验,本研究选取了4个影响实验结果的关键因素进行条件优化,分别是秋水仙素的加入时间、低渗时间、固定时间和染色时间。
秋水仙素是一种有丝分裂阻断剂,通过抑制纺锤体的形成来阻止细胞分裂,可使细胞分裂停留在中期,从而得到大量的中期细胞[7]。若秋水仙素作用超时,一方面会对细胞产生毒性,影响细胞分裂,使分裂指数减少;另一方面,会使染色体缩短变粗,最终使染色体丢失而导致实验失败。因此,确定好秋水仙素的作用时间非常重要。通常认为,在终止培养前3~4 h内加入秋水仙素。实验期间发现,秋水仙素的作用时间在1.5~4.0 h时,虽能在显微镜下找到理想的分裂相,但是,当时间小于等于2.0 h时,停滞在中期的细胞数目会减少,并且有相当数量的细胞处于其他分裂时期,这与谢志威等[8]报道的秋水仙素加入太少或处理时间偏短,可导致染色体形态偏长或无中期分裂相一致。当秋水仙素加入时间大于等于3.0 h时发现,大部分细胞处于分裂中期,但染色体变得又粗又短,不利于观察。而当作用时间为2.5 h时,可获得数目多、浓缩适中的染色体。
低渗处理的目的是诱导淋巴细胞吸水胀破,有助于染色体从细胞分散出来。低渗时间过长(45~60 min),会导致染色体长度增加,黏度增大,影响分散程度,也不利于后续的显带。Henegariu等[9]认为低渗处理10 min就可以得到理想的结果。因此,低渗时间是本实验成败的一个关键。研究中发现,当低渗时间不超过15 min时,绝大部分细胞没有破裂,形态完整,未能释放出核内的染色体(图B1),偶尔也能看到几条染色体,但数目不够,有的染色体还被细胞膜或细胞质包裹,形态不清,这也许是细胞破裂不充分导致的(图B2),主要原因是低渗时间不够,大部分细胞没能充分与低渗液相互作用。若低渗时间超过25 min,则会使细胞过早破裂,导致染色体丢失。当低渗时间调整为20 min时,发现很多细胞破裂并释放出染色体,达到了实验要求(图B3)。
染色体释放出来之后,为了维持其形态,得到一个分散良好的分裂相,需要使用固定液对染色体进行固定操作。通过五个时间梯度的实验发现,固定时间不超过20 min时,有的染色体散的太开,不利于观察,或者相邻2个细胞的染色体混在了一起(图C),无法辨别,不便于计数,也加大了后续核型分析的难度。当固定时间为25 min时,染色体分散良好,有很多完整的分裂相,且质量较高(图B3)。
染色是本实验的最后一步,通过4个染色时间的尝试,结果显示,染色时间不超过15 min时,染色体着色很淡,亮度不够,甚至看不清楚(图D1),也不美观。当染色时间大于等于25 min时,染色体又着色太深,形态不清晰,还会使玻片的背景过深,且不易冲洗,同样对结果有很大影响(图D2)。最终发现,当这4个时间分别为2.5 h,20 min,25 min和20 min时,能够得到高质量的染色体(图A1,A2和A3)。同时,在满足上述条件的前提下,还应注意以下几点:(1)淋巴细胞培养期间,要经常摇动培养瓶,避免培养基与细胞分层,影响细胞增殖。(2)为了获得分裂指数较多,形态清晰,长短适中,分散良好的染色体,培养时间需在70~72 h。(3)收集细胞时,要摇匀培养液,然后将细胞和培养液全部转入离心管,否则会造成细胞数量的减少。(4)离心后需弃去上清液的,应尽快除去上清液,否则会引起沉淀溶解,造成细胞丢失。(5)低渗液加入后,必须混匀完全,让细胞与其充分接触,否则会影响染色体的释放。(6)滴片时必须使用冰冻的载玻片,且滴片高度在30 cm左右,否则会影响染色体的分散程度[10]。
综上所述,经过反复摸索,本研究得到了高质量的中期染色体,这不仅有助于后续的显带和核型分析,也有助于实验教学的顺利开展。然而,外周血染色体制备技术目前还没有统一的质量控制体系,该技术所用试剂的浓度、生产厂家,以及实验室条件和设备等诸多因素参差不齐,再加上人为因素等,均会对染色体的质量产生影响。因此,无论是科技工作者还是医务人员,都应本着相互学习的态度,取长补短,以获得高质量的染色体标本。
[1]药泽榕,魏魏,苗聪秀.外周血淋巴细胞培养制备染色体改良方法的研究[J].中国优生与遗传杂志,1993,1(2):45-46.
[2]赵小平,陈绍坤,黄燕,等.外周血淋巴细胞培养及染色体制备过程中的问题分析[J].现代预防医学,2009,36(11):2108-2112.
[3]马强,刘青松,蔡燕,等.外周血淋巴细胞培养及染色体制备的几点体会[J].国际检验医学杂志,2011,32(14):1641-1642.
[4]任莉萍,李娟,潘亚丽,等.人的外周血淋巴细胞培养及染色体制作技术[J].生物学通报,2011,46(3):54-55.
[5]徐文瑜,陈彦明,黄月娇.外周血染色体制备成功方法的探讨[J].中国社区医师,2013,15(8):222-223.
[6]钟慧军,陆宏.细胞生物学实验教学指导[M].西安:第四军医大学出版社,2009:36-38.
[7]刘爱生,朱春燕.外周血淋巴细胞培养及染色体高分辨标本制备方法[J].中国优生优育,2013,19(2):82-85.
[8]谢志威,张晶,李卫凯.外周血染色体制备改良方法的应用[J].国际检验医学杂志,2013,34(1):82-83.
[9]Henegariu O,Heerema NA,Wright LL,et al.Improvements in cytogenetic slide preparation:controlled chromosome spreading,chemical aging and gradual denaturing[J].Cytometry,2001,43(2):101-109.
[10]侯艳香.人外周血淋巴细胞培养染色体制备及影响因素[J].检验医学与临床,2013,10(7):874-875.
10.3969/j.issn.1672-9455.2015.15.070
B
1672-9455(2015)15-2296-03
2015-03-18
2015-05-20)

