赖氨大黄酸通过调控miRNA表达水平抑制HBV增殖*
张荣花,王密斯,王 琳,冯雪研,郝晓方,甄永占,李 琳,陈 静,章广玲,2△
(1.华北理工大学基础医学院病原生物学与免疫学教研室,河北唐山 063000;2.河北省唐山市慢性病临床基础研究重点实验室 063000)
·论 著·
赖氨大黄酸通过调控miRNA表达水平抑制HBV增殖*
张荣花1,王密斯1,王 琳1,冯雪研1,郝晓方1,甄永占1,李 琳1,陈 静1,章广玲1,2△
(1.华北理工大学基础医学院病原生物学与免疫学教研室,河北唐山 063000;2.河北省唐山市慢性病临床基础研究重点实验室 063000)
目的 研究赖氨大黄酸在体外对乙型肝炎病毒(HBV)增殖及病毒抗原表达的影响及分子机制,为研究赖氨大黄酸抗HBV作用机制奠定初步的实验依据。方法 将HepG2.2.15细胞分为实验组(分别加入5、10、20、40、80 μmol/L赖氨大黄酸)及不加赖氨大黄酸的对照组,分别培养24、48 h收获上清液,采用四唑氮化合物(MTS)法检测细胞的增殖活性,采用ELISA法检测HBsAg和HBeAg的表达水平,实时定量PCR(RT-PCT)检测其中HBV DNA的拷贝数及miR-210、miR-185、miR-199a-3p、miR-370、miR-196a、miR-184、miR-217的表达水平。miR-210、miR-185、miR-199a-3p、miR-370、miR-196a、miR-184、miR-217反义链(ASO)分别转染HepG2.2.15细胞后,MTS法检测细胞的增殖活性,ELISA法检测HBsAg和HBeAg的表达水平。结果 在没有对HepG2.2.15细胞的增殖活性产生影响的情况下,赖氨大黄酸抑制了HBsAg的产生和HBV的增殖。20 μmol/L的赖氨大黄酸明显促进了miR-210、miR-185、miR-199a-3p的表达,而抑制了miR-370的表达,与对照组相比较,差异具有统计学意义(P<0.05)。结论 赖氨大黄酸可能通过影响细胞内miRNA的表达抑制HepG2.2.15细胞中HBV的增殖和HBsAg的产生。
赖氨大黄酸; 乙型肝炎病毒; 乙型肝炎病毒表面抗原; miRNA
乙型肝炎病毒(HBV)是一种可引起人类急、慢性肝炎的DNA病毒。虽然有高活性的乙肝疫苗,而且已广泛使用了20多年,但HBV的感染仍然是一个危害全球健康的重大疾病。全球有超过3.5亿的HBV感染者,而且每年急慢性HBV感染致死人数约有一百万。中药对病毒性传染病的作用是肯定的,大黄酸是传统中药大黄中的一个重要蒽醌类化合物,具有广泛的药理活性,如抗炎、抗菌、抗病毒等。不同剂量的大黄酸具有不同的功效。由于大黄酸水溶性差,生物利用度低,其进一步应用受到很大限制。为了改善大黄酸的水溶性,对大黄酸进行结构改造获得了水溶性好的赖氨大黄酸,与大黄酸相比,赖氨大黄酸溶解度显著提高为8 mg/mL,其中的赖氨酸盐是人体8种必需氨基酸之一,安全无不良反应[1]。本项目首次探讨赖氨大黄酸体外对HBV复制的调控作用,确定赖氨大黄酸是否通过调控微小RNA(miRNA)的表达进而影响HBV的蛋白表达和病毒增殖,通过分析赖氨大黄酸与miRNA在HBV感染中的作用,为理解赖氨大黄酸、细胞miRNAs调控病毒增殖提供新的理论依据,也为今后开发抗病毒药物或手段提供新的分子基础或靶点。
1 材料与方法
1.1 材料 四唑氮化合物(MTS)购自美国Sigma公司,ELISA速显检测试剂盒购自英科新创(厦门)科技有限公司。HepG2.2.15细胞由天津医科大学生命科学中心实验室提供。miRNA反义链(ASO)由美国Sigma公司合成。Trizol购自上海生工生物工程技术服务有限公司。专利药赖氨大黄酸由卫生部北京医院/卫生部北京老年医学研究所惠赠。
1.2 方法
1.2.1 HepG2.2.15细胞培养 HepG2.2.15细胞培养基为含20%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的MEM-α,细胞于37 ℃ 5% CO2的细胞培养箱中生长。实验组:赖氨大黄酸浓度分别为5、10、20、40、80 μg/mL。对照组:不加入赖氨大黄酸。细胞转染:转染前1 d,胰酶消化细胞并计数,8 000~11 000 cell/100 μL每孔铺板。分别取miRNA ASO和LacZ基因,分别按Invitrogen公司Oligofectamine Reagent转染试剂盒说明书配制转染试剂/DNA混合液:按每孔0.3 μL Oligofectamine Reagent试剂、30 pmol ASO及90 μL无血清培养基Opti-MEM配制,混匀后加入96孔板中,置于37 ℃ 5% CO2孵箱中培养48 h。实验在同等条件下重复3次。
1.2.2 MTS法检测HepG2.2.15细胞增殖活性 将HepG2.2.15细胞8 000~11 000 cell/100 μL每孔接种于96孔培养板中,24 h贴壁后分别加入5、10、20、40、80 μmol/L浓度的赖氨大黄酸,每个浓度设9个复孔,分别培养24、48 h,吸出上清后,每孔加入培养液100 μL,每孔加MTS 20 μL(MTS:PMS比例为19∶1),置于37 ℃ 5% CO2孵箱继续培养2 h。取出培养板,采用μQuant分光光度计检测波长为490和630 nm的各孔吸光度值(A490和A630)。以(实验孔A490-空白孔A490)/(LacZ孔A490-空白孔A490)作为标准化后的数据,采用SPSS11.0软件包对3个孔的均值进行统计分析,以P<0.05为差异有统计学意义。
1.2.3 ELISA法检测HBsAg和HBeAg 将HepG2.2.15细胞8 000~11 000 cell/100 μL每孔接种于96孔培养板中,24 h贴壁后分别加入5、10、20、40、80 μmol/L浓度的赖氨大黄酸,每个浓度设9个复孔,分别培养48 h,吸出上清液后,按照试剂盒的说明书进行操作。采用μQuant分光光度计检测波长为450和630 nm的各孔吸光度值(A450和A630)。以(实验孔A450-空白孔A450)/(LacZ孔A450-空白孔A450)作为标准化后的数据,采用SPSS11.0软件包对3个孔的均值进行统计分析,以P<0.05为差异有统计学意义。
1.2.4 实时荧光定量PCR(RT-PCR)检测HBV DNA及miRNA 将培养的HepG2.2.15细胞经20 μmol/L赖氨大黄酸处理48 h后,吸出的上清液,按照HBV DNA定量诊断试剂盒(PCR-Fluorescence Probing)说明书进行操作,数据的收集由ABI 7500定量PCR仪自带软件完成。通过软件可以计算出所有标准品和标本的阈值循环(Ct),并且根据标准品Ct值绘制出标准曲线,由标准曲线计算出样品的起始拷贝数Co=10(Ct-Intercept)/slope。同时,根据Takara公司SYBR PrimeScript®miRNA RT-PCR试剂盒说明书加入1 μg的总RNA及反转录反应所需试剂,反应条件为37 ℃ 60 min;85 ℃ 5 s。用反转录合成的cDNA作为模板进行RT-PCR检测miR-210、miR-185、miR-199a-3p、miR-370、miR-196a、miR-184、miR-217的表达水平。
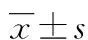
2 结 果
2.1 赖氨大黄酸对HepG2.2.15细胞增殖的影响 MTS法测定结果表明,5、10、20 μmol/L的赖氨大黄酸对HepG2.2.15细胞增殖没有明显的影响,当赖氨大黄酸浓度大于20 μmol/L时能抑制HepG2.2.15细胞增殖(P<0.05),赖氨大黄酸对HepG2.2.15细胞增殖的抑制作用呈浓度和时间依赖性,见表1。

表1 赖氨大黄酸对HepG2.2.15细胞增殖的影响
注:与对照组培养24 h结果比较,*P<0.05;与对照组培养48 h结果比较,#P<0.05。
2.2 赖氨大黄酸对HepG2.2.15细胞中HBsAg和HBeAg表达及HBV复制的影响 选择经MTS法测定,对HepG2.2.15细胞增殖没有明显影响的5、10、20 μmol/L浓度的赖氨大黄酸作用于HepG2.2.15细胞,采用ELISA法检测HBsAg和HBeAg表达水平。加入不同浓度赖氨大黄酸的各实验组分别与对照组比较,最后以对照组结果为“1”进行标准化。ELISA法检测结果表明,5、10 μmol/L的赖氨大黄酸对HBsAg和HBeAg表达没有明显影响;20 μmol/L的赖氨大黄酸能抑制HBsAg和HBeAg表达,与对照组相比较差异具有统计学意义(P<0.05)。采用RT-PCR检测对照组和加入不同浓度赖氨大黄酸的各实验组HBV DNA水平,最后的结果以对照组的值为“1”进行标准化,各实验组分别与对照组比较,结果显示20 μmol/L的赖氨大黄酸抑制了HBV复制,与对照组比较,差异具有统计学意义(P<0.05)。见表2。
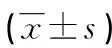
表2 赖氨大黄酸对HepG2.2.15细胞中HBsAg和HBeAg表达水平及HBV复制的影响
注:与对照组比较,*P<0.05。
2.3 miR-210、miR-185、miR-199a-3p、miR-370、miR-196a、miR-184、miR-217、miR-370 ASO转染对HepG2.2.15细胞增殖、HBsAg、HBeAg表达水平的影响 实验筛选对HBsAg、HBeAg表达及HepG2.2.15细胞增殖有明显影响的328种人类miRNA,实验中每种转染的miRNA ASO做3个复孔,重复检测3次,实验组分别与转染LacZ基因的对照组进行对比,最后的结果以对照组的检测值为“1”进行标准化。结果显示,与转染LacZ基因的对照组比较,在没有对HepG2.2.15细胞的增殖产生明显影响的情况下,对HBsAg产生有明显影响的miRNA有miR-199a-3p、miR-196a、miR-210、miR-184、miR-217、miR-185、miR-370(P<0.05),见表3。
表3 对细胞增殖、HBsAg和HBeAg产生影响的


转染基因细胞增殖HBeAgHBsAgLacZ1.00±0.041.00±0.021.00±0.03miR-184ASO0.93±0.080.94±0.031.54±0.03*miR-185ASO0.95±0.020.95±0.031.58±0.03*miR-196aASO0.97±0.071.12±0.031.59±0.02*miR-199a-3pASO0.98±0.081.00±0.021.56±0.01*miR-210ASO0.98±0.030.98±0.021.28±0.03*miR-217ASO0.98±0.020.89±0.021.29±0.07*miR-370ASO1.00±0.030.89±0.030.63±0.12*
注:与转染LacZ基因比较,*P<0.05。
2.4 赖氨大黄酸对HepG2.2.15细胞中miR-210、miR-185、miR-199a-3p、miR-370、miR-196a、miR-184、miR-217表达水平的影响 选择20 μmol/L浓度的赖氨大黄酸作用于HepG2.2.15细胞,采用RT-PCR检测HepG2.2.15细胞中miR-210、miR-185、miR-199a-3p、miR-370、miR-196a、miR-184表达水平,加入20 μmol/L赖氨大黄酸的实验组与未加赖氨大黄酸的对照组比较,最后的结果以对照组的检测值为“1”进行标准化。结果显示,20 μmol/L的赖氨大黄酸明显促进了miR-210、miR-185、miR-199a-3p的表达,抑制了miR-370的表达,与对照组相比较,差异具有统计学意义(P<0.05),见表4。
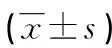
表4 赖氨大黄酸对HepG2.2.15细胞中miRNA表达的影响
注:与对照组比较,*P<0.05。
3 讨 论
HBV是嗜肝DNA病毒,是引起病毒性肝炎的主要病原体之一。虽然现在有预防性疫苗,但是疫苗的推广使用及免疫效果等方面尚存在许多问题[2]。乙型肝炎的治疗至今尚无良策,因此深入研究HBV感染机制,寻找病毒与宿主细胞之间的相互调控和作用机制,将有利于帮助研究人员找到治疗这种感染性疾病的有效方法。
中医药抗HBV的主要思路是通过扶正祛邪达到清除或抑制其复制的目的[3]。目前筛选抗HBV中药主要有3条途径:(1)利用中草药直接作用于人血清来筛选。(2)利用体外细胞培养筛选抗HBV中草药。(3)利用鸭乙型肝炎动物模型来筛选抗 HBV中草药。
中药对病毒性传染病的作用是肯定的,但尚缺乏有说服力的实验证据。故从细胞、分子、蛋白质水平进行机制研究和有效药物的筛选,研究出有效的中药显得尤为重要。传统中药大黄中的一个重要蒽醌类化合物大黄酸具有广泛的药理活性,如抗炎、抗菌、抗病毒、抑制肿瘤细胞增殖等。不同剂量的大黄酸具有不同的功效[4-5]。由于大黄酸水溶性差,生物利用度低,使其进一步应用受到很大限制。为了改善大黄酸的水溶性,由卫生部北京医院/卫生部北京老年医学研究所林雅军博士合成了大黄酸的赖氨酸盐(分子式C21H22N2O8,相对分子质量430),并申请了国家专利。与大黄酸相比,赖氨大黄酸溶解度显著提高至8 mg/mL,其中的赖氨酸盐是人体8种必需氨基酸之一,安全无不良反应。因此,赖氨大黄酸比大黄酸更适合临床研究与应用[6]。
近年发现的miRNA作为1种转录后基因调节机制,参与了生物体的生长、发育、衰老、死亡的调控过程,成为了病毒与宿主细胞相互作用过程中的一种重要的调控分子[7]。越来越多的研究证实病毒编码的miRNA分子或细胞内源性的miRNA均参与了病毒感染宿主细胞及宿主细胞抗病毒的过程,发挥对病毒与宿主细胞相互作用的促进因子或抑制因子,在病毒的生命活动周期中具有重要作用[8-11]。目前已发现miR-32可以与泡沫病毒(PFV)mRNA的3′非翻译区(UTR)不完全互补结合而抑制病毒转录本的翻译,从而限制了病毒的增殖[12]。可见,宿主细胞的miRNA不仅可以作为1种抗病毒机制,而且可促进病毒的增殖,参与病毒的组织亲嗜性。对这些细胞miRNA在病毒感染过程中的作用的深入理解,将有助于揭示病毒组织亲嗜性和致病机制,从而为抗病毒药物靶点的选择和抗病毒新疗法的开发奠定基础。
本研究中,利用稳定整合HBV DNA的HepG2.2.15细胞(可以产生高水平的HBeAg和HBsAg)作为研究HBV复制和增殖的模型,用于研究赖氨大黄酸体内外对HBV复制的调控作用,结果显示,在没有对细胞增殖活性产生影响的情况下,赖氨大黄酸(20 μmol/L)抑制了HBsAg的产生和HBV的增殖。本研究通过转染328种人类miRNA的ASO封闭宿主细胞的miRNA功能,通过初步筛选实验,采用MTS法检测细胞的增殖活性,ELISA法检测HBeAg和HBsAg表达水平,RT-PCR检测HBV DNA,初步得到了一些不影响细胞增殖但对病毒复制有影响的细胞miRNAs,包括miR-210、miR-185、miR-199a-3p、miR-370、miR-196a、miR-184。在此基础上,选择20 μmol/L的赖氨大黄酸作用于HepG2.2.15细胞,采用RT-PCR检测HepG2.2.15细胞中miR-210、miR-185、miR-199a-3p、miR-370、miR-196a、miR-184表达水平,发现20 μmol/L的赖氨大黄酸明显促进了miR-210、miR-185、miR-199a-3p的表达,而抑制了miR-370的表达。进一步研究这几个miRNA抑制HBV增殖的机制,找到它们的靶基因,并将miRNA的功能与它们各自靶基因功能联系起来,将有助于为抗HBV治疗提供新途径。
综上所述,本研究通过分析赖氨大黄酸与miRNA在HBV感染中的作用,为理解赖氨大黄酸、细胞miRNA调控病毒增殖提供了新的理论依据,也为今后开发抗病毒药物或治疗手段提供了新的分子基础或靶点。
[1]林雅军,甄永占,魏洁,等.赖氨大黄酸盐的合成工艺及活性研究[J].中国现代应用药学,2010,27(11):1010-1012.
[2]沈灵智,陈恩富,李倩,等.不同剂次重组乙型病毒性肝炎疫苗加强免疫效果研究[J].疾病监测,2011,26(10):811-814.
[3]李勇,林爱花.西药抗病毒疗法与传统中药联合治疗慢性乙型肝炎的新进展[J].中国现代药物应用,2010,4(15):17-19.
[4]Sheng X,Zhu X,Zhang Y,et al.Rhein protects against obesity and related metabolic disorders through liver X receptor-mediated uncoupling protein 1 upregulation in brown adipose tissue[J].Int J Biol Sci,2012,8(10):1375-1384.
[5]Zhang Y,Fan S,Hu N,et al.Rhein reduces fat weight in db/db mouse and prevents diet-Induced obesity in C57Bl/6 mouse through the inhibition of PPAR gamma signaling [J].PPAR Res,2012,2012:374936.
[6]Lin YJ,Zhen YZ,Wei J,et al.Effects of Rhein lysinate on H2O2-induced cellular senescence of human umbilical vascular endothelial cells [J].Acta Pharmacol Sin,2011,32(10):1246-1252.
[7]Martínez MA.RNA interference and viruses:current innovations and future trends[M].Norfolk:Caister Academic Press,2010.
[8]Wu W,Guo Z,Zhang X,et al.A microRNA encoded by HSV-1 inhibits a cellular transcriptional repressor of viral immediate early and early genes[J].Sci China Life Sci,2013,56(4):373-383.
[9]Zhang GL,Li YX,Zheng SQ,et al.Suppression of hepatitis B virus replication by microRNA-199a-3p and microRNA-210[J].Antiviral Res,2010,88(2):169-175.
[10]McKenna DJ,Patel D,McCance DJ.MiR-24 and miR-205 expression is dependent on HPV onco-protein expression in keratinocytes[J].Virology,2014,448(100):210-216.
[11]Xu G,Gao Z,He W,et al.MicroRNA expression in hepatitis B virus infected primary treeshrew hepatocytes and the independence of intracellular miR-122 level for de novo HBV infection in culture[J].Virology,2014,448(2):247-254.
[12]Chiang K,Liu H,Rice AP.miR-132 enhances HIV-1 replication[J].Virology,2013,438(1):1-4.
RHL inhibiting proliferation of HBV in HepG2.2.15 cells through regulating the miRNA expression level*
ZHANGRong-hua1,WANGMi-si1,WANGLin1,FENGXue-yan1,HAOXiao-fang1,ZHENYong-zhan1,LILin1,CHENJing1,ZHANGGuang-ling1,2△
(1.TeachingandResearchingSectionofPathogenicMicrobiologyandImmunology,SchoolofBasicMedicalSciences,NorthChinaUniversityofScienceandTechnology,Tangshan,Hebei063000,China;2.TangshanKeyLaboratoryforPreclinicalandBasicResearchonChronicDiseases,Tangshan,Hebei063000,China)
Objective To study the effect and molecular mechanisms of rhein lysinate(RHL) on the proliferation of hepatitis B virus(HBV) and viral antigen expression to establish the preliminary experimental evidence for researching the anti-HBV mechanism of RHL.Methods HepG2.2.15 cells were divided into the experimental groups(adding 5,10,20,40,80 μmol/L RHL) and the control group without adding RHL.After culturing for 24,48 h,the supernatant was obtained.The cell proliferation activity was detected by the non-radioactive cell proliferation assay(MTS),the expression level of HBsAg and HBeAg were detected by adopting the ELISA method,the HBV DNA copy number and the expression levels of miR-210,miR-185,miR-199a-3p,miR-370,miR-196a,miR-184 and miR-217 were detected by real time quantitative PCR(RT PCT).HepG2.2.15 was transfected by miR-210,miR-185,miR-199a-3p,miR-370,miR-196a,miR-184 and miR-217ASO,the cell proliferation activity was detected by the MTS method,the expression levels of HBsAg and HBeAg were detected by rthe enzyme linked immunosorbent assay(ELISA),respectively.Results Without generating the effect on the cell proliferation activity,RHL inhibited the generation of HBsAg and the HBV proliferation.The expression level of miR-210,miR-185 and miR-199a-3p was increased by RHL(20 μmol/L) and the expression level of miR-370 was inhibited by RHL(20 μmol/L),the differences compared with the control group were statistically significant(P<0.05).Conclusion RHL is possible to suppress HBV proliferation and HBsAg generation by affecting the miRNA expression in HepG2.2.15 cells.
rhein lysinate; hepatitis B virus; hepatitis B surface antigen; miRNA
国家自然科学青年基金资助项目(81201281);河北省自然科学基金资助项目(H2013209180、C2012401037、H2013209040);河北省唐山市科技计划资助项目(12140209A-4);华北理工大学研究生创新项目(2015S16、2015S17);国家级、省级大学生创新项目(201410081021)。
张荣花,女,在读硕士,主要从事病毒相关肿瘤学研究。
△通讯作者,E-mail:zhguangling@126.com。
10.3969/j.issn.1672-9455.2015.19.003
A
1672-9455(2015)19-2817-03
2015-01-28
2015-04-15)

