酿酒酵母培养基的优化
张蕾,黄荣凯,胡喜贵,于永昂
(1.河南科技学院,河南新乡453003;2.西北农林科技大学,陕西杨凌712100)
酿酒酵母培养基的优化
张蕾1,黄荣凯1,胡喜贵1,于永昂2
(1.河南科技学院,河南新乡453003;2.西北农林科技大学,陕西杨凌712100)
为了提高酿酒酵母的生物量,采用单因素试验和正交试验设计相结合的方法,对酿酒酵母的培养基成分进行了优化.结果表明:优化后的配方为每100 mL培养基含蔗糖4 g,蛋白胨3 g,磷酸二氢钾0.1 g,氯化钠0.1 g.用此培养基进行发酵,酿酒酵母的生物量为17.5 g/L,比培养基优化前的12.78 g/L提高了36.9%,OD560值为1.611,比培养基优化前提高了36.2%.
酿酒酵母;正交试验;培养基;优化
酿酒酵母(Saccharomyces cerevisiae)作为人类利用最早的微生物,其营养成分十分丰富[1].酿酒酵母与同为真核生物的动物和植物细胞具有很多相同的结构,又容易培养,因此被选为标准模型微生物系统[2-4].不管酵母菌是应用于酿酒还是医药等其他领域,获得最大数量的菌体都是酵母菌应用的前提和基础,研究和优化菌体的生产条件,对于酵母菌产品的低成本应用具有重要意义.
近几年来,人们利用以发酵获得高细胞浓度的酵母为基础生产大量的重组蛋白及生物制品,并取得一定的进展[5-6].这些研究成果都是在提高酿酒酵母生物量的基础上取得的.影响酿酒酵母高细胞浓度发酵的因素非常多,如细胞所需要的营养物质、发酵过程中生长抑制物的积累、培养温度、发酵液的pH值及发酵液流变学特性等.酵母发酵常用的碳源有葡萄糖、蔗糖、淀粉、果糖、麦芽糖等,常用的氮源有蛋白胨、酵母浸粉、尿素、硫酸铵、硝酸钾等,而无机盐、生长因子、微量元素等也是酵母生长必不可少的物质[7].不同的酵母菌株其生物学特性不完全相同,因此,本试验针对啤酒车间保存的菌株,通过单因素比较试验和正交试验,筛选酿酒酵母培养基的优化组合,为进一步扩大培养提供理论依据,奠定实践基础[8].
1 材料与方法
1.1 材料
酿酒酵母(河南科技学院生命科技学院啤酒中试车间保存).
1.2 培养基
斜面培养基(100 mL):葡萄糖2 g,蛋白胨2 g,酵母浸粉1 g,琼脂1.5 g,自然pH值.
种子培养基(100 mL):葡萄糖2 g,蛋白胨2 g,酵母浸粉1 g,自然pH值.
发酵培养基(100 mL):葡萄糖2 g,蛋白胨2 g,KH2PO40.1 g,MgSO4·7H2O 0.05 g,NaCl 0.05 g,pH 7.0~7.2.
1.3 方法
1.3.1 菌种活化和扩大培养 先制备斜面培养基,在无菌条件下,在斜面培养基接1环保藏菌种至恒温培养箱30℃培养48 h复苏菌种.菌种的扩大培养是用接种环取1环活化后的斜面菌种转接到装液量为20 mL/100mL的种子培养基中,在30℃、180 r/min条件下培养48 h.
1.3.2 菌体密度的测定 发酵液经过适当稀释后用紫外可见分光光度计,以不接菌液的空白培养基作为对照,测量波长在560 nm处的OD值.
1.3.3 菌体生物量的测定 使用离心机使发酵液在5 000 r/min条件下离心15 min,用蒸馏水洗涤2次后收集菌体,置于烘干箱内105℃烘干,保持质量恒定,称质量并记录数据.
1.4 培养基优化单因素试验
培养基的初始条件为pH 6.0,接种量4 mL,装液量20 mL/100mL三角瓶,温度30℃,转速180 r/min,摇床培养48 h.培养基选取碳源、氮源、生长因子、无机盐等,研究其对菌株生物量的影响.
1.4.1 最适碳源的确定 分别取2 g葡萄糖、可溶性淀粉、蔗糖代替基础培养基的碳源配制100 mL培养基(以下各成分的添加量均为配制100 mL培养基的添加量),其他成分不变,进行发酵培养.以葡萄糖为碳源的培养基为对照,每组3个平行,在波长560 nm条件下测定其OD值.
1.4.2 最适碳源添加量的确定 碳源确定后分别选取1、2、3、4、5 g添加量进行单因素试验,每组3个平行,测定OD560值.
1.4.3 最适氮源的确定 分别取2 g蛋白胨、硫酸钠、尿素代替基础培养基的氮源配置100 mL培养基,其他成分一样,进行发酵,以蛋白胨为氮源的培养基为对照,每组3个平行,测定OD560值.
1.4.4 最适氮源添加量的确定 氮源确定后分别选取1、2、3、4 g添加量进行单因素试验,每组3个平行,测定OD560值.
1.4.5 磷酸盐含量的确定 培养条件不变,分别选取0.01、0.05、0.1、0.2 g添加量进行单因素试验,以基础培养基为对照组,每组3个平行,测定OD560值.
1.4.6 最适无机盐的确定 去掉基础培养基中的所有无机盐,分别添加0.05 g的氯化钠、氯化钙、硫酸镁,以不添加任何无机盐的发酵培养基为空白对照,进行发酵培养,测定OD560值.
1.4.7 最适无机盐含量的确定 无机盐确定后分别选取0.01、0.05、0.1、0.2 g添加量进行单因素试验,以基础培养基为对照,每组3个平行,测定OD560值.
1.5 培养基优化正交试验
根据碳源、氮源、磷酸二氢钾、无机盐的单因素试验结果,选出最佳碳源、氮源、无机盐和磷酸二氢钾添加量,采用L9(34)正交表安排试验进行四因素三水平正交试验,以OD560值为考察指标,对正交试验的结果进行方差分析,进一步对发酵培养基组成进行优化.
1.6 数据处理
采用SPSS 17.0软件,对试验数据进行方差分析.
2 结果与分析
2.1 碳源的确定
不同碳源对酿酒酵母生物量的影响见图1.
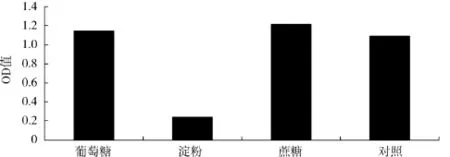
图1 不同碳源对OD560值的影响Fig.1 Effect of carbon source on OD560
由图1可知,用葡萄糖、可溶性淀粉、蔗糖3种碳源与发酵培养基中的葡萄糖进行对比,当可溶性淀粉为碳源时的菌体密度最低,蔗糖为碳源时的菌体密度最大,OD值高达1.216.方差分析结果显示,葡萄糖作为碳源时与蔗糖作为碳源两组间差异不显著(P>0.05).由于蔗糖为多糖,含糖高,提供能量多,能更好地维持培养基内的低渗环境.因此,选择蔗糖为酿酒酵母的最佳碳源.
2.2 蔗糖添加量的确定
蔗糖添加量对酿酒酵母生物量的影响见图2.
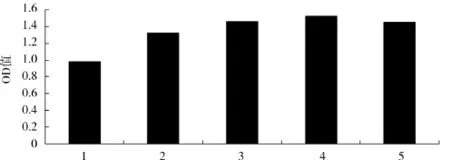
图2 蔗糖添加量对OD560值的影响Fig.2 Effect of sucrose consentration on OD560
由图2可知,在蔗糖添加量低于4 g/100mL时,菌体浓度随着蔗糖添加量的增加而增大,当蔗糖添加量大于4 g/100mL时酵母菌的生长受到抑制,蔗糖添加量为4 g/100mL时OD值高达1.508.蔗糖添加量在3、4、5 g/100mL时各组分间差异不显著(P>0.05).从糖对酿酒酵母生物量的转化率和经济成本考虑,高质量浓度使酿酒酵母快速增长的同时代谢产物也快速大量积累,而一些有抑制作用的代谢产物会抑制酿酒酵母的增值,从而造成糖的浪费,又增加了投入成本.因此,确定适宜的蔗糖添加量为4 g/100mL.
2.3 氮源的确定
不同氮源对酿酒酵母生物量的影响见图3.
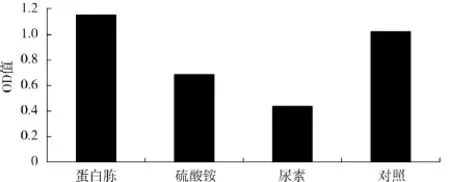
图3 不同氮源对OD560值的影响Fig.3 Effect of nitrogen source on OD560
由图3可知,用蛋白胨为氮源时的菌体密度显著高于硫酸铵、尿素为氮源时的菌体密度,OD值高达1.152,与对照组发酵培养基中的蛋白胨相差不大,因此,选用蛋白胨作为发酵培养基的氮源.
2.4 蛋白胨添加量的确定
蛋白胨添加量对酿酒酵母生物量的影响见图4.
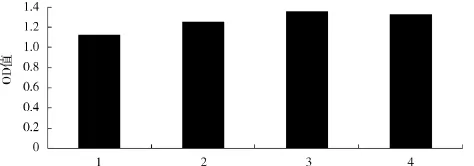
图4 蛋白胨添加量对OD560值的影响Fig.4 Effect of peptone consentration on OD560
由图4可知,蛋白胨添加量为3 g/100mL时的OD值最大,为1.354.与添加量为4 g/100mL时的菌体浓度无显著性差异(P>0.05),但高于1~2 g/100mL添加量时的菌体浓度.因此,蛋白胨添加量以3 g/100mL为宜.
2.5 磷酸二氢钾添加量的确定
磷酸二氢钾添加量对酿酒酵母生物量的影响见图5.
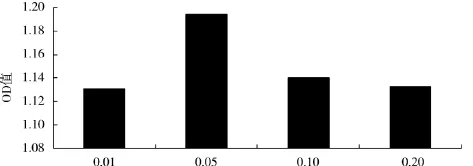
图5 磷酸二氢钾添加量对OD560值的影响Fig.5 Effect of KH2PO4consentration on OD560
由图5可知,磷酸二氢钾添加量为0.05 g/100mL时的OD值最大,达1.194,并且与其他各组分间有显著性差异(P<0.05).因此,选择0.05 g/100mL添加量的磷酸二氢钾为生长因子.
2.6 最适无机盐的确定
不同无机盐对酿酒酵母生物量的影响见图6.
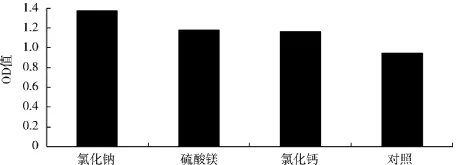
图6 不同无机盐对OD560值的影响Fig.6 Effect of inorganic salts on OD560
由图6可知,选用氯化钠、硫酸镁、氯化钙做无机离子时的菌体密度均高于对照组,但氯化钠作为无机盐时的OD值最大,高达1.377.方差分析结果表明,氯化钠为无机盐时与其他两组分间有显著性差异(P<0.05).因此选用氯化钠作为无机盐.
2.7 氯化钠添加量的确定
氯化钠添加量对酿酒酵母生物量的影响见图7.
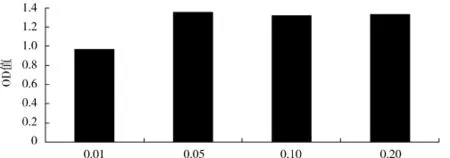
图7 氯化钠添加量对OD560值的影响Fig.7 Effect of NaCl consentration on OD560
由图7可知,氯化钠添加量为0.05g/100mL时的OD560值最大,高达1.353.与添加量为0.1、0.2 g/100mL时的菌体浓度无显著性差异(P>0.05),但均高于0.01 g/100mL添加量时的菌体浓度.因此,从节约经济成本考虑,确定氯化钠添加量为0.05 g/100mL.
2.8 酿酒酵母培养基优化优化正交试验分析
根据单因素试验结果,选择蔗糖添加量、蛋白胨添加量、磷酸二氢钾添加量、氯化钠添加量4个因素进行正交试验,正交试验因素与水平见表1,结果与分析见表2,方差分析见表3.
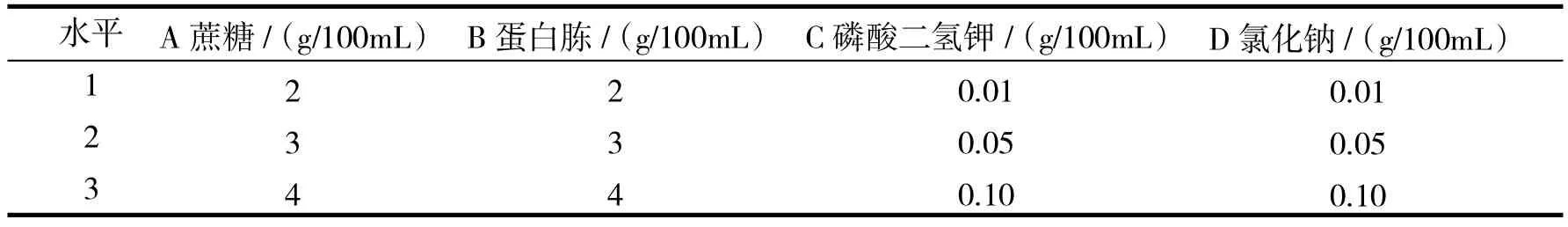
表1 酿酒酵母培养基配方优化正交试验因素与水平Tab.1 Factors and levels of orthogonal experiment for medium formula optimization of Saccharomyces cerevisiae
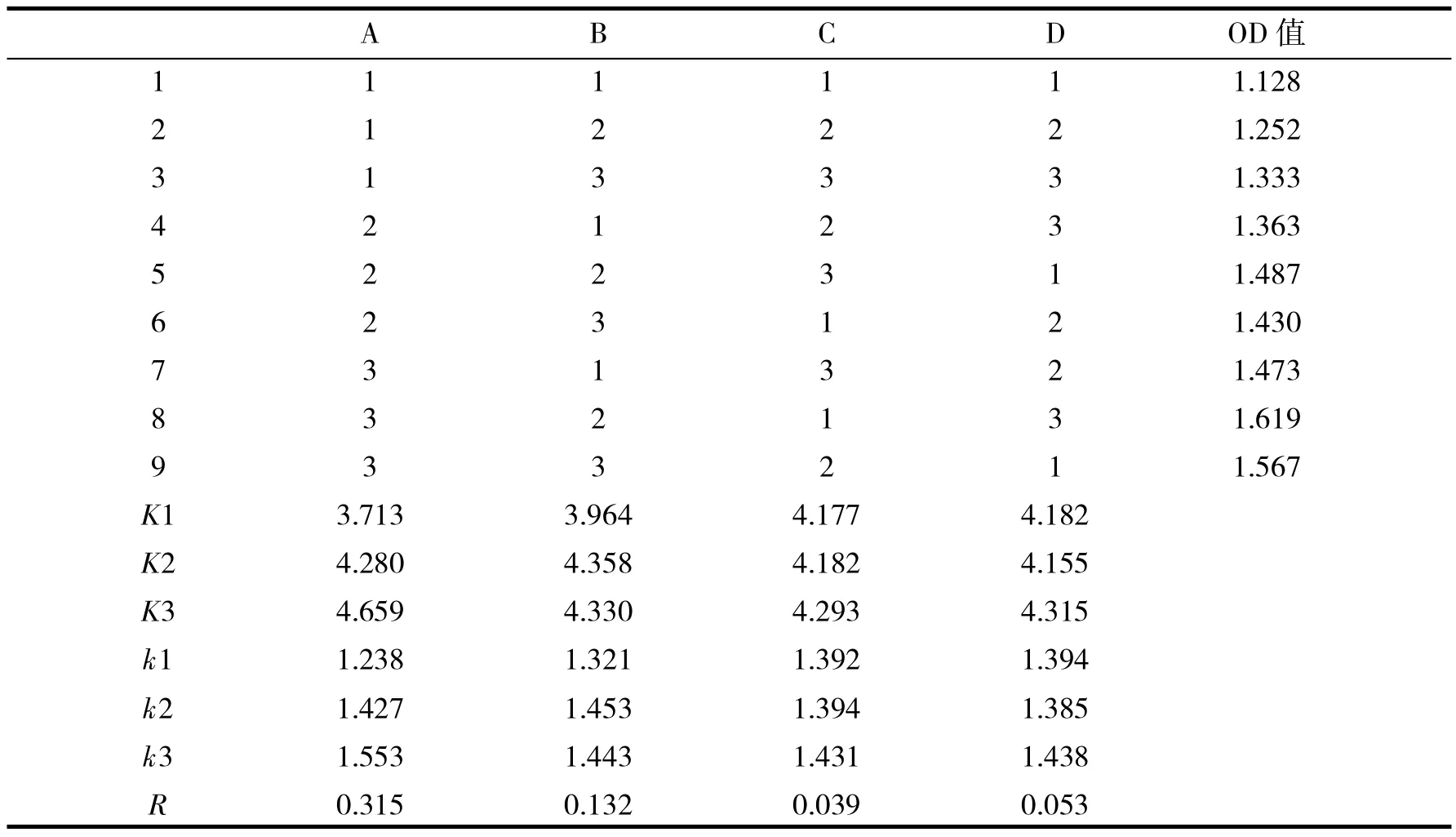
表2 酿酒酵母培养基配方优化正交试验结果与分析Tab.2 Results and analysis of orthogonal experiment for medium formula optimization of Saccharomyces cerevisiae
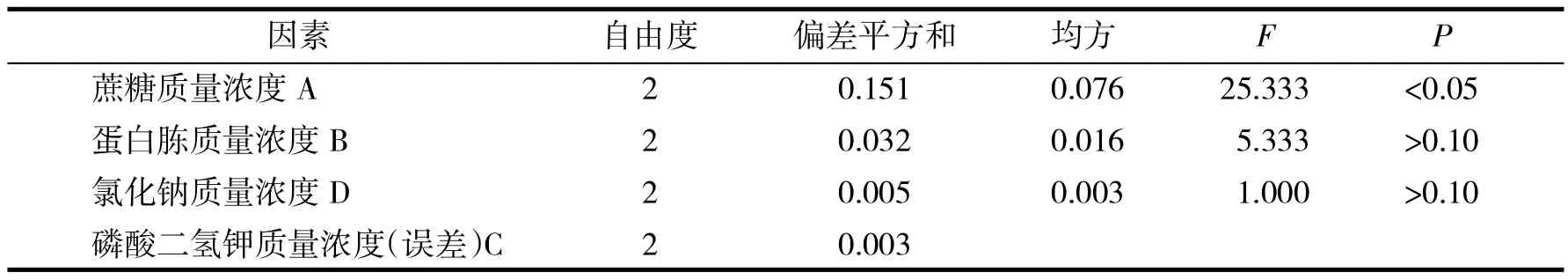
表3 酿酒酵母培养基配方优化正交试验方差分析Tab.3 Variance analysis of orthogonal experiment for medium formula optimization of Saccharomyces cerevisiae
由正交试验结果可知,影响酿酒酵母发酵水平的主次因素关系为A>B>C>D,即蔗糖对酿酒酵母的影响最大,其次是蛋白胨和氯化钠,磷酸二氢钾影响最小.酿酒酵母最优培养基组合为A3B2C4D4,即蔗糖、蛋白胨、磷酸二氢钾、氯化钠的添加量分别为4、3、0.1和0.1 g/100mL.3次重复验证试验结果表明该组合确为酿酒酵母的最适发酵培养基.在此培养条件下,OD560值为1.611,比未优化培养基提高了36.2%,酵母菌的干质量达到17.5 g/L,比未优化培养基提高了36.9%.
极差分析结果表明,磷酸二氢钾对试验结果影响最小,因此把磷酸二氢钾作为误差项来检验其他因素的显著性.方差分析结果表明,A的F值>F0.05=19,即蔗糖添加量对酿酒酵母OD560值影响显著,而其他因素F值均小于F0.05,说明蛋白胨、磷酸二氢钾、氯化钠对酿酒酵母发酵无显著影响.
3 结论与讨论
微生物在生长繁殖过程中需要不断从外界环境中摄入各种营养物质,并且将这些营养物质用于细胞的生长繁殖.一般培养基中含有水、碳源、氮源、无机盐、生长因子、微量元素等,培养基中的这些营养成分是制约酿酒酵母发酵水平的因素.前人大多通过优化发酵培养基和培养条件来提高酵母菌体浓度,杨士春[9]等采用响应面法研究酿酒酵母的优化,得出在酵母发酵生产过程中,向培养基中添加0.286 g/L的磷酸二氢钾、0.975 g/L的硫酸镁和5.877 g/L的尿素,能使乙醇产量达到最佳值.王美霞[10]等对YPD培养基、豆芽汁培养基、麦氏培养基、LB培养基和马铃薯培养基5种培养基经过初筛后,通过正交试验优化培养基组成,优化后的OD值是基础培养基的1.06倍.李聪[8]对酿酒酵母培养条件和发酵培养基进行优化,得到优化的发酵培养基配方为葡萄糖20 g/L,酵母粉10 g/L,磷酸二氢钾1.5 g/L,硫酸镁1 g/L,并得出结论:影响酿酒酵母生长的关键因素是摇瓶培养时间和培养基中的葡萄糖质量浓度.
本研究通过单因素试验和正交试验优化了酿酒酵母的发酵培养基,最终优化的培养基配方为:蔗糖、蛋白胨、磷酸二氢钾、氯化钠的添加量分别为4、3、0.1和0.1 g/100mL.在此培养条件下,OD560值为1.611,比未优化培养基提高了36.2%,酵母菌的干质量达到17.5 g/L,比优化前高了36.9%.
[1]赵小丽,甄玉国,王兰惠,等.酿酒酵母发酵条件的研究[J].中国酿造,2014,33(6):75-78.
[2]王颖,何宁,李清彪,等.酿酒酵母S.cerevisiae高密度培养条件优化研究[J].工业微生物,2007,37(1):34-38.
[3]张晓阳,杜风光,池小琴,等.代谢工程与全基因组重组构建酿酒酵母抗逆高产乙醇菌株[J].中国生物工程杂志,2011,31(7):91-97.
[4]刘建静,杨曙明,宋海彬.单细胞蛋白饲料的开发与利用[J].黑龙江畜牧兽医,2008(4):21-22.
[5]周向荣,夏延斌,周跃斌,等.Saccharomyces cerevisiae在食品工业发酵中的研究进展[J].中国酿造,2008,27(2):1-4.
[6]张伟,余传信,杨建良,等.酿酒酵母表达Sj23HD-HSA融合蛋白与免疫反应性分析[J].中国血吸虫病防治杂志,2011,23(6):653-658.
[7]Kennedy M,Krohse D.Strategies for improving fermentation medium performance:a review[J].Journal of Industrial Microbiology and Biotechnology,1999,23(6):456-475.
[8]李聪.酿酒酵母培养条件及发酵培养基的优化[J].中国农学通报,2014,30(9):302-306.
[9]杨士春,吕晓龙,缪绎.响应面法优化酿酒培养基的研究[J].安徽农业科学,2010,38(24):13296-13299.
[10]王美霞,贺银凤.与乳酸菌具有共生作用酵母菌培养基的优化[J].农产品加工,2013(10):1-4.
(责任编辑:邓天福)
The optimization of Saccharomyces cerevisiae medium
Zhang Lei1,Huang Rongkai1,Hu Xigui1,Yu Yongang2
(1.Henan Institute of Science and Technology,Xinxiang 453003,China;2.Northwest A&F University, Yangling 712100,China)
In order to improve the biomass of Saccharomyces cerevisiae,the experiment adopts the method combined single-factor test with orthogonal test,optimizing the medium components of S.cerevisiae.The results showed that the optimized medium included 4 g sucrose,3 g peptone,0.1 g potassium dihydrogen phosphate,0.1 g sodium chloride per 100 mL.Using this fermentation medium to ferment,the biomass of S.cerevisiae is 17.5 grams per litre up by 36.9%, compared with the optimization of medium 12.78 gram per litre before,and the value of OD560is 1.611,increased by 36.2%than the optimized amount of culture medium.
Saccharomyces cerevisiae;orthogonal test;medium;optimiz
TS261.1+1
A
:1008-7516(2015)04-0018-06
10.3969/j.issn.1008-7516.2015.04.004
2015-06-24
河南科技学院引进高层次人才科研启动项目(201010613001)
张蕾(1987―),女,河南卫辉人,硕士,助理实验师.主要从事微生物发酵研究.

