不同棕色玻璃安瓿对盐酸氨溴索注射液光稳定性的影响
任传杰,李坤娓,黄国英,贾情情,张 健
(山东齐都药业有限公司,山东淄博255400)
不同棕色玻璃安瓿对盐酸氨溴索注射液光稳定性的影响
任传杰,李坤娓,黄国英,贾情情,张 健
(山东齐都药业有限公司,山东淄博255400)
目的比较光照影响因素试验中不同棕色玻璃安瓿对盐酸氨溴索注射液稳定性的影响,确定最佳包装形式。方法棕色中性、低硼硅玻璃安瓿以及附加外包装纸盒的盐酸氨溴索注射液分别进行光照试验,采用高效液相色谱法测定盐酸氨溴索和有关物质的含量,考察药物稳定性。结果棕色中性硼硅玻璃安瓿与棕色低硼硅玻璃安瓿+纸盒包装的盐酸氨溴索注射液光稳定性试验结果基本一致。棕色低硼硅玻璃安瓿单独包装的盐酸氨溴索注射液光稳定性试验结果有明显差异,且暴露48 h后未知单杂超过报告限度。结论棕色中性硼硅玻璃安瓿或棕色低硼硅玻璃安瓿+纸盒可作为盐酸氨溴索注射液的包装材料,但棕色低硼硅玻璃安瓿包装的盐酸氨溴索注射液光照暴露时间不宜超过24 h。
棕色玻璃安瓿;盐酸氨溴索注射液;光稳定性
盐酸氨溴索是新一代的呼吸道粘液调节剂,具有很强的祛痰作用,并对肺泡表面活性物质的合成和分泌具有显著的促进作用。适用于急、慢性呼吸道疾病引起的痰液粘稠、咳痰困难[1~4]。国内企业生产的盐酸氨溴索注射液多采用棕色低硼硅玻璃安瓿包装,而上海勃林格殷格翰药业有限公司分包装的进口产品采用棕色中性硼硅玻璃安瓿包装。本试验参照文献报道的检测方法[5,6],采用高效液相色谱(HPLC)法测定盐酸氨溴索含量和有关物质,考察棕色中性、低硼硅玻璃安瓿以及附加外包装纸盒的盐酸氨溴索注射液在光照条件下的变化,比较三者的稳定性。
1 仪器和材料
1.1 仪器 高效液相色谱仪(美国Agilent,1260型,G1365D多波长紫外检测器,G1310B单元泵);电子天平(日本岛津,AUW120D,双量程);酸度计(上海精科雷磁,PHS-3C);药品强光照射试验箱(重庆市永生实验仪器厂,SHH-200GDPL-I)。
1.2 材料 盐酸氨溴索(北京太洋药业有限公司,批号:M130909);2 mL棕色中性硼硅玻璃安瓿(德国肖特,批号:1350202201);2 mL棕色低硼硅玻璃安瓿(济南力诺玻璃制品有限公司,批号:1370212151);盐酸氨溴索对照品(中国食品药品检定研究院,批号:100599-201203,含量99.9%);盐酸氨溴索杂质B对照品(中国食品药品检定研究院,批号:510026-201301,含量98.3%);盐酸氨溴索杂质E对照品(中国食品药品检定研究院,批号:510029-201301,含量99.8%);磷酸氢二钠(湖南华纳大药厂有限公司,批号:121104);枸橼酸(湖南华日制药有限公司,批号:20130802);氯化钠(山东肥城精制盐厂,批号:201312002);其他试剂均为分析纯。
2 方法
2.1 样品制备 取水适量,依次加入磷酸氢二钠0.357 5 g、枸橼酸0.25 g、盐酸氨溴索1.875 g、氯化钠1.8 g,搅拌溶解,定容至250 mL。经0.2μm微孔滤膜过滤,分别取2mL加入至2mL棕色中性、低玻璃安瓿,熔封,121℃12 min蒸汽灭菌,并取部分棕色中性、低硼硅玻璃安瓿样品装入纸盒中。
2.2 含量和有关物质测定色谱条件 用十八烷基硅烷键合硅胶为填充剂;以磷酸铵缓冲液(取磷酸铵1.32 g,加水900 mL溶解后,用磷酸调pH值至7.0,加水至1 000 mL)-乙腈(50∶50)为流动相;含量检测波长为248 nm,杂质B检测波长为259 nm,杂质E检测波长为238 nm。柱温30℃,流速1mL·min-1,进样量20μL。
2.3 含量测定方法 精密量取样品适量,加流动相定量稀释制成每1 mL约含盐酸氨溴索75μg的溶液,精密量取20μL,注入液相色谱仪,记录色谱图;另取盐酸氨溴索对照品,同法测定,按外标法以峰面积计算。
2.4 有关物质测定方法 取杂质B和杂质E适量,加流动相定量稀释制成每1 mL约含杂质B和杂质E各约2.3μg的杂质B、杂质E对照品溶液;精密量取样品适量,加流动相定量稀释制成每1 mL约含盐酸氨溴索0.75 mg的供试品溶液;精密量取供试品溶液1 mL,置100 mL量瓶中,加流动相稀释至刻度,摇匀,作为对照溶液。照“2.2”项下色谱条件,精密量取对照溶液20μL,注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%。精密量取杂质B和杂质E对照品溶液、供试品溶液和对照溶液各20μL,分别注入液相色谱仪,记录色谱图至供试品溶液主峰保留时间的3倍,按外标法以峰面积计算。
2.5 光照稳定性 参考国家食品药品监督管理总局药品审评中心颁布的化学药物(原料药和制剂)稳定性研究技术指导原则[7],将样品置于光照总照度不低于1.2×106Lux·h,近紫外能量不低于200 W·h·m-2条件下进行光照影响因素试验,按“2.3”和“2.4”项下方法测定含量及有关物质。
3 结果与讨论
3.1 光照试验 于光照试验第5、10天,取棕色中性、低硼硅玻璃安瓿以及外加纸盒包装的棕色中性、低硼硅玻璃安瓿样品,检测盐酸氨溴索含量及有关物质,结果见表1。
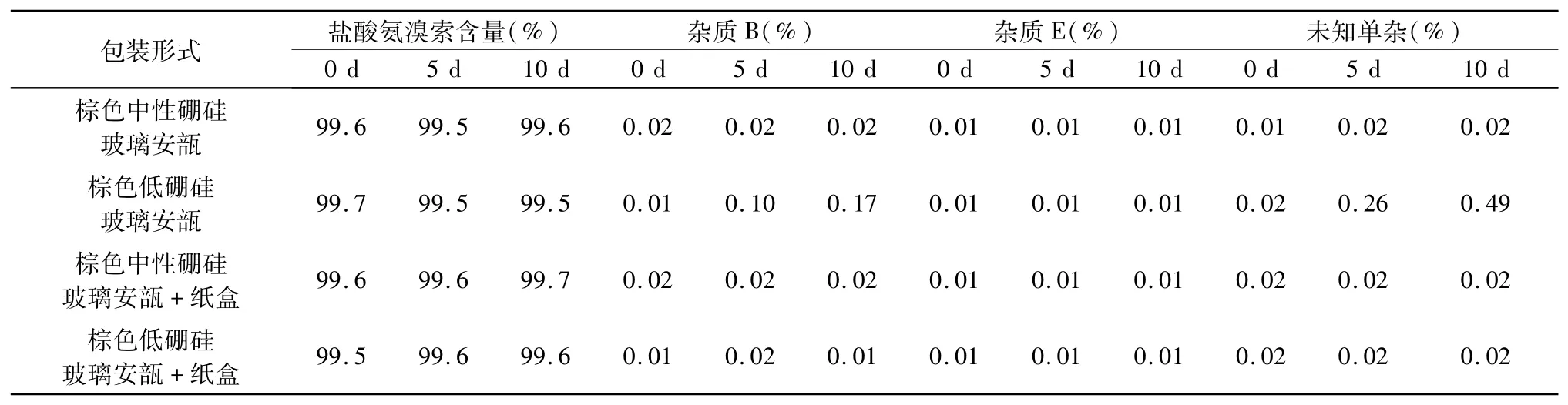
表1 不同包装形式盐酸氨溴索含量及有关物质检测结果
从表1可以看出,不同包装形式下盐酸氨溴索含量无明显变化,杂质E含量稳定,杂质E不属盐酸氨溴索注射液的光照降解产物。棕色低硼硅玻璃安瓿包装的盐酸氨溴索注射液杂质B以及未知单杂含量随光照时间明显增加,棕色中性硼硅玻璃安瓿以及增加外包装纸盒的棕色中性、低硼硅玻璃安瓿包装的盐酸氨溴索注射液杂质B以及未知单杂含量无明显变化。在光照试验条件下,棕色低硼硅玻璃安瓿无法对盐酸氨溴索注射液进行有效保护,盐酸氨溴索注射液进行光降解,主要生成杂质B以及其他未知单杂,且未知单杂的生成量远大于杂质B。棕色中性硼硅玻璃安瓿由于铁、钛、碳等着色剂的使用以及配比的不同,可强烈吸收紫外光,保护药品质量[8]。通过增加纸盒外包装,对光进行屏蔽,也可达到棕色中性硼硅玻璃安瓿同样的保护效果。3.2 光照耐受时间试验 于光照试验第4、8、14、24、48、72、96小时,取棕色低硼硅玻璃安瓿样品,检测盐酸氨溴索含量及有关物质,结果见表2。

表2 棕色低硼硅玻璃安瓿样品盐酸氨溴索含量及有关物质检测结果
从表2可以看出,光照条件下,棕色低硼硅玻璃安瓿包装的盐酸氨溴索注射液杂质B和未知单杂含量均明显升高。第48小时,未知单杂含量已达0.11%,已大于化学药物杂质研究0.1%的报告限度。棕色低硼硅玻璃安瓿包装的盐酸氨溴索注射液光照暴露时间不宜超过24 h。
4 结论
通过不同棕色玻璃安瓿包装下盐酸氨溴索注射液的光稳定性对比,棕色中性硼硅玻璃安瓿更适于作为盐酸氨溴索注射液的内包装材料。以棕色低硼硅玻璃安瓿+纸盒包装也可达到棕色中性硼硅玻璃安瓿包装的同等效果,但使用过程中直接暴露于光照的时间不宜超过24 h。
[1] 赵磊,文爱东,吴昌归,等.注射用盐酸氨溴索祛痰作用的疗效和安全性评价[J].第四军医大学学报,2004,25(2):189-192.
[2] 高文燕.盐酸氨溴索治疗分泌性中耳炎的疗效观察[J].药学研究,2015,34(5):302-303.
[3] 张琼.盐酸氨溴索的药理和临床分析[J].中国实用医药,2009,4(35):111-112.
[4] 施毅,肖永营,苏欣,等.注射用盐酸氨溴索粘痰溶解与祛痰作用的多中心临床随机对照研究[J].临床内科杂志,2005,22(9):598-600.
[5] 付建,苏贵勇,赵海桥.HPLC法测定盐酸氨溴索注射液的含量和有关物质[J].齐鲁药事,2012,31(2):84-87.
[6] 王博,李洪起,徐芳,等.HPLC法测定盐酸氨溴索注射液中有关物质[J].现代药物与临床,2012,27(3):226-228.
[7] 国家食品药品监督管理总局药品审评中心.化学药物(原料药和制剂)稳定性研究技术指导原则[EB/OL].(2013-02-06)[2015-03-20].http://www.cde. org.cn/attachmentout.domothed=list&id=5161.
[8] 禚明.棕色安瓿瓶玻璃的研究[D].济南:山东轻工业学院,2009:58.
The light stability of Ambroxol Hydrochloride Injection under different brown glass ampoules packaging
REN Chuan-jie,LIKun-wei,HUANGGuo-ying,JIAQing-qing,ZHANG Jian
(Shandong Qidu Pharmaceutical Co.,Ltd.,Zibo 255400,China)
ObjectiveTo compare the stability of Ambroxol Hydrochloride Injection in different brown glass ampoule under the light test and determine the best form of packaging.MethodsThrough the light test,determining the ambroxol hydrochloride and impurities by HPLC,to study the stability of Ambroxol Hydrochloride Injection packaging by brown low&neutral borosilicate glass ampoule and carton.ResultsAmbroxol Hydrochloride Injection packaging by brown neutral borosilicate glass ampoule was consistent with the low brown borosilicate glass ampoule and carton packaged under the light test.Ambroxol Hydrochloride Injection individually packaged by brown low borosilicate glass ampoule was significantly different,and the unknownmonoimpurity was over the reporting limits after 48 h exposured.ConclusionBrown neutral borosilicate glass ampoule or low borosilicate glass ampoule and carton can be used as Ambroxol Hydrochloride Injection packagingmaterials,but light exposure time should not exceed 24 h for brown low borosilicate glass ampoule packaging Ambroxol Hydrochloride Injection.
Brown glass ampoule;Ambroxol Hydrochloride Injection;Light stability
R927.11
A
2095-5375(2015)08-0461-003
任传杰,男,工程师,研究方向:药物开发,E-mail:qdrdrenchuanjie@163.com

