激活小胶质细胞α7-nAChR减少Aβ蛋白所致的神经元毒性的研究
雷露雯,李伟煊,冯智敏,邓 冲,陈 翔
(南方医科大学附属南海区人民医院,广东佛山528000)
·实验研究·
激活小胶质细胞α7-nAChR减少Aβ蛋白所致的神经元毒性的研究
雷露雯,李伟煊,冯智敏,邓 冲,陈 翔
(南方医科大学附属南海区人民医院,广东佛山528000)
目的研究激活小胶质细胞上的α7-烟碱型乙酰胆碱受体对减少由于β-淀粉样蛋白1-42沉积所致的慢性炎性反应对神经元毒性作用。方法取孕18 d的胎鼠大脑皮质做原代神经元的培养,选用微管相关蛋白-2与神经元特异性烯醇化酶作为神经元特异性标志物,用免疫细胞化学技术对神经元进行鉴定。培养10 d的神经元与小胶质细胞共同培养于带有膜插件的培养皿中。试验分空白对照组、β-淀粉样蛋白组、共培养组、烟碱预处理组,各组添加β-淀粉样蛋白1-42共培养96 h后,用流式细胞仪及免疫荧光法检测神经元的凋亡率。结果体外培养10 d的神经元,用免疫荧光及DAB显色鉴定神经元均能显色,细胞纯度达到了94.49%。激活组与未激活组相比神经元的凋亡率明显下降(P<0.05)。结论激活小胶质细胞上的α7-烟碱型乙酰胆碱受体能减少β-淀粉样蛋白介导的神经元凋亡,对神经元产生保护作用。
α7-烟碱型乙酰胆碱受体;神经元;免疫细胞化学;细胞凋亡
Aβ蛋白沉积所致的慢性炎症与阿尔茨海默病(AD)的发病有密切的关联[1]。现有研究表明外周迷走神经释放的递质可以激活巨噬细胞α7-烟碱型乙酰胆碱受体(α7-nAChR),减少炎性介质的分泌,从而抑制外周炎性反应[2,3]。本试验利用带膜插件的培养皿将神经元与小胶质细胞共同培养,然后利用β-淀粉样蛋白1-42(Aβ1-42)作用于小胶质细胞产生炎性因子的方法诱导离体培养的神经元损伤模型的建立,观察激活小胶质细胞上的α7-nAChR对神经元凋亡的影响,评价α7-nAChR对神经元损伤的保护作用。
1 材料与方法
1.1 材料 怀孕18 d的SD大鼠(南方医科大学实验动物中心,动物合格证号:粤监证字2006B023);DMEM/F12高糖培养基(Hyclone公司);新生牛血清、胎牛血清、羊血清、胰蛋白酶/EDTA(Gibico公司);L-谷氨酰胺、多聚赖氨酸、烟碱、Aβ1-42(Sigma公司);小鼠抗大鼠MAP-2单克隆抗体(Abcom公司);荧光标记二抗(Calbiochem公司);神经元特异性烯醇化酶(NSE)多克隆抗体和SP免疫组化试剂盒(武汉博士德生物科技有限公司);Fluorescein FragELTM DNA Fragmentation Detection Kit(Merker公司)。
1.2 方法
1.2.1 神经元的分离培养 将SPF级孕18 d的SD大鼠麻醉。无菌方法取出胎鼠放入盛有DHanks液的无菌烧杯。用75%的酒精消毒后,取出胎鼠的大脑皮质,去除脑膜,然后剪碎,放于37℃的孵箱中用0.25%的胰酶消化10 min。最后用加有血清的完全培养基终止消化,将细胞混悬液置于离心机中,按1 000 rpm的速度离心,弃上清,加入含20%胎牛血清的DMEM/F12培养基悬浮细胞,转移至已包被好的细胞培养皿中,放入孵箱中培养,第2天换用含有神经营养因子B27,但没有血清的培养基继续培养,以后3 d换液1次。
1.2.2 皮质神经元的鉴定 首先采用免疫荧光的方法对培养于盖玻片上第10天的神经元进行鉴定。具体操作如下:用0.01 mol·L-1PBS充分洗涤,然后用多聚甲醛于室温下固定30 min,PBS液清洗;加0.3%的Triton-100于室温下放置30 min;最后加10%羊血清放在37℃的孵箱中封闭30 min。加入以1∶250稀释的MAP-2单克隆抗体,放于4℃的冰箱中,48 h后用PBS液清洗,再加DEXAS红色荧光标记的IgG二抗,避光、37℃1~2 h。用Hoechst 33258染细胞核。在高倍显微镜下随机选取5个视野,计数阳性细胞的个数,取其均值作为阳性神经元的百分率。
然后采用DAB显色方法对原代培养的神经元进行鉴定,以NSE多克隆抗体作为神经元的特异性标志物,采用免疫细胞化学技术SP法标记神经元,具体方法参照试剂盒的说明书,以胞质及突起染成棕黄色为阳性神经元。
1.2.3 用带膜插件的培养皿共同培养神经元与小胶质细胞 为了能达到神经元与小胶质细胞共同培养,把带有孔径为0.22μm的膜插件放入培养有神经元的培养皿中,将分离纯化好的小胶质细胞培养在位于神经元上层的膜插件上,由于有膜插件的存在,神经元与小胶质细胞没有直接的接触,并且不能通过这种膜插件,但可溶性的蛋白可以通过。
1.2.4 分组及细胞处理 根据实验要求分为空白对照组、Aβ蛋白组、共培养组、烟碱预处理组。其中空白对照组不施加任何干预,Aβ蛋白组是在培养的神经元中加入终浓度为500 ng·mL-1的Aβ1-42,共培养组是在共同培养有神经元与小胶质带膜插件的培养皿中加入终浓度为500 ng·mL-1的Aβ1-42,烟碱预处理组是在加终浓度为500 ng·mL-1的Aβ1-42前24 h加入10μmol·L-1烟碱预激活与神经元共培养的小胶质细胞上的α7-nAChR。加Aβ1-42后,各组继续37℃、5%CO2孵箱中共培养96 h。
1.2.5 神经元凋亡的检测 首先选用流式细胞仪测定神经元的凋亡率。各组细胞培养96 h之后先用胰酶消化,计数0.5×106~1×106个细胞,用PBS洗涤2次,依次加入Binding Buffer和FITC标记的Annexin-V于室温避光条件下放置30 min,再加入PI(50μg·mL-1)5μL,避光5 min,最后加400μL Binding Buffer,立即用FACScan进行流式细胞术定量检测。
其次选用免疫荧光显微镜检测神经元的凋亡率用Fluorescein FragEL DNA Fragmentation Detection Kit试剂盒检测神经元的凋亡数。详细操作按试剂盒说明书来做。
1.3 统计学方法 所有的数据经SPSS 13.0软件统计处理,计量数据以±s表示。组间比较采用单因素方差分析,凋亡百分率采用卡方分析。
2 结果
2.1 观察原代培养的神经元 用倒置相差显微镜观察培养7~10 d的神经元,可见胞体丰满,清晰的突起,神经元有单突起也有多突起者,渐连接在一起形成网络。
2.2 神经元的鉴定 用NSE免疫细胞化学染色,能清楚地见到神经元突起及胞质被染成棕褐色。MAP-2免疫荧光染色,在荧光显微镜下可见明显的红色胞质及突起,并用Hoechst 33258进行核染,胞核着蓝色;经过软件叠加后可见Hoechst 33258核染的细胞上大部分MAP-2都呈阳性表达。按公式MPA-2阳性数/核染阳性数为细胞纯度,结果神经元的纯度几乎达到了94.49%±1.22%,见图1。

图1 神经元的鉴定结果A.MAP-2染色阳性的神经元(×200);B.用Hoest 33258核染阳性的细胞(×200);C.图A与B进行叠加的效果图(×200)
2.3 流式细胞仪检测神经元的凋亡 结果见图2。空白对照组、Aβ蛋白组、共培养组、烟碱预处理组凋亡率分别为14.93%±6.40%、37.57%±15.54%、51.20%±12.43%、32.07%±7.67%。共培养组高于Aβ蛋白组(P<0.05),烟碱预处理组低于共培养组(P<0.05),见图3。

图2 流式细胞仪检测神经元的凋亡A.空白对照组;B.Aβ蛋白组;C.共培养组;D.烟碱预处理组
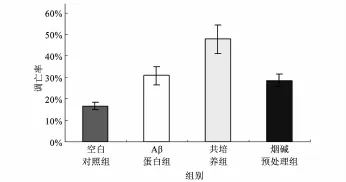
图3 流式细胞仪检测各组神经元凋亡之间的比较
2.4 免疫细胞荧光检测凋亡 在高倍显微镜观察用TUNNEL标记的凋亡细胞,随机选取5个视野,统计阳性细胞的数量。凋亡率分别为13.28%±2.92%、18.65%±2.06%、30.18%±1.26%、20.53%± 1.27%。共培养组高于Aβ蛋白组(P<0.05),烟碱预处理组低于共培养组(P<0.05)。
3 讨论
小胶质细胞是参与中枢炎性反应最主要的细胞,这些细胞激活后可释放多种细胞因子、趋化因子、补体及其激活物,如IL-1α、IL-1β、IL-6和TNF、IL-8、MIP-1α、MCP-1等[4],导致非特异性炎细胞浸润,产生慢性炎症,使神经系统受损。在Aβ斑块周围,常积聚大量激活的胶质细胞,甚至在星形胶质细胞内也有Aβ堆积[5]。Aβ形成后可对神经细胞产生直接毒性作用[6]。激活的神经系统中胶质细胞和少突胶质细胞释放炎性介质,触发神经细胞损伤的信号通路,导致神经细胞受损,激活的胶质细胞可以通过释放活性氧、NO、蛋白水解酶等介质对邻近的神经元产生杀害作用[7,8],同时炎性因子介导的炎性反应又可以促进淀粉样前体蛋白(APP)代谢为Aβ蛋白,从而加重炎性反应,形成恶性循环。本课题的前期研究采用RT-PCR及免疫荧光双染技术,从mRNA及蛋白水平证实了体外培养的小胶质细胞均能表达α7-nAChR[9],并且进一步的证明激活该受体可以减少Aβ介导的炎性介质的分泌。
为观察激活α7-nAChR对减少Aβ介导的神经元损伤作用,在本试验中我们特别采用了transwell这种特殊装置,实现非接触性细胞通讯,观察共培养体系中小胶质细胞在Aβ作用下释放的可溶性炎性介质对神经元的作用。结果显示,神经元在正常培养状态下也有一定程度的凋亡,但若在培养神经元中直接加入Aβ,神经元凋亡率较空白对照组明显增加,提示Aβ对神经元有直接损伤作用。如果将小胶质细胞与神经元细胞共培养再用Aβ作用于小胶质细胞,由此引起的神经元凋亡不仅比空白对照组高,而且也明显高于Aβ组,说明Aβ可通过小胶质细胞加重对神经元的损伤。由于我们采用transwell共培养的小胶质细胞与神经元细胞不能直接接触,只能通过细胞分泌的可溶性介质实现细胞间的相互作用[10]。所以小胶质细胞加重神经元损伤可以通过细胞介质来实现。在这些介质中,Aβ介导小胶质细胞分泌的细胞因子也许是重要的因素。因激活小胶质细胞α7-nAChR能削弱这些细胞介质的分泌,故我们期望通过预激活α7-nAChR,对Aβ通过小胶质细胞造成的神经元损伤起保护作用,研究结果正好与我们的预期目的一致。对神经元凋亡的统计,为避免研究者主观影响,我们通过流式细胞仪,采用Annexin-V/PI检测早期细胞凋亡,该方法较灵敏,受主观影响较小,且适合定量的检测。流式细胞检查结果显示,Aβ蛋白作用于共培养组的神经元96 h之后,神经元的凋亡数量达到了47.86%±6.7%,而Aβ直接作用组的凋亡率为30.90%±4.27%相比,明显低于共培养组(P=0.001)。用烟碱预激活小胶质细胞上的α7-nAChR之后,神经元的凋亡率为28.73%±2.80%,与共培养组相比明显下降,接近Aβ直接作用组(P=0.554)。这进一步佐证了我们的研究结果,并提示在AD患者脑内沉积的Aβ除可以直接对神经元产生损伤外,也许通过作用小胶质细胞释放炎性介质及趋化因子对神经细胞损伤更为严重,因此激活小胶质细胞α7-nAChR,减少炎性介质及趋化因子的释放,削弱Aβ对神经细胞的损伤,可能是预防和治疗AD的有效措施,这一研究结果有可能对开发AD治疗新的策略产生影响。
[1] Findeis MA.The role ofamyloid beta peptide42 in Alzheimer′s disease[J].Pharmacol Ther,2007,116(2):266-286.
[2] Tracey KJ.The inflammatory reflex[J].Nature,2002,420(6917):853-859.
[3] Wang H,Yu M,Ochani M,et al.Nicotinic acetylcholine receptor alpha7 subunite is an essential regulator of inflammation[J].Nature,2003,421(6921):384-388.
[4] Town T,Nikolic V,Tan J.Themicroglial"activation"continuum,from innate to adaptive response[J].JNeuroinflammation,2005,Oct31(2):24.
[5] Nagele RG,D′Andrea MR,Lee H,et al.Astrocytes accumulate A beta 42 and give rise to astrocytic amyloid plaques in Alzheimer disease brains[J].Brain Res,2003,971(2):197-209.
[6] Jen LS,Hast AJ,Jen A,et al.Alzheimer′s peptide kills cells of retina in vivo[J].Nature,1998,392(6672):140-141.
[7] Savage MJ,Lin YG,Ciallella JR,et al.Activation of c-Jun N-terminal kinase and p38 in an Alzheimer′s diseasemodel is associated with amyloid deposition[J].J Neurosci,2002,22(9):3376-3385.
[8] Halliday G,Robinson SR,Shepherd C,et al.Alzheimer′s disease and inflammation:a review of cellular and therapeutic mechanisms[J].Clin Exp Pharmacol Physiol,2000,27(1/2):1-8.
[9] 雷露雯,王勇.小胶质细胞α7-nAChR表达及意义[J].山东医药,2008,48(48):1-2.
[10]Zujovic V,Taupin V.Use of cocultured cell systems to elucidate chemokine-dependent neuronal/microglial interactions:control of microglial activation[J].Methods,2003,29(4):345-350.
Study on activation m icroglia′sα7-nAChR for reducing neuron toxicity induced by Aβprotein
LEILu-wen,LIWei-xuan,FENG Zhi-ming,DENG Chong,CHENG Xiang
(Nanhai People Hospital,Southen Medical Unversity,Foshan 520000,China)
ObjectiveTo investigate the activation ofmicroglia′sα7neuromal acetylcholine receptor(α7-nAChR)for reducing neuron toxicity,which resulted from accumultation ofβ-amyloid peptide 1-42(Aβ1-42)increased levels of pro-inflammatory factors,contributed to the local jnflammatory response.MethodsThe cortex of fetation 18 days rats were isolated andminced.The growth ofneuronswas observed with contrastphasemiroscop.The cellswere identified by immunocytochemistry after immunostaining with MAP-2 and NSE on the tenth day.The tenth day neurons coculture withmicroglai cells in the transwells.The cells randomly divided into four groups:blank control,Aβprotein group,coculture group;nicotin pretreat group.Neurons apoptosismodel was established by added Aβ1-42protein in each group after 96 hours,and the apoptosis ratswas analysed by FCM and fluorescencemicroscopy.ResultsNeuron cells after 10 days incubation were identified by immunocytochemistry,immunofluorescence staining and DAB staining show neuron cells stainning positive,purity ratio reached 94.49%.The neuron apoptosis ratio in activativemicroglia′sα7-nAChR group was lower than that in inactivative group.ConclusionActivativemicroglia′sα7-nAChR reduced neuron apoptosis ratio,so that protected neuron from the toxic effect induced by pro-inflammatory factors.
α7-nAChR;Immunocytochemistry;Neuron;Apoptosis
R965
A
2095-5375(2015)08-0435-004
广东省自然科学基金资助项目(No.07005203)
雷露雯,女,主管药师,研究方向:临床药学,E-mail:leiluwen618@163.com

