大花蕙兰快速繁殖体系的初步建立
胡燕梅,夏景波,方中明,郭云贵,杨永会
(1.江汉大学 期刊社,湖北 武汉 430056;2.暨南大学 生命科学技术学院,广东 广州 510632;3.武汉生物工程学院 生物科学与技术学院,湖北 武汉 430415)
大花蕙兰快速繁殖体系的初步建立
胡燕梅1,夏景波2,方中明*3,郭云贵3,杨永会3
(1.江汉大学期刊社,湖北武汉430056;2.暨南大学生命科学技术学院,广东广州510632;3.武汉生物工程学院生物科学与技术学院,湖北武汉430415)
摘要:探讨了4种大花蕙兰外植体诱导原球茎形成的效果和不同激素配比对茎尖原球茎诱导及增殖与分化培养的影响。结果表明:诱导原球茎适宜外植体为茎尖,培养60 d后诱导率达到76.0%。而其他3种外植体均不能有效诱导原球茎形成;其中0.5 mg/L 6-BA +0.1 mg/L NAA激素组合诱导茎尖原球茎形成率达到87.8%;而茎尖原球茎在各激素组合处理中增殖率均能达到100%。原球茎在1.5 mg/L KT +0.5 mg/L IBA激素组合中增殖与分化效果最好,增殖系数和分化系数分别达到5.19和2.80。
关键词:大花蕙兰;快速繁殖;茎尖;原球茎;增殖与分化
大花蕙兰为兰科兰属植物,是兰属中的大花附生种、小花垂生种以及一些地生兰经过100多年的多代人工杂交育成的品种群[1]。其叶长碧绿,花姿粗犷,豪放壮丽,是世界著名的“兰花新星”。它具有国兰的幽香典雅,又有洋兰的丰富多彩,在国际花卉市场十分畅销,深受花卉爱好者的喜爱[2]。为加快其繁殖速度、缩短繁殖周期,大花蕙兰的育苗常常采用植物组织培养方式[3-4]。根据已有的研究报道,大花蕙兰组织培养一般采用原球茎途径[5-8],即原球茎的成功诱导与增殖培养是大花蕙兰利用植物组织培养方式实现快速繁殖的首要步骤。植物激素是组织培养过程中的关键性物质,各激素在培养基中相互协调、相互影响,协同促进培养物的生长与发育。外源激素中常用的有细胞分裂素和生长素。本试验探讨了4种不同外植体诱导原球茎产生的效果和不同激素组合对茎尖原球茎诱导和增殖分化的影响,为利用植物组织培养方式实现大花蕙兰种苗快速繁殖打下基础。
1 材料与方法
1.1材料来源和培养条件
大花蕙兰组培苗购于云南高科农业有限公司。将无菌组培苗取出,选取不同外植体接种于相应培养基中,探讨其原球茎诱导效果。后期又将成功诱导的原球茎通过无菌操作接种于增殖和分化培养基中。培养方式为固体培养,于(25±2)℃光照培养箱中,光照时间为12 h/d。
1.2试验方法
1.2.1外植体对大花蕙兰原球茎诱导的影响4种外植体分别取自大花蕙兰幼叶、茎尖、根尖及根兜。在无菌条件下,将大花蕙兰无菌组培苗置于超净工作台上,剥去组培苗外面数层叶片。取最里层幼叶,用解剖刀切成约1 cm2的小块作为外植体用于接种;将里层幼叶剥离后取2~3 mm茎尖作为外植体用于接种;将嫩根根尖切成0.3~0.6 cm小段作为外植体用于接种;切取根基部0.1~0.2 cm根兜作为外植体用于接种;将不同外植体分别接种于MS + 1.0 mg/L 6-BA +0.1 mg/L NAA +30 g/L蔗糖+7 g/L琼脂+2 g/L活性炭+100 g/L香蕉汁培养基中培养30 d和60 d后统计结果。
香蕉汁制法:100 g去皮的新鲜香蕉,剪成小块,放于约500 mL蒸馏水中加热搅拌成糊状,4层纱布多次过滤,收集滤液用于培养基的配置。
1.2.26-BA与NAA组合对茎尖原球茎诱导的影响以茎尖为外植体,以MS+30 g/L蔗糖+7 g/L琼脂+ 2 g/L活性炭+100 g/L香蕉汁为基本培养基,分别加入0.5、1.0、1.5、2.0 mg/L 6-BA和0.1、0.2 mg/L NAA组合的8种不同配比的激素,以检测6-BA和NAA组合对茎尖原球茎诱导的影响。
1.2.3植物激素对大花蕙兰原球茎培养的影响试验以茎尖诱导的原球茎为接种材料,以MS+30 g/L蔗糖+7 g/L琼脂+2 g/L活性炭+100 g/L香蕉汁为基本培养基,KT+NAA和KT+IBA两组激素做供试因子,KT浓度设置为0.5、1.0、1.5、2.0 mg/L,NAA和IBA浓度均设置为0.1 mg/L和0.5 mg/L。分别研究两组激素组合对大花蕙兰原球茎增殖与分化培养的影响。
1.3数据统计与分析
外植体接种培养30 d和60 d后统计原球茎诱导率;原球茎接种培养60 d后统计其增殖率、增殖系数和分化系数。
有效接种数:经培养后未污染的接种数。
原球茎诱导率=(诱导出原球茎的有效接种数/有效接种数)×100%。
原球茎增殖率=(原球茎增殖的有效接种数/有效接种数)×100%。
原球茎增殖系数是以每个原球茎经培养60 d后所形成的原球茎总个数的平均值(以3 mm左右的原球茎小块为标准进行统计)。
分化系数是以每个原球茎经培养60 d后分化出的试管苗总数的平均值。
采用Excel 2003对数据进行处理,使用SPSS 17.0软件中完全随机单因素试验方差分析邓肯氏新复极差法评估各试验处理间差异的统计学意义。同列数据标有不同字母表示差异有统计学意义(P <0.05)。
2 结果与分析
2.1不同外植体对原球茎诱导的影响
4种外植体接种于培养基中培养后效果差异较大(见图1)。茎尖培养初期膨大成乳白色球状物,继续培养后期形成典型的原球茎,且颜色逐渐加深,由乳白色变为黄绿色,最后成绿色。茎尖形成的原球茎虽个体生长缓慢,但绿色加深,后期在原球茎顶部出现芽尖并分化成苗。根尖培养7 d后开始膨大并伸长,表面粗糙并长出乳白色的小突点,14 d后体积增大2~4倍。但继续培养根尖顶端只是不断伸长,60 d后再无明显变化,没有成功诱导出原球茎。幼叶培养20 d后叶片明显长大,但无卷曲、变厚的生长迹象,培养40 d后叶片停止生长,约50 d后叶片发黄而枯死。根兜培养初期体积膨大,但后期继续培养所有根兜均发黄而枯死,无生长迹象。
4种外植体培养30 d和60 d后诱导情况统计结果见表1。大花蕙兰4种不同外植体在同一培养基上培养后原球茎诱导差异明显,仅茎尖部位成功诱导出原球茎,30 d时原球茎诱导率达到72.0%,60 d后原球茎诱导率达到了76.0%,表明随着时间延长茎尖诱导率仍缓慢增加。而另外3种外植体幼叶、根尖和根兜诱导率均为0,没有成功诱导出原球茎。

图1 4种外植体培养60 d后的效果Fig.1 Culture effects of four kinds of explants after 60 d

表1 4种外植体诱导原球茎的效果Tab.1 Inducing effects of protocorm with four kinds of explants
2.26-BA与NAA组合对茎尖原球茎诱导效果的影响
将茎尖接种于不同配比的6-BA和NAA激素组合的培养基中,培养30 d和60 d后其原球茎诱导效果见表2。从表2可以看出原球茎诱导率培养60 d普遍较培养30 d高,表明随着培养时间延长原球茎诱导率增加。0.1 mg/L NAA处理组培养60 d后平均诱导率达到72.4%,0.2 mg/L NAA处理组仅达到63.9%,即低浓度NAA更利于茎尖原球茎的诱导。而在0.1 mg/L NAA同一处理组中,6-BA浓度越高原球茎诱导率越低,诱导效果越差。其中0.5 mg/L 6-BA +0.1 mg/L NAA较适合于原球茎诱导,其诱导率最高,达到了87.8%。
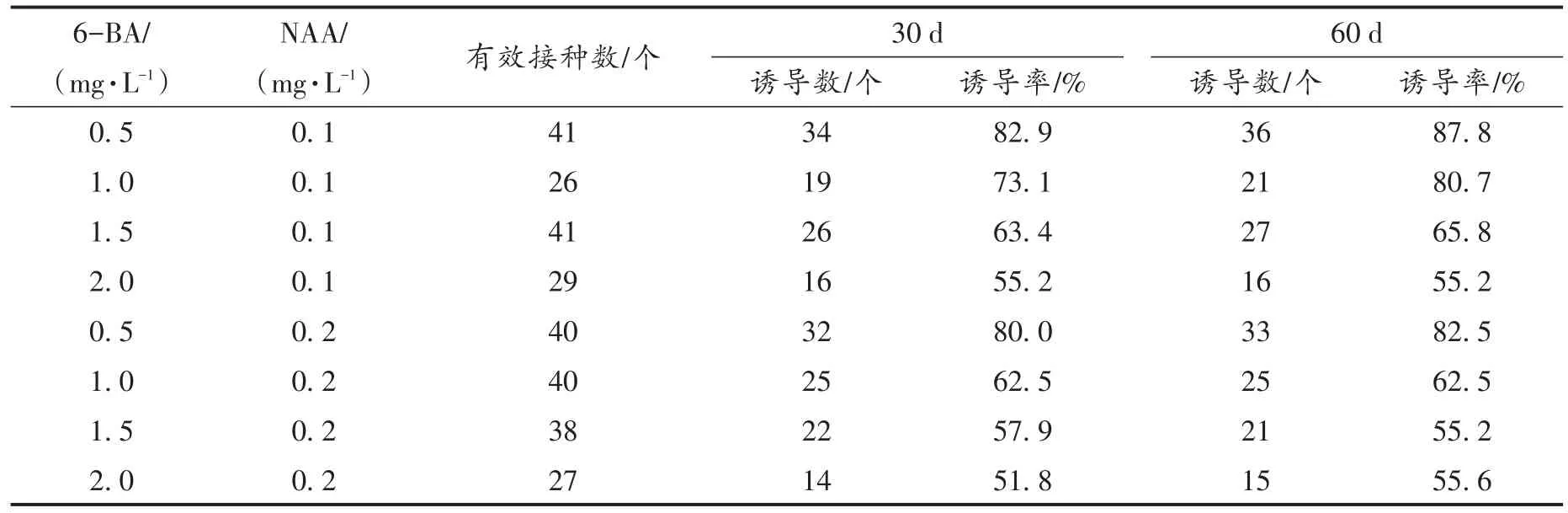
表2 BA与NAA组合对茎尖原球茎诱导的影响Tab.2 Influence of BA and NAA treatment to protocorm induced by stem tip
2.3植物激素对大花蕙兰原球茎增殖和分化的影响
将茎尖诱导的原球茎经过适当切割后,接种于KT+NAA和KT+IBA两组激素处理组的培养基中培养60 d后,发现原球茎均不同程度的生长变大,有增殖现象,且增殖率均达到了100%。原球茎在增殖生长的后期均分化出芽尖,后期芽尖长成小试管苗,长势明显(见图2)。

图2 培养60 d后的原球茎及其上分化出的小试管苗Fig.2 After 60 d culture of protocorm
不同处理组的原球茎增殖和分化效果差异明显,统计培养60 d后原球茎的增殖系数与分化系数,结果见表3。从表3中可以看出1.5 mg/L KT+0.5 mg/L IBA处理组的大花蕙兰原球茎增殖系数和分化系数均达到显著性最高,即5.19和2.80。将表3中KT+NAA和KT+IBA处理组数据进行平均处理,结果见表4。由表4可知,高浓度0.5 mg/L的生长素NAA和IBA促进原球茎增殖和分化的效果要显著好于0.1 mg/L处理组,即生长素浓度对原球茎增殖与分化有主要影响。而在浓度相同的情况下,NAA处理略强于IBA处理,但两种生长素处理的原球茎增殖系数与分化系数差异均无统计学意义,表明同浓度的NAA和IBA即生长素种类对原球茎增殖与分化无显著性影响。
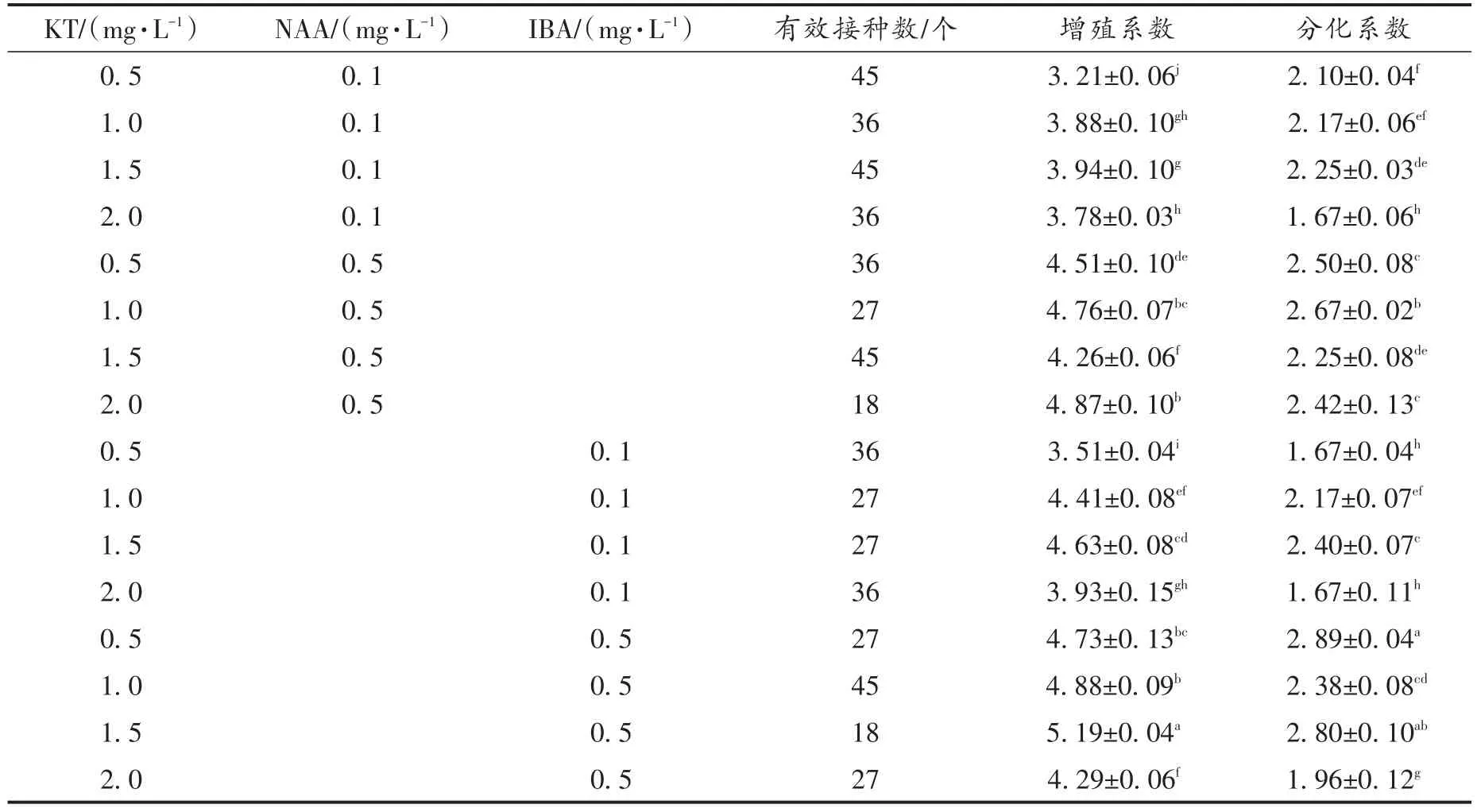
表3 植物激素对大花蕙兰原球茎培养的影响Tab.3 Influence of plant hormone to cymbidium protocorm culture

表4 植物激素对大花蕙兰原球茎培养的数据平均处理后的结果Tab.4 Data results of influence of plant hormone treatment
试验结果表明:激素组合为KT+IBA时利于原球茎增殖与分化,其中1.5 mg/L KT +0.5 mg/L IBA处理组原球茎增殖与分化效果最好。
3 讨论
利用4种大花蕙兰外植体对其诱导原球茎做了初步研究。结果表明:诱导原球茎适宜外植体为茎尖,其中0.5 mg/L 6-BA + 0.1 mg/L NAA为茎尖诱导原球茎较适激素组合,培养60 d后原球茎诱导率达到87.8%;而幼叶、根尖和根兜效果均不如茎尖效果明显。目前,已报道大花惠兰组织培养使用的外植体有茎尖[9-11]、茎段[12]、花梗[12]、叶片[12]、花瓣[12]、幼根[13]等,但除茎尖外,其他外植体培养成功率很低。本试验采用的4种外植体诱导原球茎,结果也表明采用茎尖作为外植体进行诱导培养容易成功,获得的原球茎性状均一,繁殖速度快。但茎尖作为外植体采集时容易损伤大花蕙兰母株,而且取材难度相对较大,增加了组织培养的生产成本。国内对于大花蕙兰根尖进行原球茎诱导的研究很少,赵颖等[13]报道的根尖诱导效果较好,而本试验中根尖初次培养并没有成功诱导出原球茎,可能与试验所用大花蕙兰品种差异有关。在根尖诱导培养的后续试验中将根尖顶部新长出的根尖切下,接入含MS+1.5 mg/L 6- BA +0.1 mg/L NAA + 30 g/L蔗糖+7 g/L琼脂+2 g/L活性炭+100 g/L香蕉汁培养基中继续培养,根尖又继续伸长生长。这样将新长出的根尖重复接种培养两次后观察到根尖能诱导少量原球茎,培养2个月后诱导率达到了9.45%,但原球茎诱导率仍然远低于茎尖,表明根尖作为诱导原球茎形成的外植体部位有待进一步研究。
植物生长调节剂的使用是植物组织培养过程中的重要影响因子,也对原球茎的诱导与增殖培养起重要作用。谷祝平等[10]报道较低浓度6-BA促进原球茎的诱导,较高浓度的6-BA能促进大花蕙兰原球茎增殖。本试验在茎尖原球茎诱导阶段,结果也显示较低浓度即0.5 mg/L 6-BA诱导原球茎的效果最好,且诱导时间短、原球茎大。
在本试验中还探索了KT+IBA和KT+NAA激素组合对大花蕙兰原球茎增殖和分化效果的影响,其中1.5mg/L KT+0.5mg/L IBA效果最好。而龚汉雨等[14]报道植物生长素2,4-D也能够显著影响大花蕙兰原球茎的增殖,还有研究者尝试使用细胞分裂素TDZ,也获得了良好的效果[15-16]。因此,在今后的研究中,综合考虑多种激素组合、适宜的激素浓度及低成本的激素种类,以获得原球茎培养的适宜激素配方的培养基,是实现大花蕙兰组织培养的前期保证。
参考文献(References)
[1]张淑娟,刘与明.大花蕙兰的快速育苗[J].福建热作科技,1993,18(2):38-39.
[2]张晓申.大花蕙兰组培快繁技术研究[J].陕西农业科学,2008,54(6):45-46.
[3]李子红,贾燕.珍品兰花快速繁殖与养护[M].上海:上海科学技术出版社,2007:69.
[4]桂敏,王继华.观赏花卉良种繁育技术[M].北京:化学工业出版社,2010:73.
[5]孔祥莹,金雪花.大花蕙兰原球茎诱导培养的影响因素及褐化防治的研究[J].安徽农业科学,2013,41(20):8470-8471,8500.
[6]殷丽青,孙翊,周音,等.添加物和植物生长调节剂对铁皮石斛离体快速繁殖的影响[J].上海交通大学学报:农业科学版,2014,32(4):8-13,23.
[7]王丽丽,曹魏魏,高新龙,等.古巴兰的茎段原球茎诱导与植株再生的研究[J].生物学通报,2013,48(1):48-52.
[8]石晓东,高润梅.植物组织培养[M].北京:中国农业科学技术出版社,2009:211.
[9]相阳,杨同梅,雷勤峰.大花蕙兰组织培养的初步研究[J].山东林业科技,2009,39(3):58-59.
[10]谷祝平,颜廷进.大花蕙兰茎尖组织培养及其形态建成的研究[J].实验生物学报,1989(2):149-151.
[11]韩牙琴,林琳,赖钟雄.大花蕙兰茎尖培养研究[J].龙岩学院学报,2007,25(3):74-77.
[12]韩学颖,徐艇.大花蕙兰组培快繁与生根培养的研究[J].北方园艺,2007(5):203-204.
[13]赵颖,刘平生,张南.大花蕙兰的嫩根与根兜组织快繁技术研究[J].内蒙古林业科技,2010,36(3):48-51.
[14]龚汉雨,李和平,季华.不同激素配方对大花蕙兰原球茎增殖的影响[J].中南民族大学学报:自然科学版,2009,28 (2):46-48.
[15]吴晓霞,姜敦云,崔月花,等.大花蕙兰的组织培养和快速繁殖[J].植物生理学通讯,2002,38(2):141.
[16]徐宏英,赵玉明,谢海军,等.大花蕙兰组培快繁影响因素分析[J].园艺学报,2002,29(2):183-185.
(责任编辑:陈旷)
Preliminary Establishment of Rapid Propagation System of Cymbidium Hybridum
HU Yanmei1,XIA Jinbo2,FANG Zhongming*3,GUO Yungui3,YANG Yonghui3
(1.Periodicals Press,Jianghan University,Wuhan 430056,Hubei,China;2.School of Life Science and Technology,Jinan University,Guanghzou 510632,Guangdong,China;3.Life Science and Technology College,Wuhan Bioengineering Institute,Wuhan 430415,Hubei,China)
Abstract:The formation effects of protocorm of cymbidium induced by four kinds of explants are dis⁃cussed,as well as the influence of hormone proportion to proliferation and differentiation of protocorm in⁃duction.The experiment results showed the best explants for protocorm induction were stem tips,the in⁃ducing rate reached 76.0% after 60 days culture.The three other explants could not effectively induce the protocorm.With 0.5 mg/L 6-BA +0.1 mg/L NAA treatment,the formation rate of protocorm induced by stem tip reached 87.8%,and the proliferation rate of protocorm induced by stem tip with each hormone treatment all reached 100%,the proliferation and differentiation of protocorm were the best with the treat⁃ment of 1.5 mg/L KT + 0.5 mg/L IBA,the proliferation coefficient and the differentiation coefficient are 5.19 and 2.80,respectively.
Keywords:cymbidium;rapid propagation;stem tip;protocorm;proliferation and differentiation
*通讯作者:方中明(1984—),男,讲师,博士,研究方向:植物生物技术。E-mail:zmfang@mail.hzau.edu.cn
作者简介:胡燕梅(1979—),女,副教授,硕士,研究方向:植物学及植物生物技术。
基金项目:国家自然科学基金青年基金项目(31301250);湖北省教育厅科学技术研究项目(B20094008);武汉市高校科学研究项目(2008K079)
收稿日期:2015 - 03 - 03
DOI:10.16389/j.cnki.cn42-1737/n.2015.03.010
中图分类号:S682.31
文献标志码:A
文章编号:1673-0143(2015)03-0248-05

