蛋氨酸席夫碱氧钒(IV)配合物的合成及其与DNA相互作用
基础医学研究
蛋氨酸席夫碱氧钒(IV)配合物的合成及其与DNA相互作用
曹亚萍,易芩兰,刘洪梅,李海霞,左建丽,袁泽利
(遵义医学院 药学院,贵州 遵义563099)
[摘要]目的 开发具有新生物活性的非铂系前药并探寻其与DNA作用模式。方法 采用一锅法合成L-蛋氨酸缩芳香醛席夫碱和1,10-邻菲罗啉氧钒(IV)[VO(csal-L-meth)(phen)]配合物I,利用高分辨质谱、FT-IR谱及摩尔电导对其进行结构表征,并通过X射线单晶衍射测定其晶体结构。采用紫外(UV)及荧光光谱方法研究配合物I与鲱鱼精DNA的作用机制。结果 高分辨质谱和红外光谱及晶体测试结果证实目标配合物I为预期结构。目标配合物Ⅰ的晶体结构属于正交晶系(Orthorhombic),P21/c 空间群,晶胞参数为a=13.615(7)Å,b=9.615(5)Å,c=18.63(1)Å,α=γ=90.00°,β=94.963(7) °,V= 2 430.7(2)Å3,Dc= 1.457 g/cm3,μ= 0.640 mm-1,Z= 4,F(000)=1 092.0,R1=0.103 4,wR2=0.271 4 [I>2σ(I)], Gof=1.085。并以钒原子为中心形成了六配位变形的八面体构型。目标配合物与DNA作用研究表明:其能与DNA发生作用。结论 设计合成的新配合物I与DNA之间为典型的嵌插作用模式,这为了解其与DNA作用提供了理论依据和实验基础。
[关键词]蛋氨酸;席夫碱;氧钒(IV)配合物;晶体结构;DNA
自上世纪70年代顺铂被发现具有抗肿瘤活性并成功应用于临床以来,小分子金属配合物作为抗癌药研究成为经久不衰的热门研究课题[1-3]。作为人体必需的一种微量元素——钒,其配合物具有降血糖、消炎、抗菌等潜在的治疗效用[4-5]。有机钒配合物(尤以VO2+)除能提高钒化合物的生物利用度外,还能增强或改进药物分子的活性并降低钒的毒性[6-8]。同时,钒氧无机盐原料易得、价格低廉,对其进行药物开发研究,有望开发价格低廉的前药[8-9]。此外,含手性碳原子的氨基酸席夫碱及其过渡金属配合物在抗菌、抗肿瘤等生物活性中表现出良好的性能[10-11]。因而,对新的氨基酸席夫碱钒氧配合物的设计合成、结构及药理活性筛选正成为医药学的重要研究方向之一[11]。
DNA是生物的基本遗传物质和遗传信息的载体,也是基因表达的物质基础[12]。在前药研究中,DNA常作为如抗菌药、抗肿瘤药、抗病毒药等研究的重要靶点[12]。小分子过渡金属配合物与DNA的相互作用研究是无机化学和生物学交叉的研究领域,通过它们相互作用研究有助于从分子水平上理解某些疾病的发病机理,也可以通过分子设计来寻找新的有效的治疗药物[13]。因此,为开发具有新生物活性的非铂系前药,本文设计合成了一个新的蛋氨酸席夫碱氧钒和1,10-邻菲罗啉配合物[VO(csal-L-meth)(phen)](I),并经高分辨质谱、红外光谱和X射线单晶衍射等对其结构进行了表征。在模拟生理(pH=7.40)条件下,采用紫外光谱和荧光光谱方法对目标配合物与鲱鱼精DNA的作用机制进行研究,希望为含氨基酸席夫碱氧钒(IV)配合物的药用机理提供一定的理论参考和依据。
1材料与方法
1.1仪器与试剂Varian 1000 FT-IR红外光谱仪(4 000- 400 cm-1,KBr压片,美国Varian公司); Micromass LCT Premier XE高分辨质谱仪(德国Bruker公司);Bruker APEX2 Smart CCD型单晶X射线衍射仪(德国 Bruker 公司);DDS-307精密型电导率仪(上海仪电科学仪器股份有限公司);TU-1901紫外-可见分光光度计(北京谱析仪器公司);Vary Eclipse荧光分光光度计(美国Varian公司);奥立龙868型pH计(美国Thermo公司)。
三羟甲基胺基甲烷(Tris,上海蓝季科技发展有限公司);鲱鱼精DNA(生化试剂,美国Sigma公司,于4 ℃保存备用);吖啶橙(AO,成都科龙化工试剂厂);实验用水均为二次蒸馏水,其他试剂均为分析纯。
1.2目标配合物I的合成称取149 mg(1 mmol)L-蛋胺酸和70 mg(1 mmol)的氢氧化钾于100 mL三口瓶中,加入50%甲醇水溶液10 mL,加热使其完全溶解后,加入含156 mg(1 mmol) 5-氯水杨醛的10 mL甲醇溶液加热回流1 h。称取163 mg(1 mmol)的硫酸氧钒溶解于5 mL水中,缓慢滴入上述反应液中,滴毕加热回流反应1 h, 溶液变为土红色。再称取198 mg (1 mmol)的1,10-邻菲罗啉溶解于10 mL无水甲醇中,缓慢滴入上述反应液中,继续加热回流反应1 h。冷却后,抽滤得褐色固体,用水、甲醇和乙醚洗涤(各15 mL×3),真空干燥后用二氯甲烷∶甲醇=1∶1(v:v)重结晶得褐色块状晶体,产率:74.3%。H RMS(ESI-MS),理论计算值C24H20N3O4SClV:532.892 8(M+),实测值:532.936 5 (M+);FT-IR(4 000-400 cm-1, KBr压片)3 480,3 423,2 927,2 900,2 853,1 656,1 628,1 525,1 457,1 392,1 177,959,849,727,554,461;Λm(DMF:H2O) = 1∶1-v/v, 1.0 × 10-5mol/L, Ω-1·mol-1·cm2):5.90。目标配合物I的分子结构(见图1)。

图1 目标配合物I的分子结构
1.3晶体结构测定及解析将配合物I用体积比为1∶1的甲醇和二氯甲烷溶液溶解后放置于室温下缓慢挥发,1周后可得适宜测试的晶体。并在Bruker APEX2 Smart CCD单晶衍射仪收集数据,采用经石墨单色器单色化的Mo Kα射线(λ=0.071 073 nm),以φ-ω扫描方式收集单晶衍射数据。强度数据进行了经验吸收校正、LP 校正。晶体结构由直接法解得。对全部非氢原子坐标及其各向异性热参数进行了全矩阵最小二乘法修正。所有计算均用SHELX-97程序完成。
1.4光谱法测定DNA待测液用UV测定A260/A280大于1.8,说明该溶液中基本不含蛋白质,其纯度满足实验要求。根据ε260=6 600 L/mol/cm确定其浓度,于0~5 ℃冰箱中备用。其余各种溶液均用pH=7.40的Tris-HCl缓冲溶液配制,摇匀,置于0~5 ℃冰箱中做供试液备用。各测定实验将供试液配制所需浓度后均以pH=7.40的Tris-HCl缓冲溶液空白为参比,扫描吸收光谱或荧光光谱。荧光光谱测定的激发和发射光谱扫描狭缝宽度均为5 nm,λex=260 nm。
2结果
2.1结构表征目标配合物I的高分辨质谱测试的测试值与计算值吻合较好,表明它们为预期的分子组成。而在目标配合物的红外光谱中,2 853~2 927 cm-1处出现了吸收峰为蛋氨酸分子中的甲基和亚甲基特征振动吸收峰。在1 656 cm-1处的吸收峰为席夫碱υ(C=N)特征振动吸收峰[3],表明席夫碱结构的生成;而在1 628 cm-1处应归属为羧基υas(COO-)的吸收峰[3,14]。同时,在1 392 cm-11处出现了υs(COO-)的吸收峰[3,14],对称和不对称的羧基振动吸收峰之差(△υ)大于200 cm-1,表明了羧基中仅有单个氧原子与金属离子配位[15]。在两个配合物中于1 177 cm-1附近还出现了酚环的υ(Ph-O)特征振动吸收峰[3,16],进一步说明了酚环存在于目标配合物结构中。还于959 cm-1处观察到υ(V=O)特征振动吸收峰[17],这能够说明目标配合物中有过渡金属氧钒的存在。而在554 cm-1和461 cm-1处为υ(V-N)和υ(V-O)的特征振动吸收峰,证明了钒与氧和氮的配位。
目标配合物I的摩尔电导率均很小,说明其在研究的溶液中以非离子的形式存在,即配合物在溶液中不会自发分解[3]。
2.2晶体结构单晶X射线衍射测试表明,目标配合物I的晶体结构属于单晶系(Orthorhombic),P21/c 空间群,其分子式为C24H20ClN3O4SV (Mr=532.88), 晶胞参数为a=13.615(7)Å,b=9.615(5)Å,c=18.63(1)Å,α=γ=90.00°,β=94.963(7) °,V= 2 430.7(2)Å3,Dc= 1.457 g/cm3,μ= 0.640 mm-1,Z= 4,F(000)=1 092.0,光源:Mo Kα 射线(λ=0.071 073 nm),R1=0.103 4,wR2=0.271 4 [I>2σ(I)], Gof=1.085。晶体结构数据存于英国剑桥数据中心, CCDC为1 438 252。
目标配合物I的分子结构以及由分子间氢键形成的网状结构示于图2中,主要键长和键角列于表1中,分子间氢键列于表2中。由图2A可以看出,配合物I的分子结构中由VO2+、席夫碱配体和1,10-邻菲咯啉配体共同组成。在配合物的分子结构中,配位的中心金属离子钒V(1)以六配位分别与席夫碱配体中的N(3)、O(2)和O(3)以及1,10-邻菲罗啉中的2个N(1)和N(2)以及氧钒中的O(1)进行配位。
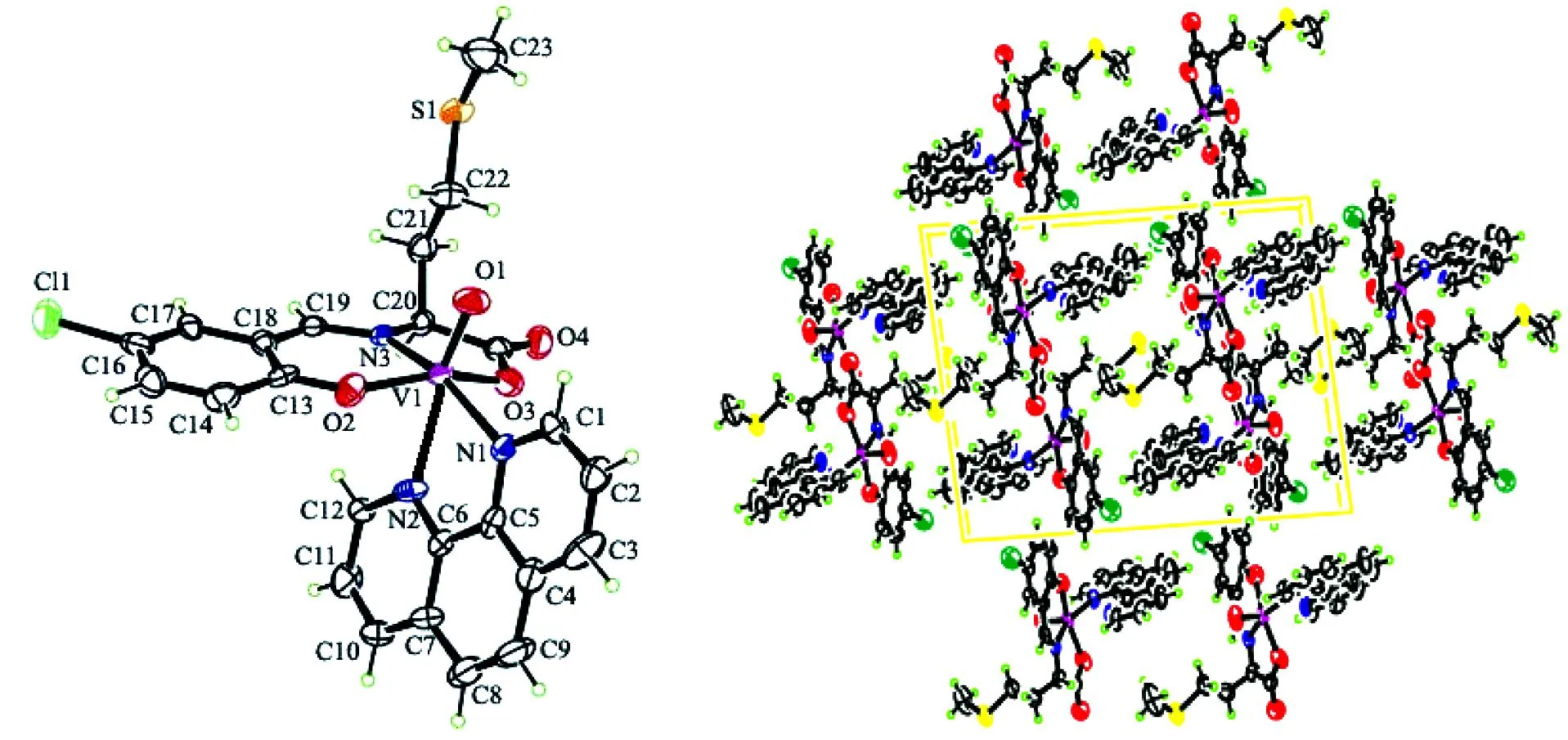
图2 配合物I的分子结构(椭球几率30%)(A)及其通过氢相互作用形成的网状结构(B)
从图2A中还可以看出:配合物I分子中的钒(IV)原子V(1)处于变形的八面体配位环境之中,通过席夫碱配体上三齿的酚羟基O(2)原子、席夫碱亚氨基N(3)原子、氨基酸羧基O(3)原子和1,10-邻菲咯啉配体上的N(1)和N(2)原子处于该变形八面体的赤道平面上。此外,在配合物的分子结构中,以V(1)原子为中心,分别形成了V(1)-N(1) -N(2) -C(6) -N(5)的五圆环(i)和V(1)-O(3)-C(20)-C(21)-N(3)的五圆环(ii)以及1个六圆环V(1)-O(2)-C(13) -C(18)-C(19)-N(3),其形成的第1个五圆环(i)的扭转角为3.85(45)°,而六圆环的扭转较为:2.96(41)°,说明形成了较好的环共面性进而增加配合物的稳定性。五圆环(i)与六圆环形成的二面角为78.458(263)°,五圆环(ii)与六圆环形成的二面角为10.776(1 249)°,五圆环(i)与五圆环(ii)形成的二面角为86.170(237)°。
由表1可知,目标配合物I的钒氧键V(1)-O(1)的键长为1.569(6)Å,为典型的钒氧双键(V=O)[3,5],与前文报道的钒氧键键长几乎相等,其余键长与类似结构相比均在合理范围内。
表1目标配合物I的选择性键长(Å)和键角(°)

键长(Å)键角(°)C1-N11.300(15)O1-V1-O2101.4(5)C5-N11.393(16)O2-V1-O3157.4(4)C6-N21.351(16)O1-V1-N3104.1(4)C12-N21.343(15)O2-V1-N389.6(4)C13-O21.345(15)O3-V1-N378.4(4)C19-N31.340(15)O1-V1-N193.8(4)C20-O41.201(15)O2-V1-N193.9(4)C20-O31.283(16)O3-V1-N191.6(4)N1-V12.166(10)N3-V1-N1160.8(4)N2-V12.364(10)O1-V1-N2167.3(4)N3-V12.041(10)O2-V1-N278.8(4)O1-V11.622(9)O3-V1-N281.8(4)O2-V11.942(9)N3-V1-N288.6(4)O3-V11.978(10)N1-V1-N273.6(4)
由图2 B可以看出,在目标配合物的晶体结构中,存在着在C--H···O和C--H···S两种氢键,由此构成了网状结构[18],其氢键键长和键角(见表2)。表2目标配合物I的氢键键长(Å)和键角(°)a

D—H…Ad(D—H)d(H…A)d(D…A)∠(D—H…A)C(12)--H(12)…O(4)0.932.493.3845(6)161C(19)--H(19)…S(1)0.932.843.5861(9)138C(21)--H(21)…O(3)0.982.363.2891(7)158
aSymmetry codes: (i) 1-x,2-y,1-z; (ii) 1-x,1/2+y,1/2-z。
2.3目标配合物I与DNA的作用方式探索
2.3.1紫外光谱法考察DNA对目标配合物I吸收光谱的影响在0-6号5 mL容量瓶中加入一定体积的目标配合物I,使其终浓度均为3.0×10-6mol/L。再依次往各容量瓶中加入不同体积的DNA(1.0×10-5mol/L),最后用Tris-HCl(pH=7.40)定容,测其紫外光谱(见图 3)。由图3可知,随着DAN浓度的增加,目标配合物I在264 nm左右的吸光度值呈逐渐增加趋势,即引起增色效应。这说明了目标配合物I与DNA之间发生了较强的相互作用[12-13]。
2.3.2吖啶橙(AO)竞争性实验探索目标配合物I与DNA作用模式吖啶橙(AO)具有灵敏度高、膜通透性好和能专一嵌插于DNA的双螺旋碱基对之间的典型嵌插作用,可用其作为核酸的光谱探针[12-13]。为此,本文以吖啶橙(AO)为竞争分子考察了目标配合物I对AO-DNA体系和AO对I-DNA体系的竞争性实验,结果(见图 4)。

c1=3.00×10-6mol/L; cDNA=1.00×10-5mol/L(20 μL per scan), 0~6:0~120 μL。图3 不同浓度DNA对目标配合物I的紫外吸收光谱

cDNA=1.00×10-5mol/L; cAO=1.00×10-6mol/L; cI=1.0×10-5mol/L(20 μL per scan);0~6:0~120 μL。 图4 目标配合物I对AO-DNA体系(A)和AO对I-DNA体系(B)的荧光光谱的影响
由图4A可见,随着一定体积的目标配合物I逐渐加入AO-DNA体系,使得AO与DNA在525 nm处的强荧光发射峰逐渐减弱,与此同时在363 nm处逐渐形成新的荧光峰,这说明目标配合物I能将嵌插入DNA的AO从DNA中挤出,也说明目标配合物I与DNA之间具有强的嵌插作用。为进一步验证这一现象,将一定浓度的AO逐渐加入配合物I-DNA体系中进行了同样的考察(见图4B)。结果表明:目标配合物I与DNA在363 nm处的荧光峰几乎不随AO的量的增加而减弱,说明AO不能将与DNA发生嵌插作用的目标配合物I从DNA中挤出。进一步验证了目标配合物I与DNA之间存在着强嵌插作用。
2.3.3热变性实验若DNA受热时,其会发生变性,在紫外光谱中表现为其在260 nm处的吸收峰会产生增色效应,当增色效应达到一半时的温度,即为热变性温度(tm),通常DNA的t50在70~85 ℃[19]。当小分子与DNA双链发生嵌插作用时,DNA双螺旋结构更加稳定,结合作用增强,热变性温度增高。为进一步考察目标配合物I与DNA之间是否存在嵌插作用,在30~96 ℃温度范围内测定了DNA及DNA与不同浓度目标配合物I的吸光度变化情况,并以At/A50对温度作热变性曲线(见图5),其中At为任意温度时在260 nm处溶液的吸光度,A50是温度为50 ℃时在260 nm处溶液的吸光度。由图5可以发现,随着目标配合物I浓度的增加,DNA的热变性温度由69.56 ℃逐渐增大到82.11 ℃,进一步说明目标配合物I与DNA之间存在嵌插作用。

■: cI=0.0 mol/L;●: cI=5.0×10-6mol/L;▲: cI=15.0×10-6mol/L; cDNA=1.51×10-5mol/L; λem=362 nm。图5 目标配合物I对DNA热变性的影响
2.3.4阴离子猝灭剂KI对目标配合物I及目标配合物I-DNA体系荧光强度的影响I-离子为一动态猝灭剂[12-13]。与参比(Tris-HCl, pH=7.40)相比,当小分子与DNA发生嵌入作用时,I-的猝灭作用减弱[20],而当小分子与DNA发生沟槽作用时,I-的猝灭作用增强[20]。故可通过阴离子猝灭剂KI考察其对小分子荧光的猝灭作用并用以判断小分子与DNA的作用方式。
进一步考察了KI对目标配合物I及目标配合物I-DNA 体系荧光光谱的影响,结果示于图 6中。由图 6可以看出,阴离子猝灭剂对目标配合物I和目标配合物I-DNA体系荧光均无明显影响,说明目标配合物I与DNA之间不存在沟槽作用。
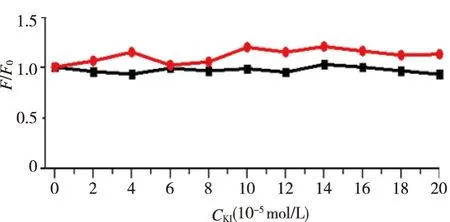
■:配合物I;●:配合物I+DNA。 图6 不同浓度的KI对目标配合物I及配合物I-DNA系统荧光光谱的影响
2.3.5氯化钠(NaCl)、磷酸钠(Na3PO4)离子强度对配合物I-DNA荧光光谱的影响由于DNA骨架中具负电荷,若小分子与DNA之间存在着静电作用,则离子强度会影响小分子与DNA之间的相互作用[20]。同时,在DNA骨架边缘部分带有的大量磷酸基团,若小分子与DNA之间存在静电作用,在小分子和DNA体系中加入磷酸根离子,则DNA骨架中的磷酸基团和加入的磷酸根离子会竞争小分子,进而引起光谱变化[21]。
为此,本文探索了以强电解质NaCl调节配合物I-DNA体系离子强度,和不同磷酸钠浓度对配合物I-DNA体系荧光光谱的影响,结果(见图7)。由图7可见,随着体系离子强度的增加,氯化钠和磷酸钠对配合物I-DNA体系荧光强度影响均很小,荧光基本不发生改变而几乎呈一直线。这表明目标配合物I与DNA之间确实不存在静电作用。

■: 配合物I-DNA体系中加入不同浓度的NaCl;●:配合物I-DNA体系中加入不同浓度的 Na3PO4;c1=3.00×10-6mol/L;cDNA=1.00×10-5mol/L。 图7 目标配合物I-DNA体系受NaCl和Na3PO4的荧光光谱影响
3讨论
对于金属配合物型前药的研制,常常需要通过配体的研制及纯化到配合物的研制到纯化的多步骤反应和处理过程。在本研究中,通过大量实验对比最终成功地以“一锅”合成法高收率地得到目标蛋氨酸席夫碱氧钒(IV)配合物I,该方法具有目标前药研制和纯化步骤简便、使用原料价廉、无需使用大量有机溶剂等优点,对于发展化学药物的低碳绿色技术具有十分重要的意义。
在目标配合物I的表征中由于VO2+中钒的氧化数为+4,价层电子中具有成单电子为顺磁性,不能进行核磁共振表证。故本文经高分辨质谱、红外光谱、摩尔电导率及单晶衍射等方法进行结构与组成表征,以上表征均能与预期结构吻合,说明了目标配合物I为预期结构和组成。
在模拟研究生理条件下(pH=7.40)目标配合物与DNA作用方式中,文献报道中多以溴化乙锭(EB)作为探针,而EB对人体和环境均具有毒性。为此,本研究采用对环境无毒性的吖啶橙(AO)作为荧光探针,其相比于常用的EB探针具有环境污染小的优点,这对于前药研发与环境保护同样具有重要意义。同时,通过紫外光谱法和荧光光谱法对目标配合物I与DNA的相互作用研究表明:目标配合物I与DNA作用机制为典型的嵌插作用模式,这为了解其与DNA作用提供了理论依据和实验基础。
[参考文献]
[1] 刘杰, 计亮年, 梅文杰. 金属钌配合物的抗肿瘤活性及其作用机理[J]. 化学进展, 2004, 16(6): 969-974.
[2] 吴庆, 袁泽利, 徐远飞, 等. 新型抗肿瘤药物双(β-二酮)钛(IV)配合物的合成[J]. 遵义医学院学报, 2010, 33(5): 425-427.
[3] 曹亚平, 易岑兰, 刘红梅, 等. 新型氧钒(IV)席夫碱配合物[VO(dtbsali-meth)(phen)和VO(hnaph-phe)(phen)]的合成及其抗肿瘤活性[J]. 合成化学, 2015, 23(12): 1124-1129.
[4] 边琳, 李连之, 王霞, 等. 混配氧钒配合物[VO(Naph-Phe)(Phen)]的合成、晶体结构及与DNA作用研究[J]. 无机化学学报, 2011, 27(4): 649-654.
[5] Qu D, Niu F, Zhao X L, et al. Synthesis, crystal structures, and urease inhibition of an acetohydroxamate-coordinated oxovanadium(V) complex derived from N′-(3-bromo-2-hydroxy -benzylidene)-4-methoxybenzohydrazide[J]. Bioorg Med Chem, 2015, 23(9): 1944-1949.
[6] 冯静楠. 钒-药物分子模拟物的合成、表征及性质研究[D].北京:首都师范大学, 2008.
[7] Ku W J, Suzuki T, SugiuraY, et al. Effective DNA cleavage by bleomycin -vanadium(IV) complex plus hydrogen-peroxide[J]. Biochem Biophys Res Commun,1985,129(2): 368-374.
[8] Bishayee A, Waghray A, Patel M A, et al. Synthesis and Characterization of some oxovana -dium complexes[J]. Cancer Letters, 2010, 294(19): 1-12.
[9] Habala L, Bartel C, Giester G, et al. Complexes of N-hydroxyethyl-N-benzimidazolyl methyl -ethylenediaminediacetic acid with group 12 metals and vanadium-Synthesis, structure and bio -activity of the vanadium complex[J]. J Inorg Biochem, 2015, 147:147-152.
[10] Özlem G, Perihan G, Gürkan P. Synthesis and characterization of higher amino acid Schiff bases, as monosodium salts and neutral forms. Investigation of the intramolecular hydrogen bonding in all Schiff bases, antibacterial and antifungal activities of neutral forms[J]. J Mole Struc, 2014, 1074: 62-70.
[11] Li L J, Fu B, Qiao Y, et al. Synthesis, characterization and cytotoxicity studies of platinum(II) complexes with reduced amino acid ester Schiff-bases as ligands[J]. Inorg Chim Acta, 2014, 419: 135-140.
[12] 宋文婷, 袁泽利, 余光勤, 等. 三唑席夫碱钛(IV)配合物的合成及其与DNA相互作用[J].分子科学学报, 2015, 31(5): 415-421.
[13] 袁泽利, 杨名惠, 易颜丹, 等. 分子光谱法研究新型抗肿瘤前药双(β-二酮)Ti(Ⅳ)与DNA相互作用[J]. 分子科学学报, 2012, 28(5): 383- 388.
[14] 赵小菁, 张丽影, 金黎明, 等. 氨基酸席夫碱的合成及性质研究[J].有机化学,2011, 31(9): 1561-1521.
[15] Patra A K, Bhowmick T, Ramakumar S, et al. DNA cleavage in red light promoted by copper(II) complexes of a-amino acids and photoactive phenanthroline bases[J]. Dalton Trans, 2008, 48(48): 6966-6976.
[16] 谢海泉, 党元林, 卓立宏. 过渡金属氨基酸席夫碱配合物的合成[J]. 合成化学, 2007, 15(3): 362-364.
[17] Banik B, Somyajit K, Koley D, et al. Cellular uptake and remarkable photocyto-toxicity of pyrenylter pyridine oxovanadium(IV) complexes of dipyridophenazine bases[J]. Inorg Chim Acta, 2012, 393(12): 284-293.
[18] 郭琼, 李连之, 董建方, 等. 氧钒配合物[VO(o-Van-Asn)(Phen)]·1.5CH3OH的合成、晶体结构及与DNA和BSA的相互作用[J]. 化学学报, 2012, 70(15):1617-1624.
[19] 童裳伦, 叶荣民, 张全, 等. S-异丙甲草胺与小牛胸腺DNA的相互作用[J]. 高等学校化学学报, 2010, 31(5): 905-910.
[20] Kumar C V, Turner R S, Asuncion E H. Groove binding of a styrylcyanine dye to the DNA double helix: the salt effect[J]. J Photochem Photobio1 A Chem, 1993, 74(2): 231-238.
[21] 赵娜, 王兴明, 王单, 等. 色氨酸-镝(亚)配合物与鲱鱼精DNA的作用方式 [J]. 无机化学学报, 2009, 25(12): 2129-2136.
[收稿]2015-09-23;修回2015-10-28]
(编辑:王静)
Synthesis, and interaction with DNA of a new oxovanadium (IV) complex containingL-Methionine Schiff base and 1,10-phenanthroline
CaoYaping,YiCenlan,LiuHongmei,LiHaixia,ZuoJianli,YuanZeli
(School of Pharmacy, Zunyi Medical University, Zunyi Guizhou 563099, China)
[Abstract]Objective To discover the novel bioactivities of non-platinum metallic prodrug, and explore the mode of action between complex and DNA of herring sperm.Methods The new oxovanadium (IV) complex, [VO(csal-L-meth)(phen)](I) (where, csal-L-meth = Schiff base derived from 5-chlorosalicylaldehyde andL-methionine, phen =1,10-phenanthroline) was synthesized by one-pot, and characterized by IR, H RMS spectra, molar conductance and single-crystal XRD.Results Single crystal X-ray diffraction results show that this complex structure belongs to orthorhombic crystal system, space groupP21/c with the following crystallographic parameters:a=13.615(7)Å,b=9.615(5)Å,c=18.63(1)Å,α=γ=90.00°,β=94.963(7) °,V= 2 430.7(2)Å3,Dc= 1.457 g/cm3,μ= 0.640 mm-1,Z= 4,F(000)=1 092.0,R1=0.103 4,wR2=0.271 4 [I>2σ(I)], Gof=1.085. The V(IV) atoms in complex(I) is six-coordinated in a distorted octahedral environment. The interaction between complex and DNA of herring sperm was studied by UV-vis and fluorescence spectroscopy using acridine orange (AO) as a fluorescence probe in Tris-HCl buffer (pH=7.4).A new amino acid Schiff base oxovanadium (IV) complex (I) has been synthesized, and it can interact with DNA.Conclusion The mode of action between complex (I) and DNA was a classical intercalation mode. Therefore, the result above will provide theoretical and experiment basis for understanding the interaction of DNA with new amino acid Schiff base oxovanadium (IV).
[Key words]L-Methionine; Schiff base; oxovanadium (IV) complex; crystal structure; DNA
[中图法分类号]R614.3
[文献标志码]A
[文章编号]1000-2715(2015)06-0584-07
[通信作者]袁泽利,男,博士,教授,硕士生导师,研究方向:药物设计合成及性能研究,E-mail:zlyuan2002@126.com。
[基金项目]国家自然科学基金资助项目(NO:81360471);贵州省国际合作项目(NO:[2012]7036);贵州省科技创新人才团队项目(NO:2014GZ 71255);国家大学生创新项目、贵州省大学生创新项目(NO:201510661007);遵义医学院大学生创新项目(NO:[2014]5809)。

