新型心脏置入器械血管入路和相关并发症的预防
王 建 王 焱
新型心脏置入器械通常通过髂-股动脉入路,入路的并发症可影响患者预后[1]。在经导管主动脉瓣置入(TAVI)手术中,非标准化定义的主要血管并发症发生率为4%~34%,并且使术后30 d死亡率增加2~3倍[2]。既往有研究者认为,经心尖部的TAVI血管并发症较经股动脉少,但近期多个荟萃研究提示,经动脉TAVI患者的预后明显优于经心尖部 TAVI的患者[3-4],这可能与围手术期出血和卒中发生率较低相关。因此,筛选出并发症高危患者,选择适当的入路,采取预防措施,以降低患者的血管入路并发症,对改善患者预后有重要意义。本文主要介绍新型心脏置入器械(主要为TAVI)中血管入路和相关并发症及其对患者预后的影响,以及出现并发症后的应对策略。
1 血管入路和相关并发症的定义
2011年瓣膜协会研究委员会(VARC)制定了TAVI研究的相关终点:死亡、心肌梗死、卒中、出血、急性肾损伤、血管入路及相关并发症和置入瓣膜的功能[2]。随后的研究发现VARC的某些定义有待修订[5]。更新后的 VARC-2共识将传导异常和心律失常纳入了研究终点,并增加了心脏超声、生活质量及瓣膜功能的评估[6]。目前,该共识已被广泛接受,并用于新型置入器械的终点事件评价。VARC-2共识中,血管入路和相关并发症包括3类:主要血管并发症、次要血管并发症以及经皮封闭装置失效。
2 入路选择对临床预后的影响
TAVI技术的手术路径包括:早期的顺行法(经股静脉穿刺房间隔已较少用)、经股动脉、经心尖、经主动脉、经腋或锁骨下动脉途径等。目前,最常用的仍为经心尖和经股动脉途径。装置的不断改进使术中使用的鞘管越来越小。美敦力的Core Valve装置使用的鞘管由第1代的25 F降至第3代的18 F;Edwards SAPIEN 装置则由22/24 F降至18/19 F(22 F和18 F鞘管仅用于23 mm瓣膜的置入);PARACHUTE装置则根据置入装置的大小,分别采用14 F和16 F的鞘管。Panchal等[3]比较了使用Edwards SAPIEN瓣膜、经股动脉和经心尖部的TAVI术后2 978例患者的死亡率和主要不良心血管事件,发现经股动脉组的TAVI术后患者30 d死亡率明显低于经心尖组(OR=0.59,95%CI:0.45~0.76,P<0.000 1);尽管经股动脉组的大血管并发症发生率明显高于经心尖组,但两种入路方式对患者的1年死亡率、卒中、心肌梗死和出血事件没有影响。在一项包括10 468例接受TAVI患者的荟萃分析中,69.5%的患者经股动脉途径,其余经心尖部。结果显示,经股动脉组的30 d和1年死亡率均较低,这与该组的出血和卒中风险较低有关[4]。一项单中心研究纳入1 000例TAVI术后患者,发现经心尖组患者的logistic EuroSCOREⅠ较高(24.3%±16.2%对22.2%±16.2%,P<0.01);在使用logistic EuroSCOREⅠ匹配了外科手术风险后的两组患者(各354例)中,经股动脉组和经心尖组入路的TAVI患者的30 d和远期死亡率、心肌梗死、卒中、出血并发症、起搏器置入和中度主动脉瓣反流均无差异,经股动脉组的主要血管并发症发生率较高,经心尖组的1级肾脏并发症发生率较高[7]。
Adamo等[8]比较了322例接受自膨胀式瓣膜置入患者的预后,其中170例(53%)经股动脉,76例(23%)切开经股动脉,32例(10%)经腋动脉,44例(14%)经主动脉。结果显示,4组患者的30 d安全评估和1年临床有效率均无差异,而经股动脉组的放射线时间、对比剂用量和次要血管并发症较高。此外,次级入路的选择对于减少血管入路相关并发症也极为重要,桡动脉途径较股动脉更为安全。Allende等[9]比较了TAVI术中以桡动脉(335例)和股动脉(127例)作为次级入路的462例患者。在70例(15%)患者中出现了74次血管入路并发症;23%的血管入路相关并发症出现于次级入路,经股动脉组的血管并发症明显高于经桡动脉组(5.0%对0,P=0.005,校正P=0.014),且这些并发症导致危及生命出血事件增加(3%对0,P=0.040,校正P=0.049)。
3 血管入路和相关并发症的类型
表1为VARC和VARC-2共识中关于血管入路和入路相关并发症的定义。后者对前者作了进一步分类及补充:(1)预先计划的外科或血管内入路封闭应为TAVI操作的一部分,而并非并发症;(2)需记录左室心尖部、锁骨下动脉和主动脉等备选入路的并发症;(3)入路并发症常导致出血,应在两种并发症中同时记录;(4)VARC-2将所有血管并发症分为入口相关或非入口相关[6]。

表1 VARC和VARC-2关于血管入路和相关并发症的定义
4 血管入路和相关并发症预测因子
血管入路的选择与新型心脏置入器械的顺利置入、入路相关并发症的发生以及患者预后密切相关,血管并发症还增加患者围术期管理、输血、住院时间和医疗费用[10]。Hayashida等[11]总结了130例连续经股动脉TAVI患者,102例置入Edwards SAPIEN(18~24 F鞘管),27例置入 Core Valve瓣膜(18 F鞘管)。根据VARC标准,血管并发症的发生率为27.6%(主要血管并发症17.3%,次要血管并发症10.2%),主要血管并发症的发生与30 d死亡率相关;团队经验、血管钙化和鞘/股动脉比值可作为血管并发症的预测因子。此外,血管并发症的预测因子还包括:入路血管钙化[12]、女性[13]、学习曲线[14]、糖尿病和logistic EuroSCORE[10]等。
5 血管入路和相关并发症预防策略
血管并发症的发生与置入器械的设计、装置大小、患者的血管解剖以及团队经验密切相关。因此,术前评估患者的外周血管对于决定入路位置和方式有重要意义。目前,评估患者血管入路的手段主要包括:血管造影、血管CT、核磁共振血管成像和血管内超声。图1为本院1例患者的TAVI术前股动脉入路筛选情况,包括血管造影和血管CT成像,对于了解患者股动脉最小直径、狭窄部位、血管弯曲程度及穿刺或切开部位选择有指导意义。
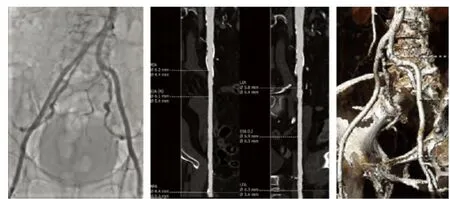
图1 术前股动脉入路筛选
在早期使用较大鞘管(22/24 F)作为介入通路时,往往采用外科切开[15]。这有助于选择理想的血管穿刺点,尤其适用于肥胖、原有股动脉置入物或移植物、股动脉分叉较高的患者[16]。随着装置的不断改进,使用的鞘管逐渐减小至目前的18 F,早期用于主动脉夹层修复、入路封闭的完全穿刺技术逐渐在TAVI术中应用,在有经验的心脏中心成功率可达90%,但有明显的学习曲线[17-18]。此外,对预计止血困难的患者,使用外周血管成形球囊(8~12 mm),通过对侧动脉交叉球囊封闭(crossover ballon occlusion)也是一种减少出血的 办法[17,19]。输送鞘管的选择也是减少入路血管并发症的关键。
根据患者的血管解剖、置入器械的特点和术者的经验,选用合适的输送鞘管,有利于缩短手术时间,减少血管并发症,改善患者预后。
[1] Ducrocq G,Francis F,Serfaty JM,et al. Vascular complications of transfemoral aortic valve implantation with the Edwards SAPIEN prosthesis:incidence and impact on outcome[J].EuroIntervention,2010,5:666-672.
[2] Leon MB,Piazza N,Nikolsky E,et al.Standardized endpoint definitions for transcatheter aortic valve implantation clinical trials:a consensus report from the Valve Academic Research Consortium[J].Eur Heart J,2011,32(2):205-217.
[3] Panchal HB,Ladia V,Amin P,et al.A meta-analysis of mortality and major adverse cardiovascular and cerebrovascular events in patients undergoing transfemoral versus transapical transcatheter aortic valve implantation using edwards valve for severe aortic stenosis[J].Am J Cardiol,2014,114(12):1882-1890.
[4] Conrotto F,D’Ascenzo F,Francesca G,et al.Impact of access on TAVI procedural and midterm follow-up:a metaanalysis of 13 studies and 10,468 patients[J].J Interv Cardiol,2014,27(5):500-508.
[5] Généreux P,Head SJ,Van Mieghem NM,et al.Clinical outcomes after transcatheter aortic valve replacement using valve academic research consortium definitions:a weighted meta-analysis of 3,519 patients from 16 studies[J].J Am Coll Cardiol,2012,59(25):2317-2326.
[6] Kappetein AP,Head SJ,Généreux P,et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation:the Valve Academic Research Consortium-2 consensus document[J].J Am Coll Cardiol,2012,60(15):1438-1454.
[7] Schymik G,Würth A,Bramlage P,et al.Long-term results of transapical versus transfemoral TAVI in a real world population of 1000 patients with severe symptomatic aortic stenosis[J]. Circ Cardiovasc Interv,2014,8 (1).pii:e000761.
[8] Adamo M,Fiorina C,Curello S,et al.Role of different vascular approaches on transcatheter aortic valve implantation outcome:a single-center study[J].J Cardiovasc Med(Hagerstown),2015,16(4):279-285.
[9] Allende R,Urena M,Cordoba JG,et al.Impact of the use of transradial versus transfemoral approach as secondary access in transcatheter aortic valve implantation procedures[J].Am J Cardiol,2014,114(11):1729-1734.
[10] Mwipatayi BP,Picardo A,Masilonyane-Jones TV,et al.Incidence and prognosis of vascular complications after transcatheter aortic valve implantation[J].J Vasc Surg,2013,58(4):1028-1036.e1.
[11] Hayashida K,Lefèvre T,Chevalier B,et al.Transfemoral aortic valve implantation new criteria to predict vascular complications[J].JACC Cardiovasc Interv,2011,4(8):851-858.
[12] Reinthaler M,Aggarwal SK,De Palma R,et al.Predictors of clinical outcome in transfemoral TAVI:Circumferential iliofemoral calcifications and manufacturer-derived recommendations[J].Anatol J Cardiol,2015,15(4):297-305.
[13] Généreux P, Webb JG,Svensson LG,et al.Vascular complications after transcatheter aortic valve replacement:insights from the PARTNER (Placement of AoRTic Tra Nscathet ER Valve)trial[J].J Am Coll Cardiol,2012,60(12):1043-1052.
[14] Lange R,Bleiziffer S,Piazza N,et al.Incidence and treatment of procedural cardiovascular complications associated with trans-arterial and trans-apical interventional aortic valve implantation in 412 consecutive patients[J].Eur J Cardiothorac Surg,2011,40(5):1105-1113.
[15] Leon MB,Smith CR,Mack M,et al.Transcatheter aorticvalve implantation for aortic stenosis in patients who cannot undergo surgery[J].N Engl J Med,2010,363(17):1597-1607.
[16] Toggweiler S,Webb JG.Challenges in transcatheter aortic valve implantation[J].Swiss Med Wkly,2012,142:w13735.
[19] Hayashida K, Lefèvre T, Chevalier B,et al. True percutaneous approach for transfemoral aortic valve implantation using the Prostar XL device:impact of learning curve on vascular complications[J].JACC Cardiovasc Interv,2012,5(2):207-214.

