蛋白质精氨酸甲基转移酶与肿瘤干预治疗
麻苗苗(综述),曹仁贤(审校)
(南华大学附属第一医院内分泌科,湖南 衡阳 421001)
肿瘤医学书
蛋白质精氨酸甲基转移酶与肿瘤干预治疗
麻苗苗(综述),曹仁贤※(审校)
(南华大学附属第一医院内分泌科,湖南 衡阳 421001)
摘要:寻找有效的肿瘤干预靶点对肿瘤患者具有重要意义。蛋白质精氨酸甲基转移酶(PRMTs)是催化蛋白质底物精氨酸残基甲基化的唯一关键酶,参与多种重要的基础细胞代谢过程。近年来的研究发现,异常表达的PRMTs可以通过促进催化精氨酸残基甲基化的过程参与肿瘤的发生与发展;PRMTs表达的高低可以作为判断肿瘤预后的因子。这些结果提示,如果针对性干预PRMTs或许可以给肿瘤患者带来临床获益。
关键词:蛋白质精氨酸甲基转移酶;精氨酸甲基化;肿瘤;干预治疗
肿瘤是导致人类死亡的主要疾病之一,仍然缺乏有效的治疗手段,在现有的治疗基础上寻找新的潜在治疗靶点对肿瘤患者具有重要的现实意义。深刻理解肿瘤的生物学特性、选择具有关键作用的调控分子作为干预对象是寻找潜在治疗靶点的核心[1]。精氨酸甲基化是一种普遍存在的翻译后修饰方式,涉及DNA修复、RNA加工、转录调控以及信号转导等多种细胞过程,蛋白质精氨酸甲基转移酶家族(protein arginine methyltransferases, PRMTs)是催化精氨酸甲基化完成的唯一酶[2-3]。大量研究证实,精氨酸甲基化在多种肿瘤的发生、发展及侵袭过程中起着重要的作用;同时研究发现PRMTs在肺癌、乳腺癌、结肠直肠癌、膀胱癌以及白血病等多种肿瘤中表达异常[4-11]。现就近年来有关PRMTs与肿瘤的研究进行综述,推测其或许是一个潜在的肿瘤干预治疗新靶点。
1PRMTs
目前在哺乳动物中共发现9种PRMT,每种PRMT都拥有一段共同的保守转甲基酶结构域,主要包括甲基供体的子域、S-腺苷-甲硫氨酸和底物蛋白[12]。PRMTs以S-腺苷-甲硫氨酸作为甲基供体,甲基化修饰蛋白精氨酸的胍基氮,生成S-腺苷同型半胱氨酸和甲基精氨酸。富含甘氨酸和精氨酸结构域的蛋白质是公认的PRTMs作用底物,但随着有关PRMTs研究的进展,研究发现PRMTs还可以甲基化单个精氨酸[3]以及脯氨酸、甘氨酸、蛋氨酸共有序列[13]等。目前已经发现超过120种包括组蛋白和非组蛋白在内的精氨酸甲基化蛋白[14-15],并且仍继续有新的精氨酸甲基化蛋白被发现,更多有关PRMTs的功能以及其在信号通路调控中的作用不断被发掘[14]。
根据PRMTs催化精氨酸残基生成的产物不同可以将其分为3型(表1)[2,16]。Ⅰ型PRMT[PRMT1、3、4/共激活相关的精氨酸甲基转移酶(coactivator-associated arginine methyltransferase, CARM)1、6和8]催化生成非对称性二甲基精氨酸;Ⅱ型PRMT(PRMT5)可以催化生成对称性二甲基精氨酸;Ⅲ型PRMT(PRMT7)催化生成单甲基精氨酸;PRMT 9目前暂未归类,推测其可能可以归类为Ⅱ型[17]。PRMTs催化精氨酸甲基化的过程是一种普遍存在的翻译后修饰方式,其涉及DNA修复、RNA加工、转录调控以及信号转导等多种重要的细胞生理过程(表1),如PRMTs通过甲基化RNA结合蛋白上的精氨酸参与转录后的基因调控[18];PRMTs能甲基化修饰组蛋白、共激活子环磷腺苷效应元件结合蛋白绑定蛋白 (cAMP-response element binding protein-binding protein,CBP)/p300以及转录因子,调节基因的转录、协助组蛋白的编码和促进信使核糖核蛋白的包装[19]等。在所有的PRMTs中以PRMT 1和PRMT5最为重要,缺失两者之中任何一种将导致机体生命活动障碍[20-21]。
2PRMTs与肿瘤
PRMTs通过精氨酸甲基化修饰参与多种细胞过程,在此基础上近年来的研究令人值得关注和进一步探索,即在多种肿瘤细胞中可以发现PRMTs异常表达(表2),并在这些肿瘤的发生、发展以及侵袭过程中起重要作用,提示通过干预PRMTs或许可能可以有效控制肿瘤的发展。目前在哺乳动物中发现了9种PRMTs,其中PRMT1、PRMT2、PRMT4/CARM1和PRMT7已经得到确认并且特征性的表达。
2.1PRMT 1PRMT1是最为重要的Ⅰ型PRMTs,在细胞质和细胞核中广泛表达,哺乳动物体内85%以上的精氨酸甲基化由其催化完成[17]。以前认为PRMT1只有一种形态,但目前的研究发现PRMT1有7种亚型,即PRMT1v1~v7[22]。随着对PRMT1深入的了解,近年来大量的研究发现PRMT 1在多种肿瘤疾病中异常表达,且大多数以表达增加为主[5,7-9,11]。在乳腺癌中,PRMT1基因以及蛋白的表达水平均明显上调,这一现象不仅在乳腺癌细胞系中存在,在乳腺癌肿瘤中同样存在[22],进一步通过免疫组织化学发现PRMT1的表达主要在细胞质中,而仅有小部分在细胞核中表达。临床研究发现乳腺癌患者高表达PRMT1v1基因预后不佳,且无病生存时间明显缩短[8]。

表1 蛋白质精氨酸甲基转移酶家族[16]
PRMTs:蛋白质精氨酸甲基转移酶;CARM1:共激活相关精氨酸甲基化转移酶1;H4R3:组蛋白H4第3位精氨酸;MRE11:染色体不稳定性相关基因MRE11,DNA损伤关键蛋白;53BP1:P53绑定蛋白1;SAM68:SRC相关的有丝分裂68×103蛋白;H3R8:组蛋白H3第8位精氨酸;RBS2:40S核糖体蛋白S2;p53:抑癌基因P53;H3R17:组蛋白H3第17位精氨酸;AIB1:乳腺癌扩增因子1;p300:组蛋白乙酰转移酶P300;CBP:CREP绑定蛋白;RNA pol ⅡCTD:RNA聚合酶ⅡC端结构域;piRNA:PIWI相互作用RNA;H4R3:组蛋白H4第3位精氨酸;E2F1:腺病毒E2启动子结合因子1;EGFR:表皮生长因子受体;CRAF:原癌基因丝苏氨酸蛋白激酶;H3R2:组蛋白H3第2位精氨酸; H2AR29:组蛋白H2A第29位精氨酸;H2AR3:组蛋白H2A第3位精氨酸
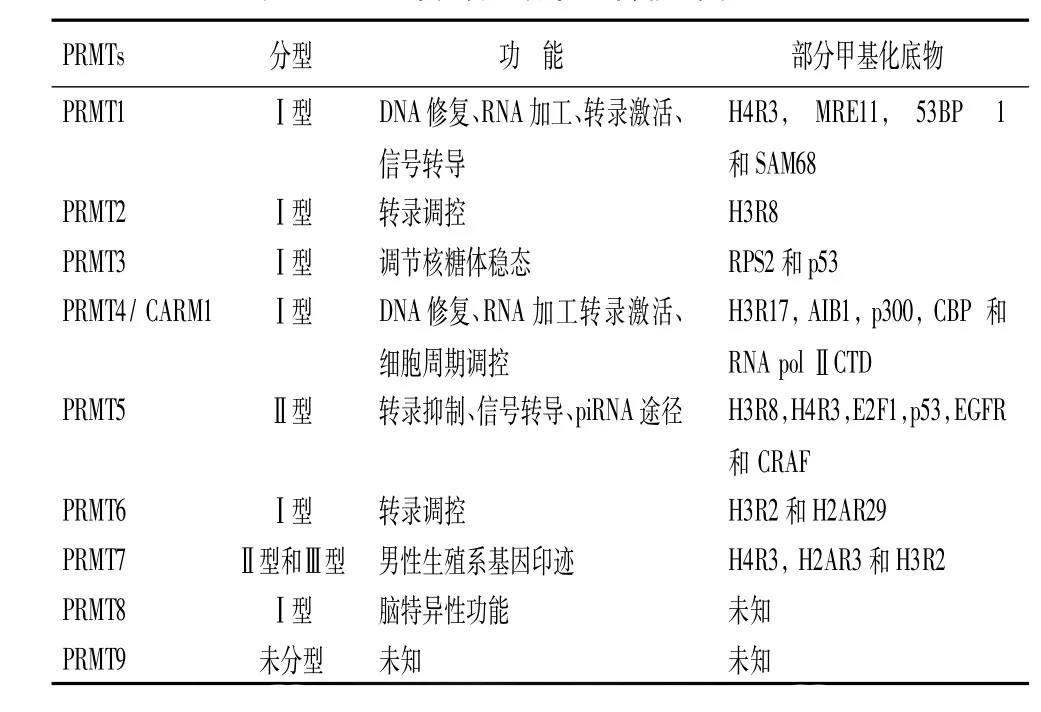
表2 PRMTs在不同肿瘤中的作用[17]
PRMTs:蛋白质精氨酸甲基转移酶;CARM1:共激活相关精氨酸甲基化转移酶1
在细胞核中,PRMT1可以甲基化组蛋白H4中的第3位精氨酸,而这一特异性的甲基化修饰是转录激活的标志[23]。研究发现,前列腺癌细胞核内组蛋白H4第3位精氨酸甲基化水平与其发生率呈正相关,并且还可以用来预测前列腺癌的复发风险[24]。尽管目前尚不清楚组蛋白H4第3位精氨酸甲基化后如何激活染色质的状态,但发现精氨酸甲基化的效应分子tudor结构域结合蛋白3与之相互作用,而tudor结构域结合蛋白3高表达提示乳腺癌患者预后不佳。
研究发现,降解PRMT1可以显著抑制乳腺癌、肺癌以及膀胱癌细胞系的增殖,其原因与降解PRMT1后细胞停滞在G0/G1期有关[9]。RNA干扰后沉默PRMT1v2基因可以明显降低乳腺癌细胞的生存能力[25]。
2.2PRMT2最初认为PRMT2可能不存在精氨酸甲基转移酶的活性,但近期的研究显示PRMT2拥有Ⅰ型精氨酸甲基转移酶活性,能对其底物组蛋白H4进行甲基化,尽管与PRMT1相比其甲基化的活性要弱很多[26],另外研究发现β联蛋白可以招募PRMT2到组蛋白H3上甲基化第8位精氨酸然后启动目的基因的转录[27]。现有的研究已经证实,PRMT2可以通过配体-受体方式与相应的转录激活因子(雌激素受体α、孕酮受体、雄激素受体、过氧化物酶体增殖激活物受体γ以及视黄酸受体α)结合后发挥其生物学功能[28],而激活雌激素受体α、孕酮受体和雄激素受体与肿瘤细胞的生长与发展有关。
研究发现雌激素受体、孕激素受体阳性的细胞株(MCF7、T47D、BT474和ZR-75-1)中PRMT2基因和蛋白表达的水平是受体阴性细胞株(MDA-MB-231、MDA-MB-453和SK-BR-3)的2倍左右;另外还发现乳腺癌组织中PRMT2基因的表达明显高于癌旁组织,同时雌激素受体阳性的乳腺癌组织PRMT2基因的表达较阴性癌组织要高,免疫组织化学也提示同样的结果[29]。这一研究结果提示在乳腺癌中PRMT2基因的表达与雌激素受体α相关,这也与PRMT2发挥其生物学功能的方式相一致。
2.3PRMT4/CARM1在哺乳动物细胞中PRMT4参与了包括翻译、前体信使RNA剪接、细胞周期调控以及DNA修复在内的多种细胞内过程,而在肿瘤细胞内PRMT4通过与肿瘤相关蛋白相互作用或协同作用在调控细胞增殖和存活中起重要作用。PRMT4可以被招募到细胞周期蛋白 E1基因的启动子区域,作为一种翻译共激活因子的方式调控细胞周期蛋白 E1基因的表达;在雌激素的刺激作用下,PRMT4甲基化组蛋白H3的第17位精氨酸引起腺病毒E2启动子结合因子1(adenovirus E2 factor 1,E2F1)表达增加进而调控乳腺癌细胞的增殖[30];另外,近期的研究发现PRMT4可以通过甲基化BAF155促进乳腺癌细胞的迁移和转移[31]。
临床研究发现,PRMT4的表达在前列腺癌、结直肠癌以及乳腺癌中明显异常[4,6-7]。在结直肠癌组织中,PRMT4的表达显著增加[6]。PRMT4不仅在前列腺癌组织中高表达,同时在前列腺上皮内瘤中同样可以发现PRMT4表达增加,而前列腺上皮内瘤是前列腺癌的癌前病变[4,7]。同样在乳腺癌中也发现PRMT4表达异常增高[7],近期Cheng等[32]的研究发现在浸润性乳腺癌中PRMT4表达显著上调,且上调的水平与肿瘤分期以及人类表皮生长因子受体2、抑癌基因p53和增殖细胞核抗原Ki-67的表达呈正相关,提示PRMT4可能可以作为乳腺癌的一个判断预后的因子。
2.4PRMT7PRMT7最初是在中国仓鼠细胞中被发现,其有2个亚型,PRMT7α和PRMT7β,PRMT7α在细胞质和细胞核中均有表达,而PRMT7β仅在细胞质中表达[17]。在人肿瘤细胞系中,仅HeLa和HuH7细胞株中发现一种PRMT7的表达,表达的PRMT7与PRMT7β同源。PRMT7具有Ⅱ型和Ⅲ型精氨酸甲基转移酶的活性,PRMT7催化生成的单甲基精氨酸推测可能作为其他PRMTs的反应中产物。尽管目前对PRMT7准确的生物学功能认识有限,但研究显示PRMT7与肿瘤相关,降解PRMT7可以增强HeLa细胞对喜树碱(一种抗癌药物)的敏感性[33];目前唯一识别出的可以与PRMT7相互作用的蛋白11-锌指蛋白是一种典型的致癌基因[34]。
3展望
肿瘤是除心、脑血管疾病之外人类死亡的又一主要原因,同时对于某些肿瘤而言目前仍然缺乏有效的治疗手段,因此迫切需要寻找新的、重要的干预靶点。大量研究显示,PRMTs不仅在生物体内发挥多种基础的生理作用,而且在肿瘤发生、发展及侵袭过程中同样起重要作用,这使PRMTs在未来极有希望成为肿瘤干预治疗的一个新靶点。尽管目前尚无针对性的药物开发,且存在诸多困难,但相信随着更多有关PRTMs在肿瘤中的作用、机制以及针对性药物研究的开展,PRMTs治疗肿瘤可以成为现实。
参考文献
[1]Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[2]Bedford MT,Clarke SG.Protein arginine methylation in mammals:who,what,and why[J].Mol Cell,2009,33(1):1-13.
[3]Bedford MT,Richard S.Arginine methylation an emerging regulator of protein function[J].Mol cell,2005,18(3):263-272.
[4]Hong H,Kao C,Jeng MH,etal.Aberrant expression of CARM1,a transcriptional coactivator of androgen receptor,in the development of prostate carcinoma and androgen-independent status[J].Cancer,2004,101(1):83-89.
[5]Cheung N,Chan LC,Thompson A,etal.Protein arginine-methyltransferase-dependent oncogenesis[J].Nat Cell Biol,2007,9(10):1208-1215.
[6]Kim YR,Lee BK,Park RY,etal.Differential CARM1 expression in prostate and colorectal cancers[J].BMC Cancer,2010,10:197.
[7]Mathioudaki K,Papadokostopoulou A,Scori las A,etal.The PRMT1 gene expression pattern in colon cancer[J].Br J Cancer,2008,99(12):2094-2099.
[8]Mathioudaki K,Scorilas A,Ardavanis A,etal.Clinical evaluation of PRMT1 gene expression in breast cancer[J].Tumour Biol,2011,32(3):575-582.
[9]Yoshimatsu M,Toyokawa G,Hayami S,etal.Dysregulation of PRMT1 and PRMT6,Type I arginine methyltransferases,is involved in various types of human cancers[J].Int J Cancer,2011,128(3):562-573.
[10]Pal S,Baiocchi RA,Byrd JC,etal.Low levels of miR-92b/96 induce PRMT5 translation and H3R8/H4R3 methylation in mantle cell lymphoma[J].EMBO J,2007,26(15):3558-3569.
[11]Papadokostopoulou A,Mathioudaki K,Scorilas A,etal.Colon cancer and protein arginine methyltransferase 1 gene expression[J].Anticancer Res,2009,29(4):1361-1366.
[12]Bachand F.Protein arginine methyltransferases:from unicellular eukaryotes to humans[J].Eukaryotic Cell,2007,6(6):889-898.
[13]Cheng D,Cate J,Shaaban S,etal.The arginine methyltransferase CARM1 regulates the coupling of transcription and mRNA processing[J].Mol Cell,2007,25(1):71-83.
[14]Boisvert FM,Chénard CA,Richard S.Protein interfaces in signaling regulated by arginine methylation[J].Sci STKE,2005,2005(271):re2.
[15]Guo A,Gu H,Zhou J,etal.Immunoaffinity enrichment and mass spectrometry analysis of protein methylation[J].Mol Cell Proteomics,2014,13(1):372-387.
[16]Yang Y,Bedford MT.Protein arginine methyltransferases and cancer[J].Nat Rev,2013,13(1):37-50.
[17]Baldwin RM,Morettin,Cote J.Role of PRMTs in cancer:could minor isoforms be leaving a mark?[J].Woeld J Biol Chem,2014,5(2):115-129.
[18]Herrmann F,Bossert M,Schwander A,etal.Arginine methylation of scaffold attachment factor A by heterogeneous nuclear ribonucleoprotein particle-associated PRMT1[J].J Biol Chem,2004,279(47):48774-48779.
[19]陈亚军,文格波.蛋白质精氨酸甲基转移酶的研究进展[J].国际病理科学与临床杂志,2008,28(6):535-539.
[20]Yu Z,Chen T,Hébert J,etal.A mouse PRMT1 null allele defines an essential role for arginine methylation in genome maintenance and cell proliferation[J].Mol Cell Biol,2009,29(11):2982-
2996.
[21]Tee WW,Pardo M,Theunissen TW,etal.Prmt5 is essential for early mouse development and acts in the cytoplasm to maintain ES cell pluripotency[J].Genes Dev,2010,24(24):2772-2777.
[22]Goulet I,Gauvin G,Boisvenue S,etal.Alternative splicing yields protein arginine methyltransferase 1 isoforms with distinct activity,substrate specificity,and subcellular localization[J].J Biol Chem,2007,282(45):33009-33021.
[23]Wang H,Huang ZQ,Xia L,etal.Methylation of histone H4 at arginine 3 facilitating transcriptional activation by nuclear hormone receptor[J].Science,2001,293(5531):853-857.
[24]Seligson DB,Horvath S,Shi T,et al.Global histone modification patterns predict risk of prostate cancer recurrence[J].Nature,2005,435(7046):1262-1266.
[25]Baldwin RM,Morettin A,Paris G,etal.Alternatively spliced protein arginine methyltransferase 1 isoform PRMT1v2 promotes the survival and invasiveness of breast cancer cells[J].Cell Cycle,2012,11(24):4597-4612.
[26]Lakowski TM,Frankel A.Kinetic analysis of human protein arginine N-methyltransferase 2:formation of monomethyl and asymmetric dimethyl-arginine residues on histone H4[J].Biochem J,2009,421(2):253-261.
[27]Blythe SA,Cha SW,Tadjuidje E,etal.Beta-Catenin primes organizer gene expression by recruiting a histone H3 arginine 8 methyltransferase,Prmt2[J].Dev Cell,2010,19(2):220-231.
[28]Qi C,Chang J,Zhu Y,etal.Identification of protein arginine methyltransferase 2 as a coactivator for estrogen receptor alpha[J].J Biol Chem,2002,277(32):28624-28630.
[29]Zhong J,Cao RX,Zu XY,etal.Identification and characterization of novel spliced variants of PRMT2 in breast carcinoma[J].FEBS J,2012,279(2):316-335.
[30]Frietze S,Lupien M,Silver PA,etal.CARM1 regulates estrogen-stimulated breast cancer growth through up-regulation of E2F1[J].Cancer Res,2008,68(1):301-306.
[31]Wang L,Zhao Z,Meyer MB,etal.CARM1 methylates chromatin remodeling factor BAF155 to enhance tumor progression and metastasis[J].Cancer Cell,2014,25(1):21-36.
[32]Cheng H,Qin Y,Fan H,etal.Overexpression of CARM1 in breast cancer is correlated with poorly characterized clinicopathologic parameters and molecular subtypes[J].Diagn Pathol,2013,8:129.
[33]Verbiest V,Montaudon D,Tautu MT,etal.Protein arginine (N)-methyl transferase 7 (PRMT7) as a potential target for the sensitization of tumor cells to camptothecins[J].FEBS Lett,2008,582(10):1483-1489.
[34]Martin-Kleiner I.BORIS in human cancers--a review[J].Eur J Cancer,2012,48(6):929-935.
Protein Arginine Methyltransferases and Cancer Interventional TherapyMAMiao-miao,CHAORen-xian. (DepartmentofEndocrinology,theFirstAffiliatedHospital,UniversityofSouthChina,Hengyang421001,China)
Abstract:Finding an effective intervention cancer target is important for the patients.Protein arginine methyltransferases(PRMTs) are the unique and critical enzymes which catalyze the methylation of protein substrates arginine residues,participate in a variety of important basic cell metabolic processes.Recent studies have found that PRMTs take part in the occurrence and development of cancer via promoting catalyzing the methylation of arginine residues, and the expression level of PRMTs can serve as a prognosis evaluating factor for cancer.These results indicate that it may bring clinical benefits to the tumor patients through targeted intervention of PRMTs.
Key words:Protein arginine methyltransferases; Arginine methylation; Cancer; Interventional therapy
收稿日期:2015-01-04修回日期:2015-03-06编辑:相丹峰
基金项目:国家自然科学基金(81372824)
doi:10.3969/j.issn.1006-2084.2015.09.020
中图分类号:R730.22
文献标识码:A
文章编号:1006-2084(2015)09-1589-03

