UV-B辐射增强对元阳哈尼梯田稻田CH4排放规律的影响
徐渭渭, 何永美, 湛方栋, 祖艳群, 李 元
云南农业大学资源与环境学院, 昆明 650201
UV-B辐射增强对元阳哈尼梯田稻田CH4排放规律的影响
徐渭渭, 何永美, 湛方栋, 祖艳群, 李 元*
云南农业大学资源与环境学院, 昆明 650201
在大田条件下,原位种植传统水稻品种白脚老粳,采用静态箱-气相色谱法研究了UV-B(ultraviolet-B)辐射增强(7.5 kJ m-2d-1)对元阳哈尼梯田海拔1600 m处稻田CH4排放量的影响,同时观测UV-B辐射增强对水稻生长的影响。结果表明:(1)UV-B辐射增强显著降低了水稻植株分蘖末期、拔节孕穗期、抽穗扬花期、成熟期地上部和地下部生物量(P<0.05)。(2)UV-B 辐射改变了稻田CH4的季节和日排放(成熟期)规律:对照组在拔节孕穗期出现1 个排放峰,处理组在拔节孕穗期和成熟期出现2 个排放峰;与对照相比,UV-B辐射增强改变了水稻成熟期CH4日排放第2个峰值出现的时间。(3)处理组CH4的季节排放通量与箱内温度的季节变化有显著的正相关性(R=0.789,P<0.05)。(4)UV-B辐射增强在分蘖末期、拔节孕穗期、成熟期都极显著提高了CH4的累计排放量(P<0.01),分别提高了47.2%,293.8%和74.4%。总之,UV-B辐射增强促进了元阳哈尼梯田传统水稻田CH4的排放。
UV-B辐射; 元阳哈尼梯田; 稻田; CH4排放
臭氧层损耗导致的地表紫外辐射增强和温室气体持续排放导致的全球变暖是当今重要的全球性环境问题。研究人员不但关注UV-B辐射增强对农作物的影响[1- 2],而且还关注UV-B辐射增强对农田温室气体排放的影响[3- 4]。有研究表明,在室外盆栽或大田条件下,UV-B辐射增强通过改变植株生理代谢过程,影响植株的根系生长和根系分泌物的分泌情况,进而改变根际土壤微生物活性及组分,最终影响冬小麦、大豆等农田N2O与CO2等温室气体的排放状况,显著降低了这些气体的排放量[5- 9],也降低了稻田CH4的平均排放通量,下降幅度为15.84%,但不显著[10]。另有学者研究发现UV-B辐射处理能通过刺激植物使其释放更多的CH4[11- 14],并且CH4排放速率与UV-B辐射强度呈线性相关[13],认为是辐射胁迫促使植物组织产生活性氧自由基ROS(reactive oxygen species),与细胞壁中的果胶物质发生作用从而产生大量CH4[14]。娄运生等人[15]通过大田试验发现在水稻生长期内进行UV-B辐射增强处理能显著提高稻田CH4的排放通量和累计排放量。
稻田是大气CH4的重要排放源,其排放的CH4量约占全球总排放的5%—19%[16]。稻田CH4排放是稻田CH4产生、氧化和传输3个过程综合作用的结果。中国是世界上最大的水稻生产国,其水稻种植面积约为3.3×107hm2,约占世界稻作面积的22%[17]。冬水田是一类特殊的稻田,一年四季淹水,土壤氧化还原电位低,广泛分布于我国西南山地丘陵区,其总面积在2.7×106—4.0×106hm2,占我国水稻种植面积的8%—12%,但CH4排放量却高达全国稻田CH4排放总量的60%[18],是世界上CH4排放量最大的一类稻田[19]。然而,UV-B辐射增强对冬水田CH4排放规律影响的研究报道还很少。
元阳哈尼梯田于2013年入选世界文化遗产,具有重大的研究价值。元阳哈尼梯田作为我国西南地区典型的冬水田,以此为研究对象,人工模拟UV-B辐射增强,采用静态箱-气相色谱法,测定水稻不同生育期稻田CH4的排放通量,研究元阳梯田稻田CH4排放的季节变化和日变化规律,分析UV-B辐射增强对元阳梯田稻田CH4排放通量的影响,为臭氧层变薄、全球气候变化背景下农田温室气体的排放趋势提供依据。
1 材料与方法
1.1 试验地概况
大田试验地位于云南省元阳县新街镇箐口村,属于元阳哈尼梯田核心区。该地地处滇南低纬度哀牢山山脉南部,属山地季风气候,多雨湿润,干湿季分明,年平均温度15 ℃,年均降水量1397.6 mm,山顶为旱冬瓜和杉树林等自然植被覆盖,在平缓的坡面上形成3000多级、面积近1.33×104hm2的梯田,其历史长达1500多年[20]。元阳梯田全年淹水,仅在每年4月份至11月份种植水稻,冬季泡田休闲,水稻秸秆还田[21],是我国西南山地丘陵区典型的冬水田。本试验在海拔1600 m,23°7′ N,102°44′ E,坡度26°,坡向NE 25°处进行。供试水稻土壤类型为人为水耕土,其理化性质为:土壤pH值 5.32,有机质含量为26.8 g/kg,全N为1.76 g/kg,全P为0.45 g/kg,全K为16.20 g/kg,碱解N为78.44 mg/kg,速效K为16.52 mg/kg,速效P为15.26 mg/kg。
1.2 试验设计与稻田管理
供试水稻为元阳哈尼梯田的农家水稻品种白脚老粳,适合种植于海拔1200—1600 m的梯田,一年一熟,是一种温性高杆农家水稻品种。水稻于2012年3月19日进行播种育苗,5月10日移栽水稻苗至试验小区内。试验点共有6个小区,每个小区面积为3.0 m×1.5 m,小区间的过道宽0.5 m。每个小区种植15行,每行11 丛水稻,每丛1 株秧苗,最外一圈水稻作为小区间的保护行,株距15 cm,行距30 cm。在整个水稻生长期内进行常规田间管理,不施用化肥和农药,稻田水深全年一般维持在10 cm左右。
试验采用完全区组设计,设自然光照和UV-B辐射处理(7.5 kJ m-2d-1)2个水平,相当于箐口梯田海拔1600 m处夏日晴天0和30%的臭氧层衰减造成的UV-B增量,该地的UV-B辐射背景值为10 kJ m-2d-1。紫外辐射处理于6月9日进行,9月27日水稻收获后停止试验。
UV-B辐射增强采用可升降灯架,在每一行水稻正上方挂一盏40 W UV-B灯管(光谱为280—320 nm),共9行,通过改变灯管高度来调节紫外辐照强度(以植株上部计),用UV-B辐射测定仪(北京师范大学光电仪器厂)测定辐射强度,每天9:00—17:00为处理时间,阴雨天除外,直到水稻成熟收获为止[10]。处理期间随着水稻生长不断调整灯管高度,从而保证植株接受7.5 kJ m-2d-1强度的UV-B辐射。自然光照组植株上方只挂没有紫外灯的灯架,以保证处理组和对照组的自然光照条件一致。每个处理设3个重复。
1.3 测定方法
1.3.1 生物量测定
在每个水稻生长时期末期晴朗的一天,于16:00左右随机选取每个小区3 株水稻植株,拔出后洗净,分离地上部和地下部,经75 ℃烘干后测定各部分干重。
1.3.2 CH4采样方法
参照娄运生等方法[15]采用静态箱-气相色谱法收集田间气体样品。采样箱用PVC材料制成,是一个底面半径为30 cm、高度可随水稻生长情况自由调节的圆筒,用箍连接,最后盖上盖子,盖子上装有温度计和采气阀,连接处涂上凡士林以保证箱体的气密性。为减少采样过程中对周围环境的扰动,在观测点周围搭设栈桥。
CH4季节排放的采样方法参照娄运生等方法[15]:在水稻生育期内,每10 d采样1 次,时间为10:00—12:00;采样时先将箱体罩于水稻上,通过稻田淹水层液封保证静态箱气密性,盖上盖子后立即用双链球手动将箱内气体泵入到500 mL的真空铝箔气体袋中,每隔10 min收集1 次,在30 min内共收集4 次,收集气体同时记录箱温、气温及5 cm稻田土壤温度。
CH4日排放的采样方法参照马静等方法[22]:在水稻成熟期进行采样,从8:00开始采样,每隔2 h采集1 次,到18:00结束。具体收集方法同上。
1.3.3 CH4的检测方法
参照Nayak等方法[23],略加改进后,用带有氢火焰离子检测器(FID)的气相色谱仪(Angelient 7890A)检测CH4浓度。进样仪为1 mL的进口气密针,分离柱为毛细管柱。检测器FID参数设置为:加热器210 ℃,H2流量40 mL/min,空气流量400 mL/min,尾吹气流量(N2)20.871 mL/min,柱箱温度50 ℃;色谱柱流量为2.500 mL/min。CH4排放通量计算公式为[24]:
F=60×16×P×H×dc/dt/(273+t)/8.314
式中,F为CH4排放通量(mg m-2h-1);60为时间换算率;16为CH4摩尔质量(g/mol);P为当地采样点气压0.9058×105Pa,这边代入值0.9058;H为采样箱箱顶至水面的有效高度(cm);t为采样时箱内平均温度(℃);dc/dt为箱内气体浓度随时间变化的回归曲线斜率。CH4标准气体由昆明梅塞尔气体公司提供。通过积分计算水稻不同生育期CH4的累积排放量。
1.4 数据统计分析
数据用Excel 2010进行整理与绘图,用统计软件SPSS17.0通过独立样本t检验进行处理间差异显著性检验,并将CH4排放通量与各温度,CH4各时期累积排放量与各时期地上及地下部分生物量进行多元逐步回归及双变量相关分析。
2 结果与分析
2.1 UV-B辐射增强对水稻生物量的影响
UV-B辐射增强对白脚老粳整个生育时期地上部和地下部的生物量有一定影响(图1)。在不同生育时期,UV-B辐射增强均显著降低了水稻地上部和地下部生物量。其中地上部分生物量在UV-B辐射增强处理下,相对于自然光照处理,显著降低了20.3%—30.1%(P<0.05),地下部分生物量经UV-B辐射处理后显著降低了15.9%—24.6%(P<0.05)。
2.2 UV-B辐射增强对CH4排放规律的影响
2.2.1 UV-B辐射增强对CH4排放通量季节变化的影响
由图2可知,自然光照处理组的稻田CH4排放通量在整个观测期内出现了一个峰值,即在第90 天拔节孕穗期时,其峰值为74.59 mg m-2h-1,随后排放通量缓慢下降,持续至移栽后第117 天,又迅速下降至21.12 mg m-2h-1,存在低-高-低的一个排放单峰型。经UV-B辐射处理后,稻田CH4排放通量在观测期内出现了两个明显的排放峰,第一个排放峰出现的时间与对照组一致,即在水稻移栽后第90 天(拔节孕穗期)时出现,其峰值为132.52 mg m-2h-1,随后逐渐下降,在距水稻移栽的第127 天(成熟期)又出现第2个排放峰80.62 mg m-2h-1,大小为第1个排放峰的61.0%,然后再逐渐降低至22.57 mg m-2h-1,排放趋势呈现低-高-低-高-低的双峰型。说明UV-B辐射处理改变了CH4的季节排放规律,由原先的单峰型在经辐射处理之后变成了双峰型。另外,经UV-B辐射增强处理后,CH4排放通量总体上都极显著高于自然光照处理组(P<0.01),只有在距水稻移栽后第107 天、117 天和第142 天的CH4排放通量,两处理之间没有显著差异。
通过对CH4的季节排放通量与地下5 cm土壤温度、大气温度和箱内温度进行多元回归及相关分析,结果表明:自然光照处理组的CH4排放通量与各温度没有相关性,UV-B辐射处理组的CH4排放通量与大气温度和5 cm深处的土壤温度没有相关性,而与箱内温度存在显著的线性正相关,其回归表达式为:
F=- 112.723+6.041T箱(R=0.789,P=0.02)
式中,F为经UV-B辐射处理的CH4排放通量(mg m-2h-1),T箱为试验过程中静态采样箱内的平均温度(℃)。
2.2.2 UV-B辐射增强对CH4排放通量的日变化影响
自然光照处理组在该天出现了一个排放峰,即10:00的时候,随后其排放通量缓慢下降直至16:00,后又逐渐升高,因该试验只观测到傍晚18:00,因此第2个排放峰没有被观测到;UV-B辐射处理组在观测期内出现了两个排放峰,分别是在10:00和16:00的时候(图3)。另外,除8:00的排放通量两处理之间没有显著差异,12:00的排放通量UV-B辐射处理组极显著低于自然光照处理组外(P<0.01),其他几个时间点的排放通量UV-B辐射处理组均极显著高于自然光照处理组。

图2 CH4排放通量及温度的季节性变化Fig.2 Seasonal variation of CH4 flux and temperature in paddy soil
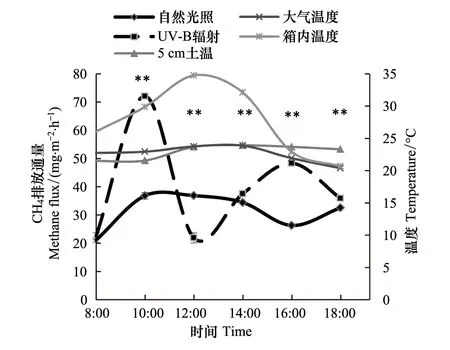
图3 CH4排放通量及温度的日变化Fig.3 Variation of CH4 flux and temperature in paddy field during the day
将CH4当天的排放通量与该天的各时段温度进行多元回归及相关分析后,发现各处理的排放通量与各温度之间均不存在显著的相关性。
2.3 UV-B辐射增强对水稻不同生育期CH4累积排放量的影响
水稻各个生育期CH4累积排放量分布比例见表1。在整个观测期内,自然光照处理组共排放CH464.46 g/m2,其累积排放量最高发生在成熟期,占总排放量的34.8%,其次是出现峰值的拔节孕穗期,其累积排放量占总排放量的30.4%;UV-B辐射处理组在整个观测期内CH4累积排放量为143.05 g/m2,各时期累积排放量最高发生在拔节孕穗期,占总排放量的54.0%,其次是成熟期,占27.4%。经UV-B辐射处理后,稻田CH4在整个观测期内的累积排放量极显著高于自然光照处理组的累积排放量(P<0.01)。

表1 UV-B辐射增强下水稻不同生育期CH4排放特征Tabel 1 Characteristics of CH4 emission in each rice growing stage under enhanced UV-B (ultraviolet-B) radiation
数据后小写字母不同表示达到显著水平(P<0.05),数据后大写字母不同表示达到极显著水平(P<0.01)
将各时期的累积排放量与各时期的植株地上部及地下部分生物量进行回归分析后发现,排放量与各部分生物量之间都不存在显著相关性。
3 讨论
3.1 UV-B辐射增强与CH4排放季节动态变化的关系
稻田CH4排放通量的季节变化受诸多因素影响:土壤理化性质[25]、稻田管理模式[26]、水稻特性[27]、稻田土壤水中的CH4浓度[28]、环境胁迫[29]等。本试验中,UV-B辐射处理组在整个观测期内出现了两个明显的排放峰,而自然光照组只出现了一个明显的排放峰,其出现时间与UV-B辐射处理组同时发生在拔节孕穗期。在该时期出现排放峰主要原因可能在于:水稻此时代谢活动比较旺盛,根系分泌能力强;通气组织发达,传输效率高;根系死亡细胞脱落物增多,为产甲烷菌提供了丰富的碳源;并且稻田温度和淹水条件适宜,从而造成了CH4排放高峰的现象[15,30- 31]。抽穗扬花期时,在淹水等一切种植环境条件没有改变的情况下,两处理的CH4排放通量开始下降,并且UV-B辐射处理组比自然光照组下降速度更快,这可能与稻田中的可溶性碳含量有关[32- 33]。即在水稻拔节孕穗期根系分泌能力旺盛,土壤中碳源增多促进了产甲烷细菌的生长繁殖,从而使这段时间内CH4排放量迅速上升,随后由于产甲烷细菌的大量繁殖导致土壤中可溶性碳含量下降,产甲烷细菌因得不到充足的营养物质其数量逐渐下降,从而引起CH4排放量降低。水稻进入成熟期后,自然光照组一直没有出现排放峰,UV-B辐射处理组在该时期出现了第2个排放峰,但是峰值没有第1个高,表现为UV-B辐射处理改变了稻田CH4排放的季节变化规律。可能是因为UV-B辐射处理组在长期辐射处理下,水稻植株体提前衰老,造成根系脱落物增多,为产甲烷菌提供了较多物质从而产生峰值现象。成熟末期,两处理的CH4排放量均下降,可能是由于水稻根系因衰老和降解导致根系孔隙度减小,影响水稻植株体传输CH4的能力[34]。
3.2 UV-B辐射增强与CH4排放日动态变化的关系
CH4排放的日变化受温度的日变化影响较大,一日之内的温度变化会引起CH4排放的传输路径的传输能力发生改变[35]。由试验结果知(图3),两处理均在10:00时出现第1个排放峰,此时各环境温度还没有达到最大值。到12:00温度达到最大值时,尤其是箱内温度达到最高,为34.75 ℃,两处理的排放通量尤其是UV-B辐射处理组回落的很快,接近白天排放量最低值,这与刘小燕等人[36]认为稻田CH4排放量是随着日出后温度逐渐升高而增大的观点不同。目前还不清楚本试验中的水稻在UV-B辐射增强处理下,遇较高温度时是否有休眠现象。有研究证明,当水稻所处环境温度高于其最适宜温度时,某些水稻品种会发生休眠现象,从而缩小水稻植株体内的空腔系统,抑制土壤中产生的CH4通过植株体向大气传输的过程[35]。
3.3 UV-B辐射处理下,植株生物量和温度与CH4排放季节和日动态变化的关系
很多研究表明,5 cm土壤温度[19,37- 38]、水稻地上及地下部干重[39- 40]与CH4排放具有相关性,随着温度的升高及干重的增大,稻田CH4排放量也升高。因为温度控制着产甲烷菌的代谢活动,其强弱随土壤温度的升高而增强,从而促进CH4的产生;水稻生物量影响着根系分泌物及脱落物的数量,间接影响了提供给产甲烷菌的底物量,从而最终决定了CH4的排放量。在该试验中,由于稻田水位在水稻生长期内一直保持在10 cm左右,较深的水层对土壤具有良好的保温作用,因此土壤温度受大气温度变化不明显。将CH4排放通量与各环境温度进行回归分析后发现,只有UV-B辐射处理组CH4的季节排放通量与箱内温度的季节变化存在显著正线性相关性(R=0.789,P<0.05)。水稻地上及地下部干重经UV-B辐射处理后显著下降(P<0.05,图1),与其他学者的研究成果一致[41]。而CH4的排放通量与累积排放量却在UV-B辐射处理后极显著增加(P<0.01,图2,图3,表1),CH4的累积排放量与水稻各部分干重均无线性相关。说明在野外条件下,影响CH4排放的因素是很复杂的,CH4排放的季节变化、日变化和累积排放量不能用温度和植株干重来完全解释,温度和植株干重不是CH4呈现这些排放规律的主要影响因素。
3.4 UV-B辐射对CH4排放的产生机理
试验研究结果显示,在UV-B辐射增强显著降低水稻植株生物量的情况下(P<0.05,图1),稻田CH4排放通量和累积排放量除个别在两处理间没有显著差异(图2,图3,表1)及极显著(P<0.01,图3)降低外,其余的辐射处理组都极显著高于自然光照组(P<0.01,图2,图3,表1),这与娄运生等人[15]研究的结果比较一致,而与胡正华等人[10]的结果相反。胡正华等人[10]认为,在土壤理化性质相同、稻田水肥管理一致,并且UV-B辐射处理没有明显改变水稻生长状况的情况下,导致了CH4平均排放量下降,但差异不显著。目前,很多研究表明,UV-B辐射处理能够促进植株体CH4的排放。Austin和Vivanco[42]认为UV-B辐射促进植物释放CH4是因为植物组织的光降解,CH4作为植物细胞物质降解后的副产物被释放出来。更多的学者认为植物体在UV-B辐射作用下产生CH4的主要原因是由于紫外辐射等环境胁迫因子刺激植物体形成活性氧自由基ROS,ROS与植物细胞壁果胶等物质中的甲氧基团作用进而生成CH4[43]。Vigano等人[12]发现,UV(ultraviolet)辐射不仅促进甲氧基产生CH4,而且促进其它糖基化碳基团产生CH4,因此,除了植物果胶在辐射胁迫下能产生CH4外,植物的木质素和纤维素在辐射作用下也会产生CH4,并且CH4的释放速率与UV辐射的强度呈线性相关。McLeod等人[14]和Messenger[44]等人分别用活性氧清除剂证实了ROS对植株组织释放CH4的重要性,认为UV辐射能通过诱导产生活性氧自由基ROS从而刺激果胶等物质释放CH4。
4 结论
UV-B辐射增强显著降低了水稻植株各时期地上部、地下部生物量(P<0.05);改变了稻田CH4排放的季节变化规律,与自然光照组相比,CH4排放除了在拔节孕穗期出现第1个排放峰外,在成熟期出现第2个排放峰,并且与箱内温度存在显著线性正相关(R=0.789,P<0.05);UV-B辐射增强改变了CH4排放的日变化规律,提前了CH4排放第2个峰出现的时间,但这种日变化规律与5 cm土壤温度、大气温度和箱内温度均不存在相关性;在整个观测期内,UV-B辐射增强极显著增加了CH4的累积排放量(P<0.01),促进了稻田CH4的排放,而与水稻各时期的各部分干重无相关性。
[1] Ballaré C L, Caldwell M M, Flint S D, Robinson S A, Bornman J F. Effects of solar ultraviolet radiation on terrestrial ecosystems. Patterns, mechanisms, and interactions with climate change. Photochemical & Photobiological Sciences, 2011, 10(2): 226- 241.
[2] Caldwell M M, Bomman J F, Ballaré C L, Flint S D, Kulandaivelu G. Terrestrial ecosystems, increased solar ultraviolet radiation, and interactions with other climate change factors. Photochemical and Photobiological Sciences, 2007, 6(3): 252- 266.
[3] Blom A A, Lee-Taylor J, Madronich S, Messenger D J, Palmer P I, Reay D S, McLeod A R. Global methane emission estimates from ultraviolet irradiation of terrestrial plant foliage. New Phytologist, 2010, 187(2): 417- 425.
[4] Messenger D J, Mcleod A R, Fry S C. Reactive oxygen species in aerobic methane formation from vegetation. Plant Signaling and Behavior, 2009, 4(7): 629- 630.
[5] 蒋静艳, 牛传坡, 胡正华, 杨玉峰, 黄耀. 地表UV-B辐射增强对土壤-冬小麦系统N2O排放的影响机理研究. 环境科学, 2006, 27(9): 1712- 1716.
[6] 胡正华, 蒋静艳, 牛传坡, 孙文娟, 黄耀. 地表UV-B辐射增强对土壤-冬小麦系统呼吸速率和N2O排放的影响. 环境科学, 2007, 28(3): 449- 454.
[7] 胡正华, 蒋静艳, 牛传坡, 陈书涛, 刘巧辉. 地表UV-B辐射增强对土壤-大豆系统N2O排放的影响. 生态学报, 2009, 29(12): 6754- 6763.
[8] 胡正华, 蒋静艳, 牛传坡, 陈书涛, 刘巧辉. UV-B增强对土壤-大豆系统CO2排放的影响. 中国环境科学, 2009, 29(4): 425- 430.
[9] 胡正华, 杨燕萍, 陈书涛, 李涵茂, 李岑子, 申双和. UV-B增强与秸秆施用对土壤-冬小麦系统CO2排放影响. 中国环境科学, 2010, 30(8): 1130- 1134.
[10] 胡正华, 凌慧, 陈书涛, 李琪, 蒋静艳, 牛传坡. UV-B增强对稻田呼吸速率、CH4和N2O排放的影响. 环境科学, 2011, 32(10): 3018- 3022.
[11] Vigano I, Röckmann T, Holzinger R, van Dijk A, Keppler F, Greule M, Brand W A, Geilmann H, van Weelden H. The stable isotope signature of methane emitted from plant material under UV irradiation. Atmospheric Environment, 2009, 43(35): 5637- 5646.
[12] Vigano I, Van Weelden H, Holzinger R, Keppler F, McLeod A, Röckmann T. Effect of UV radiation and temperature on the emission of methane from plant biomass and structural components. Biogeosciences, 2008, 5(3): 937- 947.
[13] Btuhn D, Mikkelsen T N, Øbro J, Willats W G T, Ambus P. Effects of temperature, ultraviolet radiation and pectin methyl esterase on aerobic methane release from plant material. Plant Biology, 2009, 11(S1): 43- 48.
[14] McLeod A R, Fry S C, Loake G J, Messenger D J, Reay D S, Smith K A, Yun B W. Ultraviolet radiation drives methane emissions from terrestrial plant pectins. New Phytologist, 2008, 180(1): 124- 132.
[15] 娄运生, 周文鳞. UV-B辐射增强对抗除草剂转基因水稻CH4排放的影响. 生态学报, 2012, 32(15): 4731- 4736.
[16] IPCC Fourth Assessment Report. Climate change 2007: The Physical Science Basis[EB/OL]. [2013- 4- 25]. http://www.slvwd.com/agendas/Full/2007/06- 07- 07/Item%2010b.pdf.
[17] 王玲, 魏朝富, 谢德体. 稻田甲烷排放的研究进展. 土壤与环境, 2002, 11(2): 158- 162.
[18] Cai Z C. A Category for estimate of CH4emission from rice paddy fields in China. Nutrient Cycling in Agroecosystems, 1997, 49(1/3): 171- 179.
[19] 韩广轩, 朱波, 江长胜, 高美荣, 张中杰, 马秀梅. 川中丘陵区稻田甲烷排放及其影响因素. 农村生态环境, 2005, 21(1): 1- 6.
[20] 侯甬坚. 红河哈尼梯田形成史调查和推测. 南开学报: 哲学社会科学版, 2007, (3): 53- 61, 112- 112.
[21] 严火其, 李琦. 自然主义的哈尼稻作及其可持续发展. 中国农史, 2008, 27(3): 33- 44.
[22] 马静, 徐华, 蔡祖聪, 八木一行. 水稻植株对稻田CH4排放日变化的影响. 土壤, 2007, 39(6): 859-862.
[23] Nayak D R, Adhya T K, Babu Y J, Datta A, Ramakrishnan B, Rao V R. Methane emission from a flooded field of Eastern India as influenced by planting date and age of rice (OryzasativaL.) seedlings. Agriculture Ecosystems and Environment, 2006, 115(1/4): 79-87.
[24] 胡正华, 蒋晶艳, 孙文娟, 黄耀. UV-A辐射对土壤-冬小麦系统呼吸速率和N2O排放的影响. 农业环境科学学报, 2008, 27(5): 1860- 1865.
[25] Tsutsuki K, Ponnamperuma F N. Behavior of anaerobic decomposition products in submerged soils: effects of organic material amendment, soil properties, and temperature. Soil Science and Plant Nutrition, 1987, 33(1): 13- 33.
[26] Khalil M A K, Rasmussen R A, Shearer M J, Dalluge R W, Ren L X, Duan C L. Measurements of methane emissions from rice fields in China. Journal of Geophysical Research: Atomospheres, 1998, 103(D19): 25181- 25210.
[27] Das K, Baruah K K. Methane emission associated with anatomical and morphophysiological characteristics of rice (Oryzasativa) plant. Physiologia Plantarum, 2008, 134(2): 303- 312.
[28] Nouchi I, Mariko S, Aoki K. Mechanism of methane transport from the rhizosphere to the atmosphere through rice plants. Plant Physiology, 1990, 94(1): 59- 66.
[29] Krischbaum M U F, Niinemets, Bruhn D, Winterts A J. How important is aerobic methane release by plants? Functional Plant Science and Biotechnology, 2007, 1(1): 138- 145.
[30] 杨光明, 武文明, 沙丽清. 西双版纳地区稻田甲烷的排放通量. 山地学报, 2007, 25(4): 461- 468.
[31] 杨文燕, 宋长春, 张金波. 沼泽湿地孔隙水中溶解有机碳、氮浓度季节动态及与甲烷排放的关系. 环境科学学报, 2006, 26(10): 1745- 1750.
[32] Bergman I, Klarqvist M, Nilsson M. Seasonal variation in rates of methane production from peat of various botanical origins: effects of temperature and substrate quality. FEMS Microbiology Ecology, 2000, 33(3): 181- 189.
[33] Smith L K, Lewis Jr W M. Seasonality of methane emissions from five lakes and associated wetlands of the Colorado Rockies. Global Biogeochemical Cycles, 1992, 6(4): 323- 338.
[34] Colmer T D. Aerenchyma and an inducible barrier to radial oxygen loss facilitate root aeration in upland, paddy and deep-water rice (OryzasativaL.). Annals of Botany, 2003, 91(2): 301- 309.
[35] 上官行健, 王明星, 沈壬兴, 王跃思, Wassmann R, Rennenberg H, Seiler W, 谢小立, 王卫东, 谢克和. 我国华中地区稻田甲烷排放特征. 大气科学, 1994, 18(3): 358- 365.
[36] 刘小燕, 黄璜, 杨志平, 余建波, 戴振炎, 王德军, 谭泗桥. 稻鸭鱼共栖生态系统CH4排放规律研究. 生态环境, 2006, 15(2): 265- 269.
[37] 段晓男, 王效科, 陈琳, 牟玉静, 欧阳志云. 乌梁素海湖泊湿地植物区甲烷排放规律. 环境科学, 2007, 28(3): 455- 459.
[38] 韩广轩, 朱波, 高美荣. 水稻油菜轮作稻田甲烷排放及其总量估算. 中国生态农业学报, 2006, 14(4): 134- 137.
[39] Wassmann R, Aulakh M S. The role of rice plants in regulating mechanisms of methane missions. Biology and Fertility of soils, 2000, 31(1): 20- 29.
[40] Aulakh M S, Bodenbender J, Wassmann R, Rennenberg H. Methane transport capacity of rice plants. Ⅱ. Variations among different rice cultivars and relationship with morphological characteristics. Nutrient Cycling in Agroecosystems, 2000, 58(1/3): 367- 375.
[41] 李海涛, 董铭, 廖迎春, 卢存福, 梁涛. 模拟UVB增强胁迫对大田水稻生长及内源激素含量的影响. 中国农学通报, 2007, 23(3): 392- 397.
[42] Austin A T, Vivanco L. Plant litter decomposition in a semi-arid ecosystem controlled by photodegradation. Nature, 2006, 442(7102): 555- 558.
[43] Keppler F, Hamilton J T G, McRoberts W C, Vigano I, Braß M, Röckmann T. Methoxyl groups of plant pectin as a precursor of atmospheric methane: evidence from deuterium labelling studies. New Phytologist, 2008, 178(4): 808-814.
[44] Messenger D J, Mcleod A R, Fry S C. The role of ultraviolet radiation, photosensitizers, reactive oxygen species and ester groups in mechanisms of methane formation from pectin. Plant, Cell and Environment, 2009, 32(1): 1- 9.
Effect of enhanced UV-B radiation on CH4emission from paddy field in Yuanyang Hani Terraces
XU Weiwei, HE Yongmei, ZHAN Fangdong, ZU Yanqun, LI Yuan*
CollegeofResourcesandEnvironment,YunnanAgriculturalUniversity,Kunming650201,China
The destruction of ozonosphere and the global warming have been widely concerned by governments and peoples all over the world. Increase of UV-B (ultraviolet-B) radiation on Earth′s surface due to ozone layer depletion can decrease the growth and alter the chemical composition of litter fall of plant, and consequently change the microbial community composition, structure and activity in soil. Methane is an important greenhouse gas and has a global warming potential of 25 compared to CO2over a 100-year period. Its rank is second only to CO2in the atmosphere and its concentration in the Earth′s atmosphere in 2010 was 1.808×10- 6μL/L, up from 0.7×10- 6μL/L in 1750. In addition to abiogenic production of methane, there are biogenic methane as well. Biogenic methane produced by the process of methanogenesis usually occurred under highly anaerobic conditions, for example, in the guts of humans and other animals, especially ruminants, and in landfill, artificial and natural wetlands, etc. As a kind of wetland, flooded paddy can generate a lot of methane during plant growth and are considered to be one of the major anthropogenic sources of methane, especially the year-round flooded paddy field. Up to now, quite a few researches demonstrated that methane can be largely produced from plant tissues under the influence of UV (ultraviolet) radiation due to the generation of ROS (reactive oxygen species). ROS was suggested to be a potential free-radical mechanism which can produce CH4from plant polysaccharides under aerobic condition. Though the significant effects of UV-B radiation on methane emission from rice paddy field have been studied, the effects of UV-B radiation on the methane emission from year-round flooded paddy field are rarely studied. In this paper, Yuanyang Hani Terraces which is a typical year-round flooded paddy field in Yunnan, Southwestern China, was chosen to investigate the dynamics of methane emission under enhanced UV-B radiation.Field experiment was conducted to investigate methane emission as affected by enhanced UV-B radiation (7.5 kJ m-2d-1) in Yuanyang Hani Terraces where planted the rice traditional cultivar named Baijiaolaojing at the altitude of 1600 m. The CH4emission flux was measured by static chamber-gas chromatograph method with an interval of 10 days during the rice growing season. The results showed that: (1) The straw weight and root weight decreased significantly under enhanced UV-B radiation at different stages including late tillering stage, jointing to booting stage, heading to flowering stage and mature stage (P<0.05). (2) The seasonal and daily patterns of CH4emission were changed by the enhanced UV-B radiation. Only one emission peak during the whole growing season was observed at jointing to booting stage under the control, while two peaks were observed under enhanced UV-B radiation at jointing to booting stage and mature stage, respectively. Of the daily CH4emission, the second emission peak under enhanced UV-B radiation appeared in advance, compared with the control at mature stage. (3) There was a significant positive correlation between CH4seasonal emission flux and the temperature in chamber as a result of enhanced UV-B radiation (R=0.789,P<0.05). (4) The total amount of CH4emission were increased by 47.2%, 293.8% and 74.4% significantly as compared with that of control at late tillering stage, jointing to booting stage and mature stage, respectively (P<0.01). The results suggest that enhanced UV-B radiation can stimulate CH4emission from rice paddy field cultivated with traditional rice cultivar.
UV-B radiation; Yuanyang Hani Terraces; rice paddy field; methane emission
国家自然科学基金项目(31060083, 41205113)
2013- 05- 08;
日期:2014- 04- 17
10.5846/stxb201305080981
*通讯作者Corresponding author.E-mail: Liyuan03@aliyun.com
徐渭渭, 何永美, 湛方栋, 祖艳群, 李元.UV-B辐射增强对元阳哈尼梯田稻田CH4排放规律的影响.生态学报,2015,35(5):1329- 1336.
Xu W W, He Y M, Zhan F D, Zu Y Q, Li Y.Effect of enhanced UV-B radiation on CH4emission from paddy field in Yuanyang Hani Terraces.Acta Ecologica Sinica,2015,35(5):1329- 1336.

