基于根际与凋落物际评价转Bt水稻对土壤线虫群落的影响
戚 琳,刘满强,2,*,蒋林惠,张楗峤,李修强,陈法军,胡 锋
1 南京农业大学资源与环境科学学院土壤生态实验室, 南京 210095 2 中国科学院南京土壤研究所/土壤与农业可持续发展国家重点实验室, 南京 210008 3 南京农业大学植物保护学院, 南京 210095
基于根际与凋落物际评价转Bt水稻对土壤线虫群落的影响
戚 琳1,刘满强1,2,*,蒋林惠1,张楗峤1,李修强1,陈法军3,胡 锋1
1 南京农业大学资源与环境科学学院土壤生态实验室, 南京 210095 2 中国科学院南京土壤研究所/土壤与农业可持续发展国家重点实验室, 南京 210008 3 南京农业大学植物保护学院, 南京 210095
转基因作物在商业化推广前,有必要评价其对非靶标土壤生物的生态影响。根系和凋落物与土壤的界面是代表植物直接影响土壤的两个典型活性微域,即根际和凋落物际。基于室内盆栽实验构建水稻根际和凋落物际,比较了这两个高活性微域中转Bt水稻克螟稻(KMD)与亲本水稻秀水11(XSD)对土壤可利用资源、微生物学性质和线虫群落的影响。结果表明:转Bt水稻对土壤性质的影响依赖于水稻生育期和微域的变化。与XSD相比,KMD在苗期和拔节期显著提高了凋落物际土壤可溶性有机氮含量(P<0.05);在苗期显著降低了凋落物际土壤铵态氮含量,但在成熟期显著提高了凋落物际与交互微域土壤的铵态氮含量(P<0.05)。与亲本水稻相比,转Bt水稻分别在苗期和成熟期显著提高了凋落物际土壤微生物生物量碳和活性,而在拔节期和成熟期显著降低了根际土壤微生物生物量氮含量(P<0.05)。微域间的交互作用显著影响土壤微生物生物量、可溶性有机碳和氮、线虫总数和各食性线虫的数量(P<0.05)。转Bt水稻总体上降低了土壤线虫总数,尤其在苗期和拔节期的凋落物际土壤中达到显著水平。重复测量方差分析表明转Bt水稻显著影响土壤食细菌(P<0.01)和食真菌(P<0.05)线虫数量,及线虫群落的通道指数和富集指数。水稻收获后KMD秸秆的Bt蛋白含量显著高于亲本,全部KMD处理的土壤样品中Bt蛋白含量无显著变化,因而转Bt水稻对土壤生物学性质的影响可能并非来源于Bt蛋白的作用,而更可能来自于水稻生长性状和凋落物性质的差异。
转Bt水稻;根际;凋落物际;Bt蛋白;线虫群落
水稻是我国主要的粮食作物之一,却因长期遭受病虫害的严重侵袭造成大量减产。传统化学防治既会增加生产成本又会造成环境污染。转基因水稻抗虫蛋白的表达能够减少农药施用量,在我国粮食安全保障中具有重要的地位[1]。转Bt水稻由于外源基因的插入,改变了作物组织的化学成分组成和生理生化性状[2],在生长期间可能影响农田生物群落组成和多样性。目前,有关转Bt水稻生态风险评价的研究大多集中于地上部非靶标生物[3- 5],土壤食物网中处于较高营养级的土壤动物正逐渐受到关注[6- 10]。
线虫是农田土壤中多样性较为丰富的优势生物类群[11],在评价农田土壤生态系统方面具很大优势[12]。首先,线虫可敏感地反映土壤环境的细微变化[13];其次,线虫食性多样,在土壤食物网中扮演重要角色,对维持土壤生态系统物质循环等功能起着重要作用,其营养类群结构的改变与土壤生态系统过程紧密联系[14];且其分离、鉴定较为简单[15],有助于评价转Bt水稻对土壤生态环境的潜在风险。目前,利用线虫群落研究转基因作物对土壤生态系统的影响多集中在玉米[16- 18]和棉花[19]等作物上,研究结果各异。例如,Griffiths等[16]在3个不同试验地种植转Bt及亲本玉米,发现二者之间的土壤线虫群落无显著差异;而Mina等[19]发现几乎全部采样时期Bt棉花根际土壤的微型、中型和大型土壤动物数量均高于非Bt棉花根际土壤。以往的相关研究主要关注土体土壤[16- 17],针对植物影响较为直接和强烈的微域土壤研究较少。以往的研究中,较多关注单一的根系生长或凋落物分解过程对土壤的影响,而综合根际和凋落物际对土壤生物群落的影响鲜有报道[20]。
根际(根系-土壤界面)代表空间小尺度的高活性微域,受作物根系生长过程的直接影响而形成,对根际的研究有利于理解土壤生态系统结构和功能[14]。凋落物际(凋落物-土壤界面)与凋落物直接接触,受凋落物分解过程直接影响,对土壤有机碳的矿化贡献很大[21]。二者都是资源丰富和生物活性极高的微域[22],其养分状况和生物群落结构与土体土壤的大为不同[20]。转Bt水稻对土壤的影响主要通过作物根系生长和残体分解两个途径,根际和凋落物际代表进行这两个途径的微域。根际土壤生物与植物根系相互作用,对根际生态环境和生态功能、地上部群落具有强烈的影响[14],在土壤养分转化和土壤微生物的调节过程中发挥着重要作用[23]。鉴于根际和凋落物际是直接受到转Bt水稻根系生长和凋落物分解影响的高活性微域,土壤线虫群落在这两个微域内的响应可能比土体土壤内的响应更灵敏,因此,综合这两个微域的线虫群落分析可对评估转Bt水稻的土壤生态风险起到预警作用。
本文通过构建水稻根系-土壤和凋落物-土壤的活性界面(即根际和凋落物际),研究转Bt水稻种植过程中不同生育期内的根际和凋落物际的微生物学性质和线虫群落结构的变化,以期深入评价转Bt水稻短期种植后对不同微域中土壤生物群落的生态风险影响。预期结果有助于构建转Bt水稻生态安全监测指标,全面了解转Bt水稻对土壤生态系统的影响。
1 材料和方法
1.1 实验材料
实验选用转Bt水稻克螟稻及其非转Bt亲本秀水11。其中,转Cry1Ab纯合基因抗虫恢复系克螟稻(简称克螟稻,KMD)是将Bt(Bacillusthuriengsis)杀虫蛋白基因(Cry1Ab)导入晚粳稻秀水11(简称秀水稻,XSD)后选育出的Bt水稻,对8种鳞翅目害虫具有高抗性,稻种由浙江大学原子能研究所提供。
供试土壤采自江西鹰潭余江县长期耕作的双季稻稻田,属于河流冲积土发育而成的潴育型水稻土,耕层土壤(0—15 cm)有机质含量25.5 g/kg,全氮1.54 g/kg,有效氮95.1 mg/kg,有效磷16.1 mg/kg,速效钾34.2 mg/kg,pH值 5.5。
1.2 研究方法
1.2.1 实验设计

图1 盆钵内构建凋落物际和根际的凋落物网袋及水稻根系分布示意图Fig.1 Schematic view of detritusphere and rhizosphere set-up via the spatial layout of litter mesh bags and roots of rice plants in the pots
水稻种植盆钵选用高19 cm,直径17 cm的圆形塑料桶,将两个品种的水稻凋落物(即水稻收获后的地上部秸秆,包含茎杆和叶片)分别烘干研磨,称取50 g凋落物与50 g鲜土混匀后装入孔径2 mm的网袋中。网袋平整地压实,竖直摆放在桶的直径剖面上(图1),周围填满土,每个盆钵装土5 kg。网袋中凋落物与种植的水稻品种一致,此网袋边际为凋落物际的采样点。不添加凋落物际的处理中,网袋中仅装50 g鲜土。水稻种子在30% H2O2溶液中浸种30 min后再用大量清水反复冲洗。在去离子水中避光浸泡24 h后平铺在湿润纱布上室温避光培养,2—3 d种子出芽,5 d后移栽长势健壮一致的水稻幼苗。
于2011年6月1日移栽水稻幼苗,创建3种微域:① 不种植水稻,土壤中仅添加凋落物(D,凋落物际);② 种植水稻,土壤中不添加凋落物(R,根际);③种植水稻,土壤中添加对应品种的凋落物(DR,复合微域,即包含凋落物际和根际的复合影响),每个处理设4重复。每桶分别种植8株转Bt或其非转Bt亲本水稻,水稻与凋落物袋的距离为2 cm,播种前基肥施入量为脲 1.0 g、NH4H2PO40.5 g、KCl 0.5 g(相当于田间施肥水平:N 150 kg/hm2,P 75 kg/hm2,K 150 kg/hm2),并于拔节期同水平追肥一次,盆钵置于南京农业大学日光温室中,日常管理保持土壤水分饱和。随着水稻根系的生长,根系逐渐插伸在网袋中形成了与密集的“根系网”,因此在没有凋落物的盆钵中形成根际。同样,没有种植水稻的盆钵中,网袋内凋落物分解过程中形成了凋落物际,而在同时种植水稻和含有凋落物袋的盆钵中形成了受到根系和凋落物共同影响的复合微域。分别在7月13日(苗期)、9月3日(拔节期)和10月28日(成熟期)用内径2 cm的土钻紧贴凋落物网袋采集土壤样品,每次采样用标签记录,以便不干扰下次采样。在水稻成熟期收获水稻地上部植株鲜样并保存在-70 ℃冰箱,用于测定Cry1Ab蛋白含量。挑出土壤中的植物残体后放入4 ℃冰箱保存,尽快进行土壤微生物学性质、线虫群落分析和速效养分的测定。
1.2.2 测定方法
Bt蛋白含量的测定采用美国Agdia公司生产的Enzyme-linked immunosorbent assay (ELISA)Bt-CrylAb酶联免疫试剂盒。试剂盒每个孔中加入100 μL酶连接液,在酶标板的前两列中加入8个不同浓度(0、0.125、0.25、0.5、1、2、4、8 ng/mL)的Bt标准蛋白,秸秆样品稀释液以及土壤样品上清液按顺序分别加入板中,将酶标板放入铺有湿纸巾的密闭容器中,室温孵育2 h后洗板并加入TMB显色底物和3 mol/L的H2SO4作为反应终止液,用酶标仪在450 nm下读数,测定酶标板中每个测试孔的光密度值。根据标准曲线求出Cry1Ac/Ab杀虫蛋白的含量,换算成ng/g鲜重来表示。
可溶性有机碳和氮采用0.5 mol/L K2SO4溶液浸提,8000 r/min离心10 min后上清液过孔径0.45 μm的醋酸纤维滤膜,滤液中碳氮含量测定分别用K2Cr2O4外加热法和半微量凯氏定氮法测定。铵态氮和硝态氮采用2 mol/L KCl溶液浸提,充分震荡后过滤取滤液用连续流动分析仪(Auto Analyzer Ⅲ,Bran and Luebbe, Germany)进行测定。
用氯仿熏蒸-K2SO4溶液浸提法测定新鲜土样的微生物生物量碳和氮,熏蒸土样与未熏蒸土样的有机碳和氮差值的转换系数分别是KC=0.38,KN=0.54[24]。土壤基础呼吸采用呼吸瓶22℃黑暗培养3 h,收集气体样品用气象色谱分析(Agilent 7890A, USA)。微生物代谢熵为土壤基础呼吸与微生物生物量碳的比值。采用蔗糖浮选离心法分离线虫[25],在立体显微镜下直接计数并换算成100 g干土的线虫数量。在生物显微镜下进行线虫属种鉴定,根据线虫的头部形态学特征和取食习性划分为植食、食细菌、食真菌和捕食/杂食线虫[26]。
自由生活线虫成熟度指数:
MI=∑vi×fi
式中,vi为自由生活线虫的c-p值,fi为某科/属(i)在自由生活线虫(不包括植食线虫)总数中所占的比重。
线虫通道指数NCR为食细菌线虫与食微线虫(食细菌+食真菌)数量之比。
Shannon多样性指数:
H′=-∑PilnPi
式中,Pi为第i个分类单元中个体占线虫总数的比例。
富集指数:
EI=100×(e/(e+b))
结构指数:
SI=100×(s/(b+s))式中,e为食物网中的富集成分,主要指食细菌线虫中c-p值为1和食真菌线虫中c-p值为2的类群,b为食物网中的基础成分,主要指食细菌线虫和食真菌线虫中c-p值为2的类群,s为食物网中的结构成分群,分别为食细菌线虫、食真菌线虫和捕食/杂食线虫中c-p值为3—5的类群以及捕食性线虫中c-p值为2—5的类群[27]。
1.2.3 数据分析
采用重复测量方差分析法(ANOVA)分析不同采样时期KMD和XSD种植条件下土壤微生物学性质、线虫群落和养分的变化。同一采样时间同种微域土壤的KMD和XSD之间的差异采用独立样本t检验,不同微域、相同水稻品种之间的差异比较采用最小显著极差法(LSD),显著性水平设α=0.05。
KMD和XSD种植下线虫群落结构的差异采用非度量多变量排序(nMDS),用以检验各采样时期不同水稻品种的微域土壤线虫群落组成的总体变化。上述分析方法基于各线虫属相对丰度的Bray-Curtis相似性矩阵,所有分析采用SPSS 16.0和PRIMER 5.0统计软件处理。
2 结果与分析
2.1 转Bt水稻及亲本对土壤养分、Bt蛋白含量及微生物学性质的影响
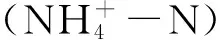
表1 转Bt水稻及亲本对不同微域土壤Bt蛋白、有效养分含量和微生物学性质影响的重复测量方差分析结果
Table 1 Repeated-measure ANOVA results for the effects of different rice varieties (transgenicBtand non-Btlines) and microsites on soilBtprotein, available nutrients content and microbial properties
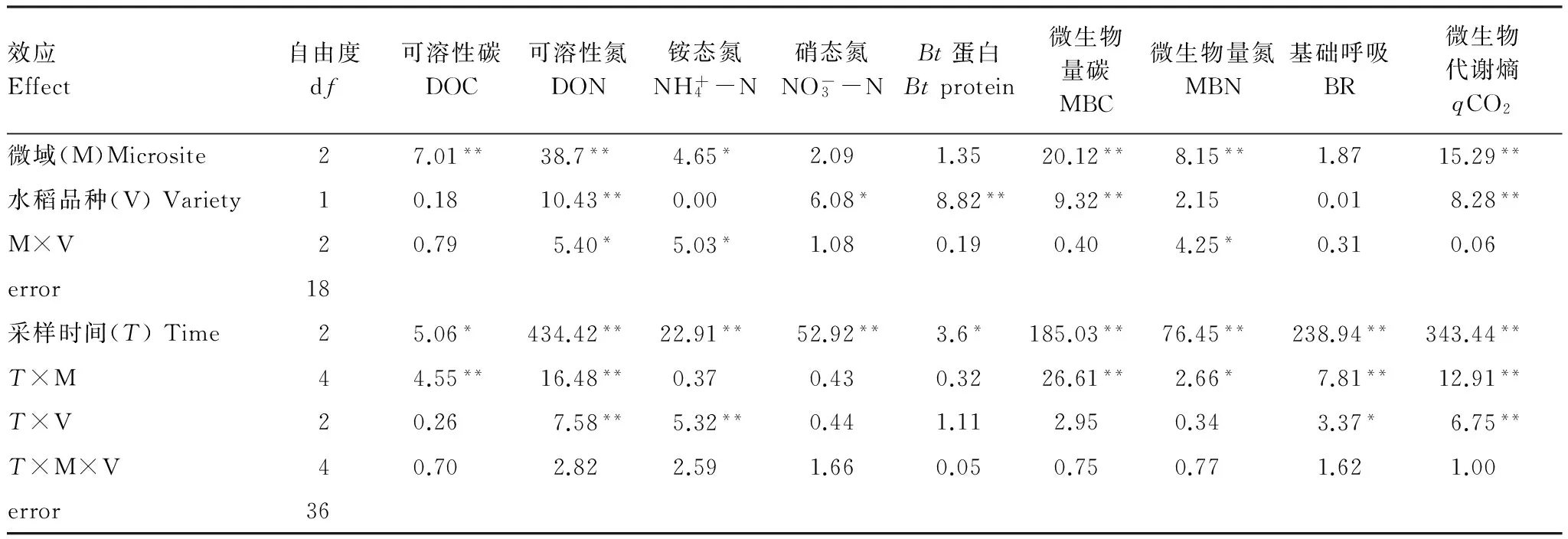
效应Effect自由度df可溶性碳DOC可溶性氮DON铵态氮NH+4-N硝态氮NO-3-NBt蛋白Btprotein微生物量碳MBC微生物量氮MBN基础呼吸BR微生物代谢熵qCO2微域(M)Microsite27.01**38.7**4.65*2.091.3520.12**8.15**1.8715.29**水稻品种(V)Variety10.1810.43**0.006.08*8.82**9.32**2.150.018.28**M×V20.795.40*5.03*1.080.190.404.25*0.310.06error18采样时间(T)Time25.06*434.42**22.91**52.92**3.6*185.03**76.45**238.94**343.44**T×M44.55**16.48**0.370.430.3226.61**2.66*7.81**12.91**T×V20.267.58**5.32**0.441.112.950.343.37*6.75**T×M×V40.702.822.591.660.050.750.771.621.00error36
DOC: Dissolved organic carbon;DON: Dissolved organic nitrogen;MBC: Microbial biomass carbon;MBN: Microbial biomass nitrogen;BR: Basal respiration;qCO2: Microbial metabolic quotient;*表示差异显著; **表示差异极显著

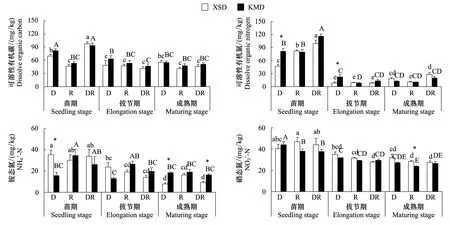
图2 转Bt水稻(KMD)及亲本(XSD)对不同微域土壤可溶性养分含量的影响(平均值±标准误)Fig.2 Effects of transgenic Bt and non-Bt rice varieties on soil dissolved nutrients contents (mean±SE)
所有采样时期各微域KMD土壤样品中均能检测到Bt蛋白,但含量很低,土壤Bt蛋白含量在0.105—0.108 ng/g范围内,最小值和最大值分别出现在水稻苗期和成熟期的根际土壤,且不同微域土壤间的Bt蛋白含量无显著差异(图3)。水稻成熟期收获的水稻植株中,KMD秸秆Bt蛋白含量显著高于亲本,根际和交互微域处理的同一品种的水稻秸秆中Bt蛋白含量无显著差异(P>0.05,图3)。

图3 转Bt水稻(KMD)不同微域土壤Bt蛋白及成熟期转Bt水稻(KMD)、亲本水稻(XSD)秸秆Bt蛋白含量Fig.3 Contents of soil Bt protein of transgenic Bt and non-Bt rice varieties and Bt protein content in straw after maturing stage (mean±SE)
相比于亲本,转Bt水稻总体上提高了土壤MBC,仅在成熟期D土壤中KMD比XSD降低了MBC,但未达到显著水平(P>0.05),KMD显著提高了苗期D土壤MBC;转Bt水稻对土壤MBN的影响因水稻生长期和微域而异,3个时期KMD比XSD降低了R土壤MBN,在拔节期和成熟期达到显著水平(P<0.05),成熟期D土壤BR显著提高(图4)。
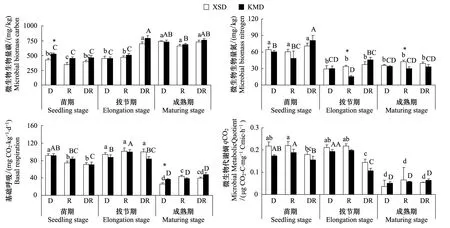
图4 转Bt水稻(KMD)及亲本(XSD)对不同微域土壤微生物生物学性质的影响(平均值±标准误)Fig.4 Effects of transgenic Bt and non-Bt rice varieties on soil microbial properties (mean±SE)
2.2 转Bt水稻及亲本对土壤线虫数量及群落结构的影响
土壤线虫总数受微域和转Bt水稻品种及其交互作用影响显著;其中,食微线虫(食细菌和食真菌线虫)数量受水稻品种影响显著,自由生活线虫(食微线虫+捕食/杂食线虫)受微域及水稻生长期影响显著(P<0.05),微域间的交互作用对土壤线虫数量和各食性线虫数量影响显著。线虫通道指数(NCR)和富集指数(EI)受微域和水稻品种的显著影响,而水稻品种对成熟度指数(MI)影响显著,微域间的交互作用对MI、NCR、EI和SI的影响达到显著水平(表2)。
表2 转Bt水稻及亲本在不同微域下线虫数量及生态指标的重复测量方差分析结果
Table 2 Repeated-measure ANOVA results for the effects of different rice varieties (transgenicBtand non-Btlines) and microsites on soil nematode abundance and ecological indices
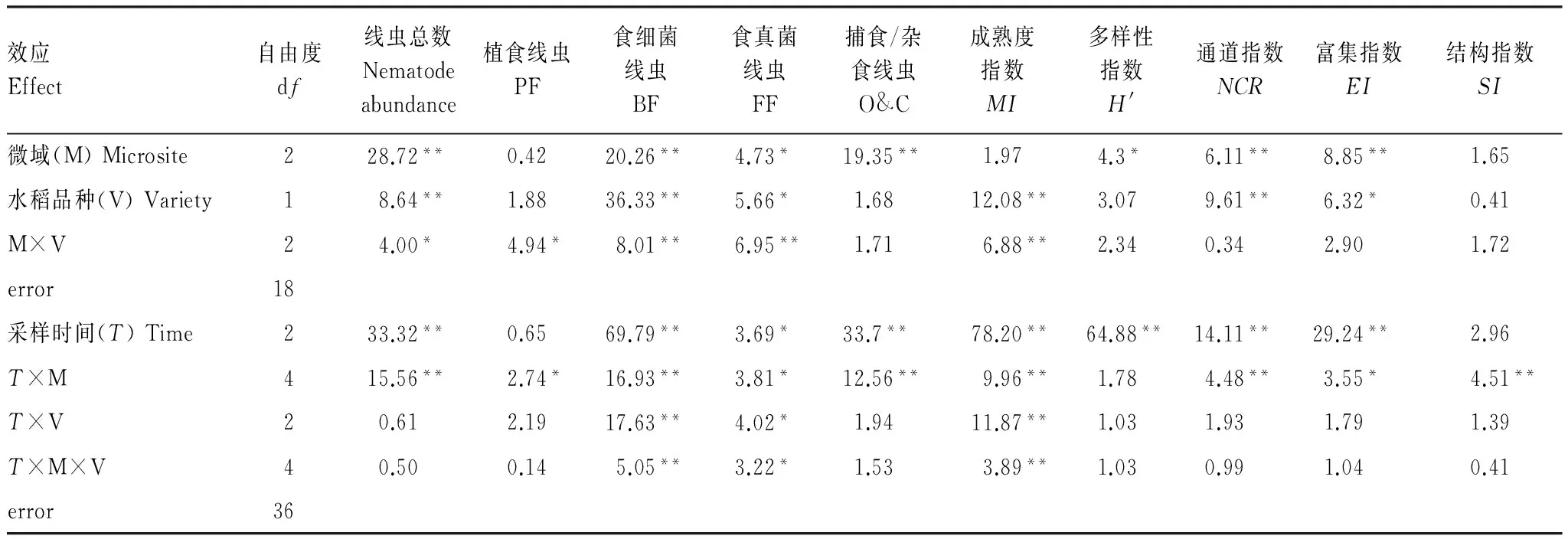
效应Effect自由度df线虫总数Nematodeabundance植食线虫PF食细菌线虫BF食真菌线虫FF捕食/杂食线虫O&C成熟度指数MI多样性指数H'通道指数NCR富集指数EI结构指数SI微域(M)Microsite228.72**0.4220.26**4.73*19.35**1.974.3*6.11**8.85**1.65水稻品种(V)Variety18.64**1.8836.33**5.66*1.6812.08**3.079.61**6.32*0.41M×V24.00*4.94*8.01**6.95**1.716.88**2.340.342.901.72error18采样时间(T)Time233.32**0.6569.79**3.69*33.7**78.20**64.88**14.11**29.24**2.96T×M415.56**2.74*16.93**3.81*12.56**9.96**1.784.48**3.55*4.51**T×V20.612.1917.63**4.02*1.9411.87**1.031.931.791.39T×M×V40.500.145.05**3.22*1.533.89**1.030.991.040.41error36
PF: Plant feeders; BF: Bacterial feeders; FF: Fungal feeders; O&C: Omnivorous & Carnivorous;MI: Maturity index;H′: Shannon-Wiener index;NCR: Nematode channel ratio;EI: Enrichment index;SI: Structure index; *P<0.05, **P<0.01
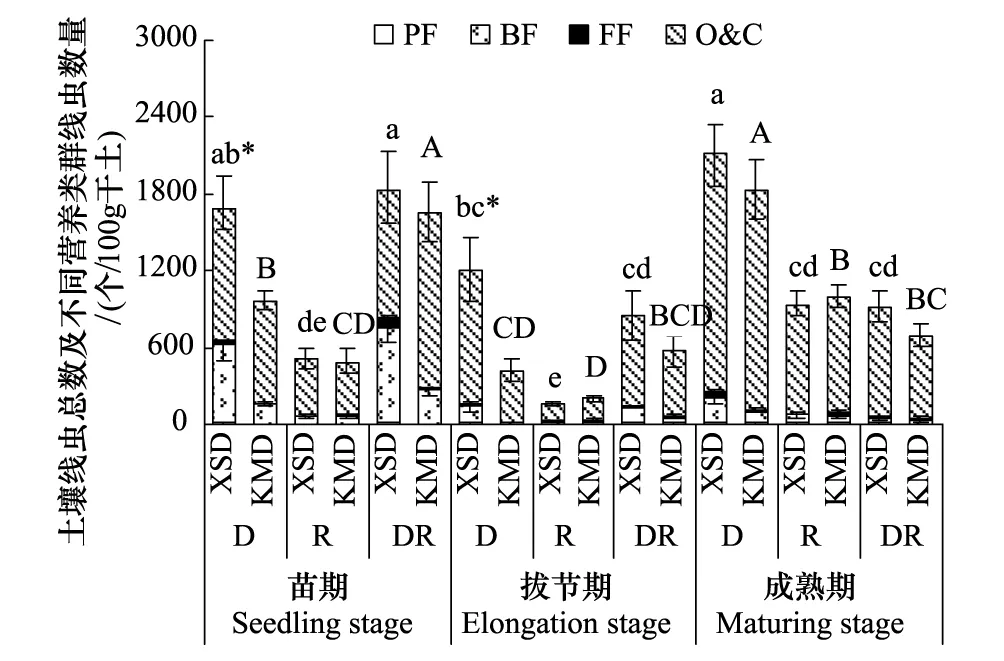
图5 转Bt水稻(KMD)及亲本(XSD)对不同微域土壤线虫总数和营养类群结构的影响(平均值±标准误)Fig.5 Effects of transgenic Bt and non-Bt rice varieties on soil nematode abundance and trophic groups (mean±SE)
转Bt水稻的种植增加了拔节期和成熟期R土壤的线虫数量,但增量很小,在其他处理中线虫数量均降低,并在苗期和拔节期的D土壤中达到显著水平(P<0.05)(图5)。在苗期和拔节期D土壤中KMD显著降低了食微线虫比例,在拔节期R土壤中显著增加了植食线虫比例。
非度量多变量排序(nMDS)结果表明,整个水稻生育期内、不同微域土壤中转Bt水稻与亲本相比线虫群落结构无显著差异(图6),D和R土壤线虫群落结构在3次采样时间下区分明显,说明D和R微域中采样时间对线虫群落结构的影响达到显著水平(P<0.05,图6a,b);拔节期和成熟期的根际-凋落物际(DR)土壤线虫群落结构区分不明显(图6c)。而在苗期和拔节期,R处理与其他两处理差异显著,D和DR土壤中XSD和KMD区分明显(图6d,e);水稻成熟期时,D处理与其他两处理差异显著(图6f)。
3 讨论
3.1 转Bt水稻对不同微域土壤Bt蛋白及可利用资源的影响
Bt杀虫蛋白在土壤中能否长期残留取决于Bt蛋白含量的释放量、微生物降解速率和非生物的钝化速率等[28- 29],一些研究发现转Bt水稻杀虫蛋白不会在土壤中积累[30- 31]。本实验发现在水稻苗期和拔节期,KMD的凋落物际和交互微域土壤中Bt蛋白含量高于根际。这可能是由于水稻生长前期土壤中凋落物迅速分解,向土壤中释放了少量的Bt蛋白[32]。而3个采样时期KMD全部微域土壤之间的Bt蛋白含量无显著差异,认为种植转Bt水稻并不会造成土壤Bt蛋白含量的增加。转Bt抗虫水稻秸秆还田后只要经一定时间的充分降解,秸秆中的Bt蛋白一般不会在土壤中形成明显的残留[33- 34]。Saxena等[35]认为Bt蛋白的残留视作物类型而定,一些抗虫作物(如玉米、马铃薯等)通过根系分泌使土壤中有Cry蛋白,而Bt棉花、油菜和烟草却没有。

图6 不同微域(a, b, c)和采样时间(d, e, f)条件下土壤线虫群落的非参数多变量排序图Fig.6 Non-metric multidimensional scaling ordination of soil nematode community structure under different microsites (a,b,c) and sampling dates (d,e,f)
本研究发现土壤可溶性有机碳含量仅受到微域和采样时间的显著影响,而非水稻品种的影响。有机物与土壤的界面往往含有更高的来自凋落物和根系的可溶性碳氮资源[36- 37]。李修强等[38]通过连续两年田间种植也没有发现转Bt水稻对土壤可溶性有机碳和氮产生持续的显著影响,而采样时间对其影响显著,玉米的研究中也得到相同的结论[39- 40]。土壤矿质氮受采样时间影响显著,说明随着水稻根系的生长,根际的效应逐渐强化,对土壤矿质氮的作用不断加强。转Bt水稻相比于亲本对土壤矿质氮的影响因微域的不同而变化,推测由于水稻苗期根系不发达,且网袋内的凋落物迅速分解,到了成熟期水稻根系旺盛、凋落物分解渐缓,这两个过程交互作用影响土壤矿质氮的变化。刘玲等[41]发现种植转Bt玉米2个月左右后,根际土壤铵态氮含量较亲本玉米显著降低,硝态氮含量与亲本无显著差异。
3.2 转Bt水稻对不同微域土壤微生物学性质的影响
土壤微生物生物量碳能够快速反映土壤有机碳的数量和质量变化[42]。本研究结果表明转Bt水稻显著提高了苗期凋落物际土壤微生物生物量碳,而在水稻拔节期和成熟期显著降低了根际土壤微生物生物量氮,可能是由于添加的转Bt和亲本水稻凋落物在有机物组成上的差异所致[20];上述结果也暗示转Bt水稻种植后土壤微生物群落结构可能也发生了变化。李修强等[38]通过大田实验发现,相比各自的亲本,克螟稻和华恢1号显著降低了苗期土壤MBC,而Bt汕优稻则效果相反;戚琳等[43]通过1a的田间实验发现不同转基因水稻品种对土壤微生物量的影响不同,种植HH1比亲本水稻MH63显著增加了土壤微生物生物量碳含量,而种植另外两种转Bt水稻T2A- 1和T1C- 19与亲本相比没有差异;3种转Bt水稻种植后与亲本相比对土壤微生物生物量氮含量没有影响;而万小羽等[44]和Sarkar等[45]均研究发现Bt棉花的根际土壤微生物生物量碳显著高于对照。这些研究结果间的分歧说明土壤生物受到的影响因素非常复杂,尚不能确定是Bt蛋白的影响。
种植转Bt水稻与亲本水稻对土壤基础呼吸无显著影响,在其他植物(如玉米)上也发现了类似的结果[39- 45, 46]。但也有研究得出相反的结论,李修强等[38]研究发现转Bt水稻与各自亲本相比,对土壤基础呼吸的影响达到显著水平。本研究发现土壤中添加转Bt水稻凋落物后,成熟期凋落物际土壤基础呼吸与亲本凋落物际存在显著差异。这是因为凋落物是土壤生物可利用物质和能量的主要来源,添加的转Bt和亲本水稻凋落物在有机物组成不同,对凋落物际的微生物群落活性产生了不同的影响。土壤微生物代谢熵(qCO2)为土壤微生物呼吸释放的CO2-C量与土壤微生物生物量碳的比值,其值的变化能够反映土壤有机碳源的生物有效性或者微生物对有机碳的利用效率。土壤微生物代谢熵显著受到水稻品种的影响,但各采样时间内,转Bt水稻对其影响不显著,说明转Bt水稻对土壤有机碳生物有效性及微生物碳源利用效率的影响主要依赖于水稻生长期和微域类型。
3.3 转Bt水稻对不同微域土壤线虫群落的影响
本研究发现苗期交互微域土壤线虫总数显著高于根际土壤,说明土壤中添加水稻凋落物显著提高了苗期土壤线虫总数,而在拔节期和成熟期,根际和交互微域土壤间各个水稻品种下线虫总数无显著差异,与微生物学性质变化的原因基本一致,推测在水稻成熟期由于凋落物处于分解的后期,凋落物际作用的弱化导致两个处理间的差异逐渐消失[47- 48]。转Bt水稻短期内对食微线虫和植食线虫的数量产生了显著的影响,由于微域土壤内Bt蛋白含量的差异不明显,上述结果更可能是由于转Bt作物外源基因的插入导致根系分泌物成分发生变化,或作物生理生化性状改变了土壤中化学物质的比例,进而影响线虫群落的数量和组成[28]。转Bt作物对土壤线虫影响的研究有诸多不同结果,Griffiths等[16]发现在3个不同地点大田种植Bt玉米与非Bt玉米相比,线虫数量表现出显著而短暂的降低趋势,而温室实验结论相反[49]。戚琳等[43]发现田间种植转Bt与非Bt水稻,二者土壤线虫总数无显著差异,植食线虫和捕食/杂食线虫的比例增加。李修强等[8]发现各采样时期BtSY63和SY63土壤线虫数量差异均未达到显著水平,而线虫群落的Shannon多样性指数、线虫通道指数和成熟度指数均受采样时间影响显著。此外,不同作物种类、土壤类型、气候条件和土样采集方式对土壤线虫群落也存在影响,今后仍需长期定位实验才能更全面系统地评价转Bt水稻对土壤非靶标生物的影响。
4 结论
转Bt水稻对线虫群落结构的影响依赖于水稻生育期和微域的差异,土壤有效资源、微生物学性质和线虫总数及群落结构受到的显著影响更主要是来源于微域及微域间的交互作用。伴随水稻的生长及分解进程,根际的作用逐渐加强,而凋落物际的作用减弱。这两个过程共同影响微域内土壤生物群落的数量和活性。转Bt水稻与亲本相比,对根际土壤微生物生物量氮、硝态氮和凋落物际土壤的微生物生物量碳、基础呼吸、可溶性有机氮的影响达到显著水平。转Bt水稻总体上降低了线虫的数量,尤其在苗期和拔节期的凋落物际土壤中达到显著水平;苗期凋落物际和交互微域内土壤食微线虫数量受水稻品种的显著影响。由于根系和凋落物是作物直接影响土壤群落的重要因素,因此结合二者进行评价能够更全面地反映和预警转Bt作物对土壤生物的影响。今后有必要结合大田以及微域实验的长期研究,以评估转基因作物对土壤非靶标生物群落的生态风险。
[1] 韩兰芝, 吴孔明, 彭于发, 郭予元. 转基因抗虫水稻生态安全性研究进展. 应用与环境生物学报, 2006, 12(3): 431- 436.
[2] 贾乾涛, 石尚柏, 杨长举, 彭于发. 转Bt基因水稻生长期几种重要成分含量的变化研究. 中国农业科学, 2005, 38(10): 2002- 2006.
[3] 徐雪亮, 韩宇, 吴刚, 蔡万伦, 袁本琦, 王晖, 刘方舟, 王满囷, 华红霞. 转cry1Ab/1Ac, cry1C, cry2A基因水稻对田间稻纵卷叶螟及其捕食类天敌的影响. 中国科学(生命科学), 2011, 41(11): 1095- 1104.
[4] Chen M, Liu Z C, Ye G Y, Shen Z C, Hu C, Peng Y F, Altosaar I, Shelton A M. Impacts of transgeniccry1Abrice on non-target planthoppers and their main predatorCyrtorhinuslividipennis(Hemiptera: Miridae) —A case study of the compatibility ofBtrice with biological control. Biological Control, 2007, 42(2): 242- 250.
[5] 王园园, 李云河, 陈秀萍, 武红巾, 彭于发. 抗虫转基因植物对非靶标节肢动物生态影响的研究进展. 生物安全学报, 2011, 20(2): 100- 107.
[6] 袁一杨, 戈峰. 转Bt基因作物对非靶标土壤动物的影响. 应用生态学报, 2010, 21(5): 1339- 1345.
[7] Bai Y Y, Yan R H, Ke X, Ye G Y, Huang F N, Luo Y M, Cheng J A. Effects of transgenicBtrice on growth, reproduction, and superoxide dismutase Activity ofFolsomiacandida(Collembola: Isotomidae) in laboratory studies. Journal of Economic Entomology, 2011, 104(6): 1892- 1899.
[8] 李修强, 陈法军, 刘满强, 陈小云, 胡锋. 转基因水稻Bt汕优63种植两年对土壤线虫群落的影响. 应用生态学报, 2012, 23(11): 3065- 3071.
[9] Lundgren J G, Gassmann A J, Bernalc J, Duan J J, Ruberson J. Ecological compatibility of GM crops and biological control. Crop Protection, 2009, 28(12): 1017- 1030.
[10] Then C. Risk assessment of toxins derived fromBacillusthuringiensis-synergism, efficacy, and selectivity. Environmental Science and Pollution Research, 2010, 17(3): 791- 797.
[11] 邵元虎, 傅声雷. 试论土壤线虫多样性在生态系统中的作用. 生物多样性, 2007, 15(2): 116- 123.
[12] Neher D A. Role of nematodes in soil health and their use as indicators. Journal of Nematology, 2001, 33(4): 161- 168.
[13] Yeates G W. Nematodes as soil indicators: functional and biodiversity aspects. Biology and Fertility of Soils, 2003, 37(4): 199- 210.
[14] 陈小云, 刘满强, 胡锋, 毛小芳, 李辉信. 根际微型土壤动物——原生动物和线虫的生态功能. 生态学报, 2007, 27(8): 3132- 3143.
[15] Chen M, Ye G Y, Liu Z C, Fang Q, Hu C, Peng Y F, Shelton A M. Analysis ofCry1Abtoxin bioaccumulation in a food chain ofBtrice, an herbivore and a predator. Ecotoxicology, 2009, 18(2): 230- 238.
[16] Griffiths B S, Caul S, Thompson J, Birch A N E, Scrimgeour C, Andersen M N, Cortet J, Messean A, Sausse C, Lacroix B, Krogh P H. A comparison of soil microbial community structure, protozoa, and nematodes in field plots of conventional and genetically modified maize expressing theBacillusthuringiensisCry1Ab toxin. Plant and Soil, 2005, 275(1/2): 135- 146.
[17] Saxena D, Stotzky G.Bacillusthuringiensis(Bt) toxin released from root exudates and biomass ofBtcorn has no apparent effect on earthworms, nematodes, protozoa, bacteria, and fungi in soil. Soil Biology and Biochemistry, 2001, 33(9): 1225- 1230.
[18] Höss S, Nguyen H, Pagel-Menzel R, Pagel-Wieder S, Miethling-Graf R, Tebbe C C, Jehle J A, Traunspurger W. Assessing the risk posed to free-living soil nematodes by a genetically modified maize expressing the insecticidal Cry3Bb1 protein. Science of the Total Environment, 2011, 409(13): 2674- 2684.
[19] Mina U, Chaudhary A, Kamra A. Effect ofBtcotton on enzymes activity and microorganisms in rhizosphere. Journal of Agricultural Science, 2011, 3(1): 96- 104.
[20] Marschner P, Marhan S, Kandeler E. Microscale distribution and function of soil microorganisms in the interface between rhizosphere and detritusphere. Soil Biology and Biochemistry, 2012, 49: 174- 183.
[21] Ingwersen J, Poll C, Streck T, Kandeler E. Micro-scale modelling of carbon turnover driven by microbial succession at a biogeochemical interface. Soil Biology and Biochemistry, 2008, 40(4): 864-878.
[22] Gaillard V, Chenu C, Recous S. Carbon mineralisation in soil adjacent to plant residues of contrasting biochemical quality. Soil Biology and Biochemistry, 2003, 35(1): 93- 99.
[23] Bonkowski M, Villenave C, Griffiths B S. Rhizosphere fauna: The functional and structural diversity of intimate interactions of soil fauna with plant roots. Plant and Soil, 2009, 321(1/2): 213- 233.
[24] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 1999.
[25] 刘满强, 黄菁华, 陈小云, 王峰, 葛成, 苏昱, 邵波, 汤英, 李辉信, 胡锋. 地上部植食者褐飞虱对不同水稻品种土壤线虫群落的影响. 生物多样性, 2009, 17(5): 431- 439.
[26] Bongers T, Ferris H. Nematode community structure as a bioindicator in environmental monitoring. Trends in Ecology and Evolution, 1999, 14(6): 224- 228.
[27] Ferris H, Bongers T, de Goede R G M. A framework for soil food web diagnostics: Extension of the nematode faunal analysis concept. Applied Soil Ecology, 2001, 18(1): 13- 29.
[28] Icoz I, Stotzky G. Fate and effects of insect-resistantBtcrops in soil ecosystems. Soil Biology and Biochemistry, 2008, 40(3): 559- 586.
[29] 王建武, 骆世明, 冯远娇, Nakatsu C. 转Bt基因作物Bt毒素在土壤中的环境去向及其生态效应. 生态学报, 2003, 23(4): 797-804.
[30] 张燕飞, 岳龙, 张素芬, 沈佳君, 付秋果, 李菊英, 汪海燕, 叶庆富.Bt水稻杀虫蛋白时空变化及秸秆还田后在土壤中的持留规律. 核农学报, 2011, 25(4): 779- 784.
[31] Wang H Y, Ye Q F, Wang W, Wu L C, Wu W X. Cry1Ab protein fromBttransgenic rice does not residue in rhizosphere soil. Environmental Pollution, 2006, 143(3): 449- 455.
[32] 付庆灵, 陈愫惋, 胡红青, 李珍, 韩晓芳, 王朴. 种植转Bt基因棉土壤中Bt蛋白的分布. 应用生态学报, 2011, 22(6): 1493- 1498.
[33] Ahmad A, Wilde G E, Zhu K Y. Detectability of coleopteran-specific Cry3Bb1 protein in soil and its effect on nontarget surface and below-ground arthropods. Environmental Entomology, 2005, 34(2): 385- 394.
[34] Icoz I, Stotzky G. Cry3Bb1 protein fromBacillusthuringiensisin root exudates and biomass of transgenic corn does not persist in soil. Transgenic Research, 2008, 17(4): 609- 620.
[35] Saxena D, Stewart C N, Altosaar I, Shu Q, Stotzky G. Larvicidal Cry proteins fromBacillusthuringiensisare released in root exudates of transgenicB.thuringiensiscorn, potato, and rice but not ofB.thuringiensiscanola, cotton, and tobacco. Plant Physiology and Biochemistry, 2004, 42(5): 383- 387.
[36] Appuhn A, Joergensen R G. Microbial colonisation of roots as a function of plant species. Soil Biology and Biochemistry, 2006, 38(5): 1040- 1051.
[37] Poll C, Marhan S, Ingwersen J, Kandeler E. Dynamics of litter carbon turnover and microbial abundance in a rye detritusphere. Soil Biology and Biochemistry, 2008, 40(6): 1306- 1321.
[38] 李修强, 陈法军, 刘满强, 胡锋. 转Bt水稻对土壤可溶性有机碳氮及微生物学性质的影响. 应用生态学报, 2012, 23(1): 96- 102.
[39] 王建武, 冯远娇. 种植Bt玉米对土壤微生物活性和肥力的影响. 生态学报, 2005, 25(5): 1213- 1220.
[40] Mungai N W, Motavalli P P, Nelson K A, Kremer R J. Differences in yields, residue composition and N mineralization dynamics ofBt- and non-Btmaize. Nutrient Cycling in Agroecosystems, 2005, 73(1): 101- 109.
[41] 刘玲, 赵建宁, 李刚, 杨殿林, 王生荣, 娜布其, 娜日苏. 转Bt玉米对土壤酶活性及速效养分的影响. 土壤, 2012, 44(1): 167- 171.
[42] 胡亚林, 汪思龙, 黄宇, 于小军. 凋落物化学组成对土壤微生物学性状及土壤酶活性的影响. 生态学报, 2005, 25(10): 2662- 2668.
[43] 戚琳, 陈法军, 刘满强, 陈小云, 祝向钰, 李辉信, 胡锋. 三种转Bt水稻短期种植对土壤微生物生物量和线虫群落的影响. 生态学杂志, 2013, 32(4): 975- 980.
[44] 万小羽, 梁永超, 李忠佩, 宋阿琳, 娄运生. 种植转Bt基因抗虫棉对土壤生物学活性的影响. 生态学报, 2007, 27(12): 5414- 5420.
[45] Sarkar B, Patra A K, Purakayastha T J, Megharaj M. Assessment of biological and biochemical indicators in soil under transgenicBtand non-Btcotton crop in a sub-tropical environment. Environmental Monitoring and Assessment, 2009, 156(1/4): 595- 604.
[46] Raubuch M, Behr K, Roose K, Joergensen R G. Specific respiration rates, adenylates, and energy budgets of soil microorganisms after addition of transgenicBt-maize straw. Pedobiologia, 2010, 53(3): 191- 196.
[47] Flores S, Saxena D, Stotzky G. TransgenicBtplants decompose less in soil than non-Btplants. Soil Biology and Biochemistry, 2005, 37(6): 1073- 1082.
[48] Poerschmann J, Gathmann A, Augustin J, Langer U, Górecki T. Molecular composition of leaves and stems of genetically modifiedBtand near-isogenic non-Btmaize-characterization of lignin patterns. Journal of Environmental Quality, 2005, 34(5): 1508- 1518.
[49] Griffiths B S, Caul S, Thompson J, Birch A N E, Scrimgeour C, Cortet J, Foggo A, Hackett C A, Krogh P H, Soil microbial and faunal community responses toBtmaize and insecticide in two soils. Journal of Environmental Quality, 2006, 35(3): 734- 741.
Influences of rhizosphere and detritusphere ofBtrice on soil nematode communities
QI Lin1, LIU Manqiang1,2,*, JIANG Linhui1, ZHANG Jianqiao1, LI Xiuqiang1, CHEN Fajun3, HU Feng1
1SoilEcologyLab,CollegeofResourcesandEnvironmentalSciences,NanjingAgriculturalUniversity,Nanjing210095,China2StateKeyLaboratoryofSoilandSustainableAgriculture,InstituteofSoilScience,ChineseAcademyofSciences,Nanjing210008,China3DepartmentofEntomology,CollegeofPlantProtection,NanjingAgriculturalUniversity,Nanjing210095,China
It is important to evaluate the ecological risks of transgenicBtrice on soil non-target organisms before it is widely released in the market. Rhizosphere and detritusphere formed by plant roots and organic residues that contact soil directly, and represent two distinct microsites that are highly affected by plants. Pot experiments were established to investigate the effects of rice, a variety genetically modified to express theBtprotein, KMD, and its parental line, XSD, on soil chemical, microbial properties and nematode assemblages of the two microsites. Results indicated that effects of transgenicBtrice on soil properties varied with plant growth stage and microsite type. Compared with XSD, KMD increased the concentrations of soil dissolved organic nitrogen in detritusphere (D) at seedling and elongation stages, whereas the concentrations of ammonium in the detritusphere were decreased significantly by KMD at seedling stage (P<0.05). At maturing stage, KMD increased the concentrations of ammonium in the detritusphere and overlapped microsite (DR, i.e. the area that affected by both rhizosphere and detritusphere) significantly (P<0.05). With regard to soil microbial biomass, KMD significantly increased the concentrations of soil microbial biomass carbon (MBC) in detritusphere at seedling and maturing stages (P<0.05), whereas significantly decreased microbial biomass nitrogen (MBN) in rhizosphere at elongation and maturing stages (P<0.05). Integrated effects of the two microsites had a significant effect on concentrations of microbial biomass carbon and nitrogen as well as dissolved organic matter, total nematode numbers and nematode numbers of different feeding groups (P<0.05). Generally, KMD decreased the total nematode numbers, especially there were significantly fewer nematodes in the detritusphere of KMD than XSD at seedling and elongation stages (P<0.05). Repeated-measure ANOVA indicated that transgenicBtrice KMD had significant effects on numbers of bacterial feeders (P<0.01) and fungal feeders (P<0.05), nematode channel ratio (NCR) and enrichment index (EI). In addition, the genetically modified KMD significantly decreased (P<0.05) the proportions of bacterial feeders and fungal feeders in detritusphere at seedling and elongation stages, and such trends were consistent to the responses of ammonium concentrations of the same microsite and growth stage. In light of soilBtprotein concentrations under KMD treatments after maturing stage,Btrice showed no significant effect, though the content ofBtprotein in straw of KMD was significantly higher than that of XSD, indicating that significant differences of effects of KMD from XSD might not result fromBtprotein itself, but from the difference of other traits such as rice growth and residue chemical composition. Together, we found that microsite studies combining the rhizosphere and detritusphere would facilitate to demonstrate the responses of soil microbial properties and nematode assemblages to explore the ecological impacts and mechanisms of growing genetically modified rice.
transgenicBtrice; rhizosphere; detrisphere;Btprotein; nematode assemblage
土壤与农业可持续发展国家重点实验室开放课题(0812201218); 转基因生物新品种培育重大专项(2013ZX08012- 005); 南京农业大学SRT项目(201206); 江苏高校优势学科(PAPD)
2013- 05- 14;
日期:2014- 04- 17
10.5846/stxb201305141061
*通讯作者Corresponding author.E-mail: liumq@njau.edu.cn
戚琳,刘满强,蒋林惠,张楗峤,李修强,陈法军,胡锋.基于根际与凋落物际评价转Bt水稻对土壤线虫群落的影响.生态学报,2015,35(5):1434- 1444.
Qi L, Liu M Q, Jiang L H, Zhang J Q, Li X Q, Chen F J, Hu F.Influences of rhizosphere and detritusphere ofBtrice on soil nematode communities.Acta Ecologica Sinica,2015,35(5):1434- 1444.

