中国弧隔鼠尾草亚属(唇形科)的分布格局
王 琦, 魏宇昆, 黄艳波
上海辰山植物园, 中国科学院上海辰山植物科学研究中心, 上海 201602
中国弧隔鼠尾草亚属(唇形科)的分布格局
王 琦, 魏宇昆*, 黄艳波
上海辰山植物园, 中国科学院上海辰山植物科学研究中心, 上海 201602
弧隔鼠尾草亚属(Subg.SalviaBenth.)是中国原产鼠尾草属最大的属下类群,有44种13变种,大多含有与丹参(S.miltiorrhiza)类似的活性化合物成分和药用功效,是具有较高利用前景的野生药用植物资源。从形态学分析,该亚属具备原始类群的主要特征,物种分化明显,是研究鼠尾草属起源和演化的关键材料;从地理分布格局看,该亚属集中分布于青藏高原以及横断山脉的高海拔地区,较少扩散至低海拔的华中与华东,易受环境和全球气候变化的影响,生境人为干扰强烈,资源保护压力较大。据此,对弧隔鼠尾草亚属物种分布区进行了全面调查,结合标本记录,获得该类群具经纬度的物种分布记录2689条,海拔高度记录1007条,分布点涵盖286个县级地区。进一步对亚属内各组、系的水平与垂直分布格局深入分析。结果表明,亚属以横断山为核心区,主要分布于西藏东南至川西一带,零星扩散迁移至河北北部、湖北东部,其狭域分布的特有种比例非常高,占总物种数的45%。在物种海拔分布格局上,亚属内6个系具有替代分布现象,从高海拔的窄域分布物种逐渐过渡到低海拔的宽域分布物种。基于最大熵模型预测的亚属出现概率与物种实际分布范围基本吻合,从单一环境因子与出现概率的关系看,12月降水量、9月降水量、年温度变化范围、海拔、3月最高气温和温度季节性变化系数是影响物种分布的主导环境因子。鼠尾草雄蕊的分化是物种形成和多样性产生的关键因素,亚属内不同类群的分布格局与雄蕊花丝药隔比例的相关性表明,环境因子和传粉者选择可能共同作用形成现有弧隔鼠尾草亚属的分布格局。
弧隔鼠尾草亚属; 宽球苏组; 分布格局; 环境因子; 最大熵模型; 传粉者选择
中国分布的原产鼠尾草属(SalviaL.)植物有82种24变种[1- 2],属下依据花器官形态(主要是雄蕊形态和花药发育状况)分为3个亚属,弧隔鼠尾草亚属(Subg.SalviaBenth.),荔枝草亚属(Subg.SclareaBenth.)和鼠尾草亚属(Subg.AllagospadonopsisBriq.)[3],弧隔鼠尾草亚属是最大类群,有44种13个变种,亚属下的2个组仅宽球苏组(Sect.EurysphaceStib.)为中国原产,其下分为多年生亚组(Subsect.PerennesC. Y. Wu)和一年生亚组(Subsect.AnnuaeC. Y. Wu),多年生亚组由8个系组成。弧隔鼠尾草亚属具有鼠尾草属原始类群的诸多特征:多年生根系粗大、叶多数基生、单叶宽大、叶片厚且多毛、花冠大型、冠筒宽大、上唇平伸、唇裂较浅、雄蕊花丝较长,药隔延伸不显著、上下臂花药均可育而与另外2个亚属相区别;该亚属主要分布于中国云南西北部、四川西南部以及西藏东南部,处在青藏高原东缘与横断山的亚属分化中心对全球气候变化敏感,生境易受人为干扰,物种资源的保育生物学亟需开展;亚属内有18种记载为民间入药[4],除去用作丹参(S.miltiorrhiza)代用品具有活血祛瘀、通经止痛作用之外,还具有治疗头晕、风湿痛、补肾等功效[3- 5],已从鼠尾草属134个物种分离到773种次生代谢化合物,分别属于倍半萜类、二萜类、二倍半萜类、三萜类、固醇类、多酚类及其他化合物[5]。弧隔鼠尾草亚属多样性中心所在的横断山海拔落差大、气候类型多样、生境异质性显著,植物次生代谢产物多样性以及具潜在利用价值的药用资源较丰富。认识物种的分布式样及其环境影响模式是植物资源保护与利用的生态学理论基础,目前对弧隔鼠尾草亚属植物的研究主要集中在资源现状[6- 7]、传粉机制[8- 11]、叶表皮形态[12]、化学成分及分类[13- 16]等方面,而该亚属起源、物种分化和分布格局的研究几近空白,本研究组实地调查分布区内15个省市自治区的物种资源现状,查询32个标本馆以获取物种分布信息,利用ArgGIS和最大熵模型Maxent对亚属内各组系分类单元的现有和潜在分布进行分析和预测,筛选出影响亚属物种分布的主导环境因子。基于上述研究,文章探讨了进化、气候和传粉者对现有分布格局的影响,以期从宏观层面认识鼠尾草属多样性和分布格局的形成机制。随着生物多样性信息学学科的兴起,生物多样性基础数据的数字化、模型工具和各种软件工具的开发、数据整合迅速发展[17],各个国家、地区对生物多样性研究和植物资源保护也日趋重视,藉此通过广泛的国际合作,对鼠尾草属这样的世界大属的了解将越来越深入,对于它们的物种多样性和分布格局的形成机制的阐明,将对此类世界分布物种的多样性和分布格局形成机制研究提供一定借鉴。
1 材料与方法
1.1 研究类群
弧隔鼠尾草亚属最早由Bentham于1876年命名,亚属下分3个组Sect.Hymenosphace, Sect.Eusphace, Sect.Drymosphace[18],之后Stibal将Sect.DrymosphaceBenth.中雄蕊下臂具花药的类群分出,命名为宽球苏组Sect.Eurysphace Stib.[19],构成中国原产的“狭义”弧隔鼠尾草亚属的主体,其余雄蕊下臂不育的类群仍然保留原组名,划分到新建立的荔枝草亚属中。因此,最早定义的弧隔鼠尾草亚属包含荔枝草亚属的丹参组(Sect.Drymosphace)和“狭义”的弧隔鼠尾草亚属宽球苏组(Sect.Eurysphace Stib.)2个类群共60个种。本文采用与《中国植物志》相同的“狭义”弧隔鼠尾草亚属概念,即仅指原产中国的宽球苏组44种13变种,另一真球苏组(Sect.EusphaceBenth.)仅一种且非原产中国。吴征镒基于生活史以及叶着生方式、形状,花冠大小与伸出方式将宽球苏组划分为多年生亚组(Subsect.PerennesC. Y. Wu)和一年生亚组(Subsect.AnnuaeC. Y. Wu),多年生亚组分为8个系:西藏鼠尾草系(Ser.HiantesC. Y. Wu)、毛地黄鼠尾草系(Ser.DigitaloiditesC. Y. Wu)、短冠鼠尾草系(Ser.BrachylomaeC. Y. Wu)、栗色鼠尾草系(Ser.CastaneaeC. Y. Wu)、钟萼鼠尾草系(Ser.CampanulataeC. Y. Wu)、鄂西鼠尾草系(Ser.MaximowiczianaeC. Y. Wu)、琴柱草系(Ser.NipponicaeC. Y. Wu)和苣叶鼠尾草系(Ser.SonchifoliaeC. Y. Wu)[20]。其中琴柱草系仅有台湾琴柱草(S.nipponicavar.formosana)分布于台湾省,苣叶鼠尾草系也只有苣叶鼠尾草(S.sonchifolia)分布于云南西畴等少数地区,仅就组系分类单元的分布格局而言,不在本文研究的涉及范畴。一年生亚组未分系,该亚组有粘毛鼠尾草(S.roborowskii)、黄鼠狼花(S.tricuspis)和荫生鼠尾草(S.umbratica)3个种。
1.2 数据收集与处理
自2010年至2013年,对15个省市自治区的弧隔鼠尾草亚属分布区进行野外考察,实地调查国内32所高校及研究所标本馆(标本馆及代码见附录1)馆藏标本,补充查询国际权威生物多样性信息网站(GBIF(http://data.gbif.org/)、The Plant List(http://www.theplantlist.org/))、中国数字标本馆(CVH)(http://www.cvh.org.cn/)、教学标本资源共享平台(http://mnh.scu.edu.cn/)、中国自然保护区标本资源共享平台(http://www.papc.cn/),获得有关类群分布记录的经纬度和海拔信息。利用ArcGIS 9.3,以物种分布点所在县域范围绘制弧隔鼠尾草亚属各组系的地理分布图;提取物种分布的海拔高度信息,将各物种每号标本的海拔信息记录到相应的海拔范围内,每出现1号标本计为1,如此累计,分别绘制:(1) 以100 m为1个海拔带的弧隔鼠尾草亚属物种分布随海拔变化趋势图;(2) 以300 m为1个海拔带的多年生亚组和一年生亚组物种出现频率随海拔变化的趋势图;(3) 以100 m为1个海拔带的亚属内6个系物种出现频率累计超过50%的海拔分布范围。
对物种分布区的实地调查结合查询公共数据库的标本记录信息,共获得该类群具县级及县级以下行政单位的经纬度记录2689条,去除重复数据共得到699条记录,这些分布点共涵盖286个县级地区,除去分布至国外的5个种(粘毛鼠尾草S.roborowskii,裂萼鼠尾草S.schizocalyx,钟萼鼠尾草S.campanulata,锡金鼠尾草S.sikkimensis,栗色鼠尾草S.castanea)外[1,3,21],其余均为中国特有种。1∶400万的中国行政区划图由国家基础地理信息系统网站(http://nfgis.nsdi.gov.cn/)下载。
1.3 潜在分布预测
Maxent模型是根据已知物种的实际分布信息和分布区域的环境变量运算模拟出目标物种在目标区域的可能分布情况,与其他物种分布模型相比,在生物分布模拟方面Maxent模型具有较高的优越特性[22- 26]。根据调查获得的物种实际分布点经纬度信息,利用基于生态位原理的最大熵模型软件Maxent V3.3.3(http://www.cs.princeton.edu/~schapire/maxent)预测弧隔鼠尾草亚属的潜在分布区,以出现概率(occurrence probability)P值的大小(0—1)表示分布区的物种适生程度,结合ArcGIS 9.3绘制物种的潜在分布图。环境因子数据来源于世界气候数据库(http://www.worldclim.org/),包括近50年来的降水记录、平均温度、最高气温、最低气温和海拔等68项数据,精度为2.5 arc min(附录2)。将亚属物种地理分布数据和潜在环境因子数据分别导入Maxent模型中,环境图层中导入的环境因子设定为连续变量(continuous),选择创建回应曲线(create response curves),选择刀切法(do jackknife)分析环境变量对亚属物种多度的影响大小,测试集(test data)设定为25%,训练集(traning data)设定为75%,其余选项均采用模型的默认设置。采用受试者工作曲线(receiver operating characteristic curve,ROC曲线)对预测精度进行分析[27]。根据初次模拟结果中68项环境变量对弧隔鼠尾草亚属分布影响贡献率的大小,筛选出贡献率排在前10位的环境变量重建亚属分布的最大熵模型,模型训练的重复数设为10次。
2 结果与分析
2.1 水平分布格局
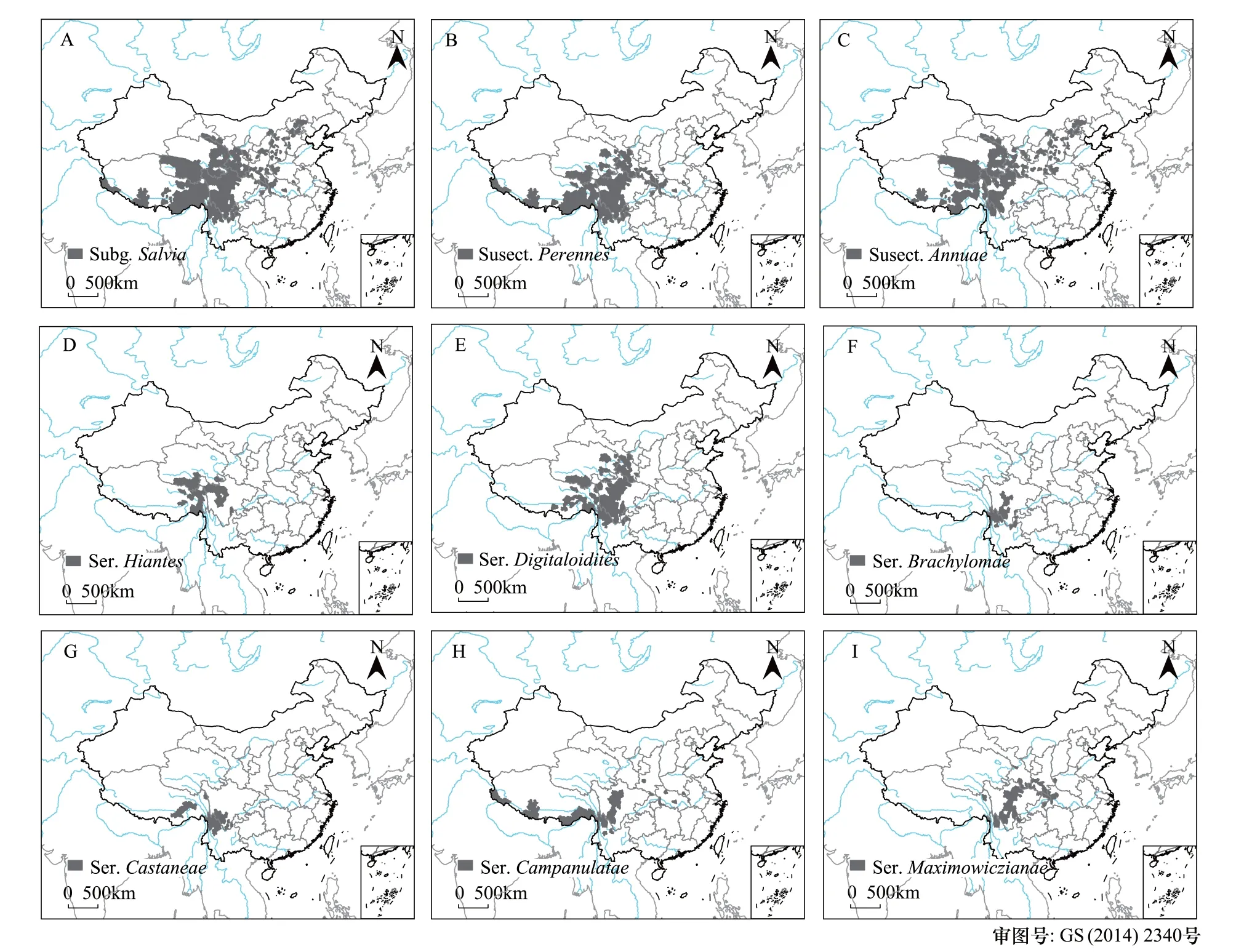
图1 中国弧隔鼠尾草亚属(A)、多年生亚组(B)、一年生亚组(C)、西藏鼠尾草系(D)、毛地黄鼠尾草系(E)、短冠鼠尾草系(F)、栗色鼠尾草系(G)、钟萼鼠尾草系(H)和鄂西鼠尾草系(I)的分布概况Fig.1 Geographic distribution of Chinese Subg. Salvia(A), Subsect. Perennes(B), Subsect. Annuae(C), Ser. Hiantes(D), Ser. Digitaloidites(E), Ser. Brachylomae(F), Ser. Castaneae(G), Ser. Campanulatae(H), Ser. Maximowiczianae(I)
弧隔鼠尾草亚属的多样性中心位于我国的青藏高原横断山区,因此,对我国该亚属的研究可以很好的反映其分布格局的全貌。根据物种所在的县域范围,分别绘制弧隔鼠尾草亚属2个亚组和6个系(含44种13变种)的中国分布概况图(图1)。从分布图中可以看出,整个亚属物种主要分布于云南北部及西北部,四川西部至南部,西藏东部、南部,青海南部,甘肃南部,向东至湖北西北部神农架,零星扩散分布至湖北东部大别山和秦岭,以及山西、境内的吕梁山、太行山,直至河北燕山;多年生亚组则更集中分布于横断山区及藏东南一带,而一年生亚组分布明显分散,从横断山北部至甘肃中部,向东至河北承德;亚组内6个系的分布模式也不尽相同,西藏鼠尾草系、毛地黄鼠尾草系、短冠鼠尾草系和栗色鼠尾草系的分布区集中在西南高海拔地区,其中西藏鼠尾草系主要分布于西藏四川交界地区,毛地黄鼠尾草系分布于横断山、藏东、川西、甘南及青海东部,短冠鼠尾草系和栗色鼠尾草系集中分布于横断山;钟萼鼠尾草系分布经度跨度较大,东至大别山,西至西藏札达县;鄂西鼠尾草系的分布区从横断山直到秦岭和神农架。
从物种水平考察,亚属以横断山为核心分布区,气候类型多样,海拔高差变化显著,狭域特有种(极小种群)较多,有的物种仅有1个记录点,如宝兴鼠尾草(S.paohsingensis四川宝兴)、暗红鼠尾草(S.atrorubra云南丽江)、暗紫鼠尾草(S.atropurpurea云南镇康)、洱源鼠尾草(S.lankongensis云南洱源)、开萼鼠尾草(S.bifidocalyx云南香格里拉)、毛唇鼠尾草(S.pogonochila四川道孚)、异色鼠尾草(S.heterochroa云南贡山)、瓦山鼠尾草(S.himmelbaurii四川峨边),其他如翅柄鼠尾草(S.alatipetiolata)、东川鼠尾草(S.mairei)、短唇鼠尾草(S.brevilabra)、洪桥鼠尾草(S.potanini)、木里鼠尾草(S.handelii)、长花鼠尾草(S.dolichantha)、少花鼠尾草(S.pauciflora)、近掌脉鼠尾草(S.subpalmatinervis)、短冠鼠尾草(S.brachyloma)、苣叶鼠尾草(S.sonchifolia)、裂萼鼠尾草(S.schizocalyx)、裂瓣鼠尾草(S.schizochila)等也仅有2—3个分布点记录。这些物种占到了整个亚属物种数量的45%。
2.2 垂直分布格局

图2 弧隔鼠尾草亚属物种数量随海拔梯度变化趋势Fig.2 Variation trend in the species number of subg. Salvia along an altitude gradient
本文共获得弧隔鼠尾草亚属的海拔记录1007条,记录到的最低海拔记录是600 m(荫生鼠尾草),最高海拔记录达4580 m(粘毛鼠尾草)。按照海拔100 m的梯度统计物种数量随海拔高度的变化趋势显示,随着海拔逐渐增高,物种的出现数量缓慢增加,海拔至3200 m左右达到最高值(16种),至4000 m均保持在一较高水平,之后随海拔增加,物种数量迅速下降,4600 m以上则没有记录到该亚属的物种(图2)。

图3 弧隔鼠尾草亚属多年生亚组与一年生亚组随海拔梯度的出现频率变化趋势Fig.3 Variation trend in occurrence frequency of subsect. Perennes and Annuae in Subg. Salvia along an altitude gradient
多年生亚组和一年生亚组按每300 m为一个海拔分布带,统计物种在其中的出现频率(图3)。结果可以看出,多年生亚组出现的最低海拔在1200 m,随海拔梯度升高至3400 m有最高的出现频率,而一年生亚组出现的最低海拔在600 m,但最高频率出现的海拔与多年生亚组相同。多年生亚组随海拔梯度升高,物种出现频率增加迅速,在2500—3700 m之间保持比较高的水平,之后快速下降,而一年生亚组在1000 m至4300 m之间的出现频率呈波浪式的变化趋势,出现频率在一个较宽的海拔区间保持相对稳定。按照累计物种出现频率大于50%的海拔分布,发现弧隔鼠尾草亚属内6个系海拔分布集中出现的高度和范围不尽相同(图4)。西藏鼠尾草系和短冠鼠尾草系的分布海拔最高,范围最窄,物种可能出现的范围在3600—4000 m之间,栗色鼠尾草系和钟萼鼠尾草系主要分布区的海拔高度下降至2900—3600 m,毛地黄鼠尾草系和鄂西鼠尾草系进一步降低,但主要分布区的海拔范围逐渐增大,如最低的鄂西鼠尾草系海拔带高度在1800—2700 m,而海拔分布宽度也从西藏鼠尾草系的200 m增加至900 m。在物种海拔分布的垂直格局上,可以看出6个系具有一定的替代分布现象,即由高海拔的相对窄域分布类群逐渐替代为低海拔分布的相对宽域分布类群。
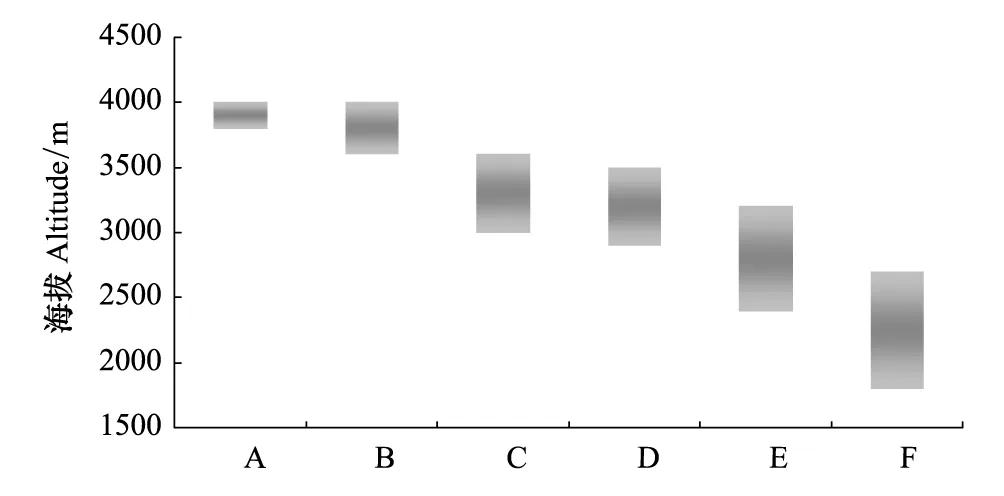
图4 弧隔鼠尾草亚属6个系出现频率累计大于50%的海拔分布Fig.4 Altitude distribution of >50% accumulated occurrence frequency of six series in Subg. Salvia
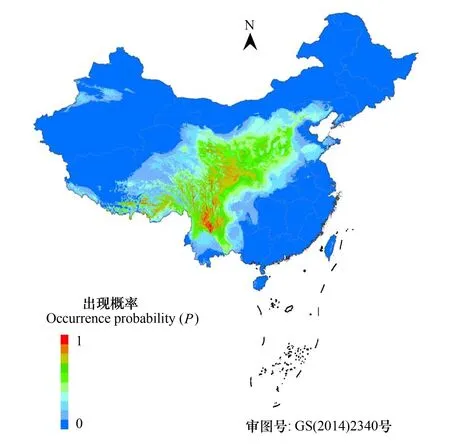
图5 弧隔鼠尾草亚属的潜在分布(P值表示物种出现概率)Fig.5 Potential distribution of subg. Salvia in China. P value represents probability of species occurrence
2.3 亚属物种的潜在分布
根据弧隔鼠尾草亚属699个实际分布点的经纬度信息,利用最大熵模型软件Maxent预测弧隔鼠尾草亚属在中国的潜在分布,以出现概率的P值大小(0—1)表示分布区物种的适生程度(图5),P值越接近于1,物种的适生程度越高。结果表明,预测与物种实际分布范围吻合,亚属分布呈现从西南往东北的逐渐迁移、扩散,出现概率具有从分布核心区往周边地区逐渐下降的趋势。影响亚属分布的主要环境因子是12月降水量(prec12)、9月降水量(prec9)、年温度变化范围(bio7)、海拔(alt)、3月最高气温(tmax3)和温度季节性变化系数(bio4),分析前4项环境因子与亚属物种出现概率的关系图(图6),得到单一环境因子对物种出现概率的变化曲线(蓝线表示多次重复得到的阈值,红线表示多次重复阈值的均值)。结果表明,12月与9月降水量对物种的出现概率均有较大影响,仅影响程度的变幅显著不同。以物种出现概率P>50%为界,12月的降水量需求很低,变幅很小,超过此区间即对物种的适生程度产生明显影响,而9月降水量允许值较高,变幅也较宽。另外,年温度变幅在23—35℃之间,海拔范围在2000—4500 m时,物种的出现概率也较大(P>50%)。上述6项环境因子所占权重的总和达79.2%,但各因子影响权重值较为平均(最高20.2%,最低9.2%),没有某一单因子占有显著优势,说明各环境因子的综合作用,决定了亚属的现有分布格局。采用ROC曲线对模型精度进行评价,分析得到的AUC值为0.926,比较该模型在其他物种上的分布预测精度,表明其在弧隔鼠尾草亚属中的预测结果也具有高的精度[22,26,28- 29]。
3 结论与讨论
弧隔鼠尾草亚属的一个显著特征是狭域分布的特有种比例非常高,占到了总物种的近50%,这与其分布核心区位于横断山密不可分,该区域具备热带、亚热带至高山寒带各类植被类型,垂直分带明显,生境多样,利于促进植物的分化,也是中国植物多样性热点地区之一[30];从亚属潜在适生区分布的特点也可以看出(图5),物种出现概率较高的区域集中在横断山、藏东南和川西的较狭小地带,其走向与区域的山脉走向吻合,分布的海拔高度集中在2000—4000 m,超过高海拔的树线以上[31],物种出现概率大大降低。

图6 影响弧隔鼠尾草亚属地理分布的主导环境因子与其出现概率的关系Fig.6 Relationship of each dominant climatic factor and occurrence probability of subg. Salvia
从亚属内亚组一级水平分析,弧隔鼠尾草亚属中国原产只有宽球苏组,根据生活史分为多年生亚组和一年生亚组,它们的分布格局有较明显的差别(图1B,C)。多年生亚组的海拔分布范围 1200—4500 m,一年生亚组为 600—4600 m,生长的最低海拔更低,海拔垂直分布范围更广;一年生亚组水平分布区范围也较宽(北至甘肃中部,东至河北北部),多年生亚组则集中分布于西南地区,一年生亚组宽的生态幅可能是基于其较为进化的、适应性较强的生活史对策和生物学特性。组内6个系呈现海拔替代性分布规律,各系物种的垂直生态幅逐渐增加,暗示各系物种可能在进化迁移过程中,逐渐从高海拔集中分布向东部、北部低海拔地区扩散与迁移,形成各自现有的垂直分布格局。
基于Maxent模型模拟弧隔鼠尾草亚属物种的潜在分布,筛选出影响亚属物种分布的主导环境因子,提出适宜亚属物种生长的环境条件是要有一定的海拔高度,适宜的年温度变化范围和9月份降水量,以及较低的12月份降水量(图6)。弧隔鼠尾草亚属物种是一类适应高山环境的植物类群,复杂多样的山地环境为亚属物种的生存和分化提供有利条件,在海拔范围2000—4500 m,物种的出现概率较大。年均温度的变化直接关系植物的生长发育,当年均温度变化范围较大时会缩短植物的年生长期,使其生长发育受阻,这可能是年温度变化范围(bio7)作为主要环境因子影响亚属物种分布的重要原因[27]。9月份在西南地区,天气渐凉,亚属植物进入秋季旺盛生长期,适当的降水有助于入冬前营养物质的积累,安全越冬。12月份处于休眠期,地上部分枯萎,所以对水分需求很少。我国东部地区海拔较低,气候闷热,伏秋易旱[32],往南处于南亚热带边缘,年温度变化范围变小,酷热、多雨[33];西部喜马拉雅山脉阻隔,西北干旱少雨[34],东北夏季炎热多雨,冬季寒冷干燥,年温度变化范围变大[35],都限制了亚属物种的扩散,这也可能是造成弧隔鼠尾草亚属物种现代分布格局的原因之一。
本研究选择699个分布点作为样本数用于构建Maxent模型,预测精度达到好的标准(AUC=0.926),说明模型预测结果与实际分布有很高的拟合度,能反映出弧隔鼠尾草亚属物种在我国的分布情况。利用GIS软件分析处理数据,使得实际物种的分布数据与环境数据在每栅格单元上相对应,与采用距离物种实际分布最近气象台站的气候资料代替物种实际分布点的气候资料研究物种分布与气候关系的方法相比[36- 37],能有效提高数据的准确性[38]。然而,Maxent模型反映的仅是物种的基础生态位,不可能取代实地考察的结果,而且我们目前的研究也无法涉及到所有影响亚属物种分布的因素。在实地调查中发现,弧隔鼠尾草亚属物种一般生长在生境适宜的林缘、疏林下,以及山谷和高山灌丛的路边,极易受到放牧、修路等人为活动的影响,再考虑到栖息地的坡度、坡向及土壤类型的多样性,未来还需考虑如何将这些环境变量带入模型做更深入系统的分析。
鼠尾草属雄蕊的分化是物种形成和多样性产生的关键因素[39],从亚组和系水平的分布格局结合雄蕊形态分析表明,生态幅较宽、分布区延伸至低海拔地区的一年生亚组、钟萼鼠尾草系与鄂西鼠尾草系,它们的雄蕊花丝均比药隔短或近等长,而分布区集中在西南高海拔地区的西藏鼠尾草系、毛地黄鼠尾草系和短冠鼠尾草系,其花丝明显长于药隔。笔者前文的研究表明,中国鼠尾草属雄蕊的进化方向表现在花丝逐渐变短而药隔逐渐延长,杠杆作用更趋明显,是雄蕊适应不同区系的昆虫传粉,提高授粉的有效性、稳定性和专一性的过程,其演化方向与不同类群的形成及物种扩散方向一致[8]。而在亚属内,亚组和各系之间的分布格局可能也有类似的趋势,一年生亚组、钟萼鼠尾草系和鄂西鼠尾草系分布区生态幅更宽,分布区更广,雄蕊结构更为进化,而多年生亚组、西藏鼠尾草系、毛地黄鼠尾草系和短冠鼠尾草系生态幅较窄,雄蕊结构也更为原始。鼠尾草属花器官尤其是雄蕊的发育是其演化的重要表现,本研究中也发现雄蕊的形态变化趋势与其分布格局有一定联系,这是否是鼠尾草属分布格局的内在重要因素,是值得进一步研究的问题。
Walker等人认为东亚是鼠尾草属的多样性中心之一,而这一分支内的物种分化与多样性形成机制却未可知[40- 41]。结合亚属分布格局、气候、形态学等几个方面分析,推测横断山区可能是东亚鼠尾草属物种辐射和多样性分化中心,在此由具备原始特征的弧隔鼠尾草亚属为基部类群,逐渐向东部低海拔地区迁移扩散,逐渐由亚属内形态原始的多年生、狭域分布类群,替代为形态较进化的一年生、宽域分布类群;属内则由弧隔鼠尾草亚属逐渐过渡为荔枝草亚属、鼠尾草亚属,其原始的雄蕊短药隔杠杆也过渡为进化的长药隔杠杆、退化杠杆传粉模式[40]。未来还需要更全面的材料收集、形态学分析和分子系统学研究,以阐明东亚分支的物种形成和多样性演化。另一方面,弧隔鼠尾草亚属比低海拔的其他类群具有更多类型的次生代谢产物[42],产生特有活性成分的机率比较高,因而需要更多关注与保护,从而合理利用其药用资源。
致谢: 马金双研究员对写作给予帮助,罗云峰、景鹏飞等参与数据录入、整理,刘欣雨协助绘图,特此致谢。
[1] Li H W, Hedge I C. Lamiaceae // Wu Z Y, Raven P H. Flora of China. Beijing: Science Press; St. Louis: Missouri Botanical Garden Press, 1994, 17: 50- 299.
[2] Hu G X, Liu Y, Xu W B, Liu E D.Salviapetrophilasp. nov. (Lamiaceae) from North Guangxi and South Guizhou, China. Nordic Journal of Botany, 2014, 32(2): 190- 195.
[3] 孙雄才, 黄咏琴. 鼠尾草属 // 中国科学院中国植物志编辑委员会. 中国植物志. 北京: 科学出版社, 1977, 66: 70- 196.
[4] 李旻辉, 宋晓玲, 王振旺, 张娜, 肖培根. 中国鼠尾草属植物传统药物学的调查. 时珍国医国药, 2011, 22(2): 476- 479.
[5] Wu Y B, Ni Z Y, Shi Q W, Dong M, Kiyota H, Gu Y C, Cong B. Constituents fromSalviaspecies and their biological activities. Chemical Reviews, 2012, 112(11): 5967- 6026.
[6] 吴文林, 张利, 杨在君, 杨瑞武, 丁春邦, 周永红. 四川鼠尾草属植物濒危等级和优先保护级别研究. 浙江大学学报: 农业与生命科学版, 2011, 37(2): 162- 168.
[7] 王涛, 王龙, 杨在君, 张利. 川西地区鼠尾草属植物资源调查与引种研究. 园艺学报, 2012, 39(12): 2507- 2514.
[8] 黄艳波, 魏宇昆, 葛斌杰, 王琦. 鼠尾草属东亚分支的传粉模式. 生态学报, 2014, 34(9): 2282- 2289.
[9] 张勃, 孙杉, 方强恩, 白小明. 鼠尾草属不同物种的雄蕊杠杆机制对传粉者空间变异的进化响应. 植物生态学报, 2012, 36(7): 681- 689.
[10] Zhang B, Claßen-Bockhoff R, Zhang Z Q, Sun S, Luo Y J, Li Q J. Functional implications of the staminal lever mechanism inSalviacyclostegia(Lamiaceae). Annals of Botany, 2011, 107(4): 621- 628.
[11] Ohashi K. Consequences of floral complexity for bumblebee-mediated geitonogamous self-pollination inSalvianipponicaMiq. (Labiatae). Evolution, 2002, 56(12): 2414- 2423.
[12] 张利, 杨在君, 黄霞, 李进, 万德光. 丹参及四川鼠尾草属植物叶表皮微形态研究. 四川大学学报: 自然科学版, 2008, 45(3): 674- 680.
[13] Han J P, Liu C, Li M H, Shi L C, Song J Y, Yao H, Pang X H, Chen S L. Relationship between DNA barcoding and chemical classification ofSalviamedicinal herbs. Chinese Herbal Medicines, 2010, 2(1): 16- 29.
[14] Li Q Q, Li M H, Yuan Q J, Cui Z H, Huang L Q, Xiao P G. Phylogenetic relationships ofSalvia(Lamiaceae) in China: Evidence from DNA sequence datasets. Journal of Systematics and Evolution, 2013, 51(2): 184- 195.
[15] 杨珊, 王萌, 杨在君, 张利. 四川鼠尾草属植物的数量分类. 四川农业大学学报, 2010, 28(3): 371- 375.
[16] 黄秀兰, 杨保津, 胡之璧. 鼠尾草属植物的二萜醌类化合物和它在分类上的意义. 植物分类学报, 1981, 19(4): 421- 433.
[17] 王利松, 陈彬, 纪力强, 马克平. 生物多样性信息学研究进展. 生物多样性, 2010, 18(5): 429- 443.
[18] Bentham G. Labiatae // Bentham G, Hooker J D. Genera Plantarum. London: Reeve and Co, 1876, 2: 1160- 1223.
[19] Stibal E P. A revision of Chinese and East Burmese species ofSalvia. Acta Horticulturae Gotoburgensis, 1934, 9: 101- 165.
[20] 吴征镒. 附录 // 中国科学院中国植物志编辑委员会. 中国植物志. 北京: 科学出版社, 1977, 66: 580- 585.
[21] 李锡文. 唇形科 // 吴征镒. 西藏植物志. 北京: 科学出版社, 1985, 4: 98- 224.
[22] 殷晓洁, 周广胜, 隋兴华, 何奇瑾, 李荣平. 蒙古栎地理分布的主导气候因子及其阈值. 生态学报, 2013, 33(1): 103- 109.
[23] 何奇瑾, 周广胜. 我国春玉米潜在种植分布区的气候适宜性. 生态学报, 2012, 32(12): 3931- 3939.
[24] 李明阳, 巨云为, Kumar S, Stohlgren T J. 美国大陆外来入侵物种斑马纹贻贝(Dreissenapolymorpha)潜在生境预测模型. 生态学报, 2008, 28(9): 4253- 4258.
[25] Phillips S J, Anderson R P, Schapire R E. Maximum entropy modeling of species geographic distributions. Ecological Modelling, 2006, 190(3/4): 231- 259.
[26] Zhu G P, Bu W J, Gao Y B, Liu G Q. Potential geographic distribution of brown marmorated stink bug invasion (Halyomorphahalys). PLoS ONE, 2012, 7(2): e31246.
[27] 龚晔, 景鹏飞, 魏宇昆, 黄卫昌, 崔浪军. 中国珍稀药用植物白及的潜在分布与其气候特征. 植物分类与资源学报, 2014, 36(2): 237- 244.
[28] Slater H, Michael E. Predicting the current and future potential distributions of lymphatic filariasis in Africa using maximum entropy ecological niche modelling. PloS ONE, 2012, 7(2): e32202.
[29] Nabout J C, Soares T N, Diniz-Filho J A F, De Marco J P, Telles M P C, Naves R V, Chaves L J. Combining multiple models to predict the geographical distribution of the Baru tree (DipteryxalataVogel) in the Brazilian Cerrado. Brazilian Journal of Biology, 2010, 70(4): 911- 919.
[30] 应俊生. 中国种子植物物种多样性及其分布格局. 生物多样性, 2001, 9(4): 393- 398.
[31] 张大才, 孙航. 横断山区树线以上区域种子植物的标本分布与物种丰富度. 生物多样性, 2008, 16(4): 381- 388.
[32] 简慰民, 沈雪芳, 刘晓清. 我国亚热带东部丘陵山区农业气象灾害与减灾对策. 湖南师范大学自然科学学报, 1992, 15(1): 84-88.
[33] 张克映. 滇南气候的特征及其形成因子的初步分析. 气象学报, 1963, 33(2): 218- 230.
[34] 黄蕊, 徐利岗, 刘俊民. 中国西北干旱区气温时空变化特征. 生态学报, 2013, 33(13): 4078- 4089.
[35] 贺伟, 布仁仓, 熊在平, 胡远满. 1961—2005年东北地区气温和降水变化趋势. 生态学报, 2013, 33(2): 519- 531.
[36] 洪必恭, 李绍珠. 江苏主要常绿阔叶树种的分布与热量关系的初步研究. 生态学报, 1981, 1(2): 105- 111.
[37] 倪健, 宋永昌. 中国青冈的地理分布与气候的关系. 植物学报, 1997, 39(5): 451- 460.
[38] 段居琦, 周广胜. 中国水稻潜在分布及其气候特征. 生态学报, 2011, 31(22): 6659- 6668.
[39] Claßen-Bockhoff R, Speck T, Tweraser E, Wester P, Thimm S, Reith M. The staminal lever mechanism inSalviaL. (Lamiaceae): a key innovation for adaptive radiation? Organism, Diversity & Evolution, 2004, 4(3): 189- 205.
[40] Walker J B, Sytsma K J, Treutlein J, Wink M.Salvia(Lamiaceae) is not monophyletic: implications for the systematics, radiation, and ecological specializations ofSalviaand tribe Mentheae. American Journal of Botany, 2004, 91(7): 1115- 1125.
[41] Walker J B, Sytsma K J. Staminal evolution in the genusSalvia(Lamiaceae): molecular phylogenetic evidence for multiple origins of the staminal lever. Annals of Botany, 2007, 100(2): 375- 391.
[42] Qiao X, Zhang Y T, Ye M, Wang B R, Han J, Guo D A. Analysis of chemical constituents and taxonomic similarity ofSalviaspecies in China using LC/MS. Planta Medica, 2009, 75(15): 1613- 1617.
Research on distribution pattern of Subg.SalviaBenth. (Lamiaceae), an important group of medicinal plants in East Asia
WANG Qi, WEI Yukun*, HUANG Yanbo
ShanghaiChenshanBotanicalGarden,ShanghaiChenshanPlantScienceResearchCenter,ChineseAcademyofSciences,Shanghai201602,China
The Subg.SalviaBenth. is the largest subgenus in theSalviaLinn. and is native to China. Most of the 44 species and 13 varieties in the subgenus contain active compounds and have medicinal effects similar to that ofSalviamiltiorrhiza, and thus serves as a wild resource with relatively high prospects as medicinal plants. Morphological investigation shows that Subg.Salviaexhibits the original characteristics of theSalviaas well as notable species differentiation, and so it is an important group for studying the origin and evolution of theSalvia. Geographically, this subgenus is mainly distributed in higher elevation areas in the Tibetan Plateau and Hengduan Mountains, nevertheless a few extending to central and east China. Hence, intense pressure exists to protect this resource due to the subgenus is vulnerable to environmental, global climate change and disturbance of human activities. Based on aforementioned factors and combined with specimen records, documented 2689 species distribution records with latitude and longitude information, and 1007 records with elevation information, covering 286 county-level regions, a comprehensive survey of Subg.Salviawas conducted and their distribution map was plotted. Furthermore, their distribution pattern was analyzed on the level and vertical dimensions at the different sections and series in the subgenus. The potential distribution regions with Subg.Salviawere predicted using maximum entropy ecological niche modelling (Maxent). In addition, dominant climatic factors affecting its present distribution were confirmed. The results showed that the Hengduan Mountains serves as the diversity center of this subgenus; its distribution range is from southeastern Tibet to western Sichuan, rarely spreading to northern Hebei and eastern Hubei. In this subgenus, narrow-ranging endemic species have a very high proportion (45% of all species). In addition, the six series within the subgenus show a vicarious distribution as related to elevation, gradual transitioning from the narrow-ranging species of high elevation to wide-ranging species of low elevation. The subgenus potential distribution obtained based on a maximum entropy model was mostly consistent with the actual distribution of the species. Regarding the relationship between single climatic factors and probability of occurrence, the amount of precipitation of September and December, the temperature annual range, altitude, maximum temperature of March and temperature seasonality are the dominant climate factors influencing species distribution. In view of a key innovation forSalviaspeciation, stamen differentiation was investigated in this study. The results showed that the filament to connective ratios of the stamen of Subsect.Annuae, Ser.Campanulataeand Ser.Maximowiczianae, of which the distributions spread to low-elevation areas, are far smaller than Ser.Hiantes, Ser.Digitaloiditesand Ser.Brachylomae, of which the distributions are concentrated in high-elevation areas in the southwest; thus the former may be more evolutionary advanced than the latter. Environmental and climatic factors and pollinator choice may together determine the current distribution pattern of the Subg.Salvia.
Subg.SalviaBenth.; Sect.EurysphaceStib.; distribution pattern; climate factors; maximum entropy model; pollinator choice
附表 1 标本馆及代码Appendix 1 Herbarium and code
附表 2 68项环境变量Appendix 2 Meaning of 68 environment variables
上海市绿化和市容管理局资助项目(G092404, F132423)
2013- 04- 04;
日期:2014- 10- 23
10.5846/stxb201404040642
*通讯作者Corresponding author.E-mail: ykwei@sibs.ac.cn
王琦, 魏宇昆, 黄艳波.中国弧隔鼠尾草亚属(唇形科)的分布格局.生态学报,2015,35(5):1470- 1479.
Wang Q, Wei Y K, Huang Y B.Research on distribution pattern of Subg.SalviaBenth. (Lamiaceae), an important group of medicinal plants in East Asia.Acta Ecologica Sinica,2015,35(5):1470- 1479.

