肾脏纤维化大鼠外周血纤维细胞计数变化及意义
党艳梅,李新建,张少青,曲小菡,魏明明,张昆(济宁医学院附属医院,山东济宁272029)
肾脏纤维化大鼠外周血纤维细胞计数变化及意义
党艳梅,李新建,张少青,曲小菡,魏明明,张昆(济宁医学院附属医院,山东济宁272029)
摘要:目的通过流式细胞仪对5/6肾切除大鼠外周血中的纤维细胞计数变化,观察外周血纤维细胞数量与肾脏纤维化程度之间的关系,探讨外周血纤维细胞作为肾纤维化早期生物学标志物的可行性。方法清洁级雄性SD大鼠10只,随机分为对照组(n=4)和模型组(n=6)。模型组5/6肾切除制作肾脏纤维化模型,对照组只剥离肾包膜,不切除肾实质。以CD45和Ⅰ型胶原作为循环纤维细胞的表面标记,使用流式细胞仪对两组大鼠外周血纤维细胞计数;结合肾功能生化指标及肾脏病理学改变,分析循环纤维细胞计数在肾纤维化中的意义。结果造模后第4、8、12周,模型组肾小球积分、肾小管间质积分、血清肌酐、尿素氮均高于对照组(P均<0.01)。模型组在造模后的第4、8、12周,外周血纤维细胞计数显著升高,高于对照组(P均<0.01)。外周血纤维细胞计数与血清肌酐、尿素氮呈正相关(r分别为0.623、0.550,P均<0.05)。结论外周血纤维细胞计数在肾纤维化早期与肾脏病理改变一致,可早期预示肾纤维化的发展进程。
关键词:循环纤维细胞;慢性肾功能衰竭;肾脏纤维化;大鼠
研究表明,纤维细胞参与了多个脏器的纤维化,介导诸如肾纤维化、肺脏纤维化、支气管哮喘、皮肤创伤以及内膜增生等多种病理过程[1~5]。研究和寻找防治肾纤维化的新靶标以及给予适时治疗方略对进一步改善慢性肾脏病(CKD)的预后至关重要。因此,我们通过对外周血纤维细胞计数,观察循环中纤维细胞数量与肾脏纤维化之间的关系,探讨外周血循环纤维细胞作为肾纤维化早期生物学标志物的可行性。
1材料与方法
1.1材料
1.1.1实验动物6~8周龄,体质量(200±20)g清洁级雄性SD大鼠10只,随机分为对照组(n=4)和模型组(n=6)。
1.1.2设备与试剂抗CD45-PE抗体(554878,BD),兔多克隆Ⅰ型胶原抗体(ab292,Abcam),FITC标记的山羊抗兔抗体(A0562,碧云天),淋巴细胞分离液(BV903200,上海拜沃);DMEM培养液(11965-092,Gibco);BD FACSCanto Ⅱ流式细胞仪。
1.2方法
1.2.1肾脏纤维化模型制备方法用10%水合氯醛腹腔麻醉,行左背旁正中纵切口,暴露左侧肾脏,分离肾包膜,夹闭左肾蒂,剪掉左肾上下各1/3肾实质,明胶海绵止血后残肾还纳入腹腔,逐层缝合,消毒。1周后切去右肾,即制备成5/6肾切除残肾模型。对照组只剥离肾包膜,不切除肾实质。
1.2.2标本的留取方法对照组和模型组大鼠分别在手术后第4、8、12周留取外周血进行生化指标的检测,留取肾脏组织标本用于肾脏病理染色。同时留取部分抗凝血进行纤维细胞计数的前期处理:肝素抗凝全血1 mL与等体积生理盐水混合,缓慢加入含2 mL淋巴细胞分离液的离心管中,保持两液面分界清晰,室温下离心2 000 r/min×20 min。离心后,管内液体分为3层,吸取中间淋巴细胞层约2 mL移入新的离心管中,加入10 mL生理盐水,混匀后离心1 000 r/min×10 min。弃上清,加入1 mL细胞冻存液重悬细胞沉淀,转移至1.5 mL无菌冻存管中,-80 ℃冻存1 d再转入液氮中保存,在标本收集完成后统一检测。
1.2.3外周血纤维细胞计数方法取出冻存的白细胞样本在37 ℃水浴中快速复融,1 500 r/min离心5 min,使用生理盐水洗涤1次,并用预冷的生理盐水重悬细胞沉淀并分装至1.5 mL EP管中。加入抗大鼠CD45-PE抗体,室温孵育30 min。细胞经过透化处理后加入100 μL生理盐水洗涤2次。然后分别加入兔抗大鼠Col Ⅰ抗体,室温孵育30 min并洗涤2次。最后FITC荧光染料标记的兔二抗孵育,室温30 min。细胞洗涤2次,用1%多聚甲醛溶液固定,上流式细胞仪分析。以CD45和Col Ⅰ作为循环纤维细胞的表面标记,通过流式细胞仪对CD+45、Col Ⅰ+双阳性的外周血白细胞进行计数,结果以CD+45/Col Ⅰ+双阳性细胞占白细胞总数的百分比表示[6]。
1.2.4肾脏功能及病理评分方法取术后第4、8、12周留取的外周血,检测Sor、BUN。参考Gadola等[7]所述方法,在光镜下对肾脏病理进行半定量积分。肾小球的硬化程度积分:0分(正常肾小球);1分(系膜区扩张或硬化面积<25%);2分(硬化面积25%~50%);3分(硬化面积50%~75%);4分(硬化面积>75%),每个标本400倍光镜下观察20个肾小球,求平均数作为肾小球硬化指数。肾小管间质积分:根据肾小管萎缩、管型、间质炎症和纤维化的范围,分别给0~3分:0分(无小管间质损害);1分(病变范围<25%);2分(病变范围25%~50%);3分(病变范围>50%)。在100倍光镜下,每个标本观察10个视野,求平均数作为肾间质小管病变指数。

2结果
2.1肾组织病理学改变对照组大鼠第4、8、12周肾小球、肾小管、间质及血管无明显改变。随着造模时间延长,模型组大鼠肾小球系膜细胞增生,系膜基质增多,肾小球包曼囊壁增厚或分层,部分可见壁层上皮细胞增生及球囊粘连,部分肾小球节段性或球性硬化;肾小管萎缩或代偿性扩张,部分出现颗粒变性及空泡变性;肾间质增宽,可见大量灶性炎症细胞浸润及灶性纤维化。见插页Ⅰ图2。模型组的肾小球积分、肾小管间质积分均显著高于对照组(P均<0.01)。见表1。
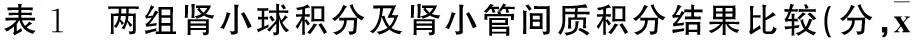
±s)
注:与同周龄对照组比较,#P<0.05,*P<0.01。
2.2血生化检测结果见表2。
2.3外周血循环纤维细胞计数见表3。
2.4外周血纤维细胞计数与肾纤维化的关系将模型组大鼠循环纤维细胞与Scr、BUN及肾脏病理积分做相关性分析显示,循环纤维细胞与Scr、BUN及肾脏病理积分均呈正相关(r分别为0.623、0.550、0.613,P分别<0.01、0.05、0.01)。
3讨论
循环纤维细胞具有类似于成纤维细胞的功能如分泌胶原蛋白和其他基质蛋白,同时还表达造血细胞的表面标记如CD34、CD45、MHC Ⅱ类分子等。因此,鉴别循环纤维细胞的基本标准是同时具有胶原生成和血源细胞标记。当前比较成熟的鉴定循环纤维细胞的标记分子有CD34、CD45、Col Ⅰ等[8,9]。循环纤维细胞可以通过多个炎症/免疫反应机制,如抗原表达、分泌细胞因子和趋化因子、产生基质金属蛋白酶等参与组织纤维化过程[10]。CCL2/CCR2信号转导通路是其发挥作用的一个重要途径[11]。目前已多项研究证实,循环纤维细胞数量与特发性肺炎、移植肾病变程度相关[12,13]。
肾纤维化的特点是细胞外基质成分过度累积,包括Ⅰ、Ⅲ、Ⅳ型胶原,糖蛋白和纤维连接蛋白等[14]。关于肾脏基质细胞的来源有如下几种可能:①肾脏固有间质成纤维细胞被激活;②肾小管上皮细胞的上皮间质转化(EMT);③来自血液循环中的纤维细胞浸润[15]。纤维细胞在肾纤维化中的详细作用机制尚不清楚,但既往研究证实纤维细胞确实参与了肾纤维化进程中[16]。Sakai等[17]研究表明,在输尿管结扎小鼠进展性肾纤维化模型中,肾间质可见CD45和Ⅰ型胶原双阳性的纤维细胞浸润,皮髓交界区尤为明显。
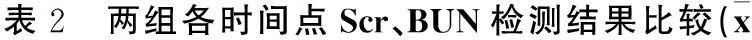
±s)
注:与同周龄对照组比较,*P<0.01。

±s)
注:与同周龄对照组比较,*P均<0.01。
肾活检病理检查是确定肾脏损伤的金标准,但由于其创伤性较大,并对操作技术有较高要求。因此,寻找更简便的、适用于临床的肾纤维化生物学标志物,对肾纤维化早期监测以及给予适时治疗方略进一步改善慢性肾脏病的预后至关重要。本研究以外周血循环纤维细胞作为潜在的生物学标志物,通过5/6肾切除大鼠肾衰模型,比较外周血纤维细胞计数的变化及与肾脏病理、血生化指标的关系,结果显示,模型组大鼠外周血循环纤维细胞随着肾脏损害的加重而逐渐增加,且与肾脏纤维化程度及血肌酐水平呈正相关,提示其可作为肾纤维化早期的生物学标志物指标。
参考文献:
[1] Collins AJ, Couser WG, Dirks JH, et al. World Kidney Day: an idea whose time has come[J]. Kidney Int, 2006,69(5):781.
[2] Quan TE, Cowper S, Wu SP, et al. Circulating fibrocytes: collagen-secreting cells of the peripheral blood[J]. Int J Biochem Cell Biol, 2004,36(4):598-606.
[3] Reese C, Lee R, Bonner M, et al. Fibrocytes in the fibrotic lung: altered phenotype detected by flow cytometry[J]. Front Pharmacol, 2014,5:141.
[4] Li J, Tan H, Wang X, et al. Circulating fibrocytes stabilize blood vessels during angiogenesis in a paracrine manner[J]. Am J Pathol, 2014,184(2):556-571.
[5] Wada T, Sakai N, Sakai Y, et al. Involvement of bone-marrow-derived cells in kidney fibrosis[J]. Clin Exp Nephrol, 2011,15(1):8-13.
[6] Moeller A, Gilpin SE, Ask K, et al. Circulating fibrocytes are an indicator of poor prognosis in idiopathic pulmonary fibrosis[J]. Am J Respir Crit Care Med, 2009,179(7):588-594.
[7] Gadola L, Noboa O, Márquez MN, et al. Calcium citrate ameliorates the progression of chronic renal injury[J]. Kidney Int, 2004,65(4):1224-1230.
[8] Suga H, Rennert RC, Rodrigues M, et al. Tracking the elusive fibrocyte: identification and characterization of collagen-producing hematopoietic lineage cells during murine wound healing[J]. Stem Cells, 2014,32(5):1347-1360.
[9] 李亚东,牛建昭,王继峰,等.人循环纤维细胞的分离和鉴定[J].解剖学报,2007,38(2):168-172.
[10] Galligan CL, Fish EN. The role of circulating fibrocytes in inflammation and autoimmunity[J]. J Leukoc Biol, 2013,93(1):45-50.
[11] Hara A, Sakai N, Furuichi K, et al. CCL2/CCR2 augments the production of transforming growth factor-beta1, type 1 collagen and CCL2 by human CD45-/collagen 1-positive cells under high glucose concentrations[J]. Clin Exp Nephrol, 2013,17(6):793-804.
[12] Kimura S, Asaka M, Atsumi H, et al. Circulating fibrocytes in ischemia-reperfusion injury and chronic renal allograft fibrosis[J]. Nephron Clin Pract, 2012,121(1-2):16-24.
[13] Yeager ME, Nguyen CM, Belchenko DD, et al. Circulating fibrocytes are increased in children and young adults with pulmonary hypertension[J]. Eur Respir J, 2012,39(1):104-111.
[14] Nelson PJ. The contentious ontogeny of fibrosis in the kidney[J]. Kidney Int, 2013,84(1):14-15.
[15] Barnes JL, Glass WF 2nd. Renal interstitial fibrosis: a critical evaluation of the origin of myofibroblasts[J]. Contrib Nephrol, 2011,169:73-93.
[16] He J, Xu Y, Koya D, et al. Role of the endothelial-to-mesenchymal transition in renal fibrosis of chronic kidney disease[J]. Clin Exp Nephrol, 2013,17(4):488-497.
[17] Sakai N, Wada T, Yokoyama H, et al. Secondary lymphoid tissue chemokine (SLC/CCL21) /CCR7 signaling regulates fibrocytes in renal fibrosis[J]. Proc Natl Acad Sci USA, 2006,103(38):14098-14103.
Significance of peripheral blood fibrocytes counting to renal fibrosis rats
DANGYan-mei,LIXin-jian,ZHANGShao-qing,QUXiao-han,WEIMing-ming,ZHANGKun
(AffiliatedHospitalofJiningMedicalCollege,Jining272029,China)
Abstract:ObjectiveTo discuss the significance of peripheral blood fibrocytes counting to renal fibrosis rats with 5/6 kidney cut. MethodsCD45and type I collagen were as the circulation fibrocytes surface markers; the flow cytometer was used to count the peripheral blood fibrocytes of rats with 5/6 kidney cut; biochemical indexes of renal function and the pathological alteration in kidney were measured. ResultsFor the model group of rats with renal failure, in 4, 8 and 12 weeks after modeling, the peripheral blood fibrocytes counting increased significantly compared with the control group (allP<0.01). The blood fibrocytes counting was positively correlated with renal pathology changes, Scr and BUN (P<0.05 orP<0.01). ConclusionThe peripheral blood fibrocytes counting is positively correlated with renal pathology changes in early renal fibrosis, which can indicate early the development process of renal fibrosis.
Key words:circulating fibrocytes; chronic renal failure; renal fibrosis; rat
(收稿日期:2014-11-06)
中图分类号:R692.5
文献标志码:A
文章编号:1002-266X(2015)04-0021-03
doi:10.3969/j.issn.1002-266X.2015.04.007
作者简介:第一党艳梅(1963-),女,硕士研究生导师,主任医师,教授,肾内科副主任,研究方向为肾纤维化的早期诊断及治疗。E-mail: dangyanmei@126.com
基金项目:山东省自然科学基金资助项目(ZR2011HL017)。

