呕吐毒素对断奶仔猪外周血液中C D 4+、C D 8+淋巴细胞及抗氧化水平的影响
姬长云,程汉奎,张静洁,邓 超,钟佳莲,李维铖,邓衔柏
(华南农业大学兽医学院,广东 广州510642)
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)又称作呕吐毒素(vomitoxin,VT),属于单端孢霉烯族化合物,是全世界饲料和粮食污染的主要真菌毒素之一[1-2]。随着对呕吐毒素的深入研究,发现DON 对动物和人都会产生免疫抑制作用。它可剂量依赖地诱导并促进小鼠胸腺细胞的凋亡和抑制其增殖,从而对小鼠的免疫功能产生一定的负面影响[3-4]。还可以影响小鼠肠黏膜的生理屏障功能,干扰机体蛋白质的合成,造成免疫系统抑制等[5]。
在动物免疫学研究中,经常需要了解外周血中淋巴细胞的分类及含量情况。根据来源和功能的不同,淋巴细胞可分为T 淋巴细胞、B 淋巴细胞、NK 细胞等几大类[6],T 细胞又分为CD4+、CD8+细胞亚群。CD4+细胞协助B 淋巴细胞产生抗体,CD8+和CD4+能通过清除体内被病毒感染的细胞或分泌具有抗病毒特性的细胞因子产生保护性免疫[7]。且CD4+/CD8+的比值可反映动物体疾病的发展历程,所以准确地测定外周血中CD4+、CD8+细胞数量就显得尤其重要[8]。正常生理状态下,机体氧自由基的生成(氧化系统)和清除(抗氧化系统)存在一种动态平衡。病理因素和外源有毒有害物质会打破这种平衡,使自由基积累,造成机体氧化功能损伤。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽-S-转移酶(GST)、谷胱甘肽还原酶(GR)是机体抗氧化系统的重要组成部分,在清除体内氧自由基,缓解氧化损伤方面发挥着重要作用。
本试验通过研究呕吐毒素对仔猪外周血液中CD4+、CD8+淋巴细胞亚群及血清中CAT、GSH-Px、SOD、MDA 活性的影响,揭示了实际生产中断奶仔猪在误食霉变饲料后,机体的细胞免疫及抗氧化功能遭受损伤所经历的过程,便于猪只在中毒前期未表现中毒症状时就提早采取措施,防治疾病的发生,也为实验室诊断和建立猪场健康体检系统提供理论依据。
1 材料与方法
1.1 DON污染饲粮的准备 准确称取一定量的DON标准品(Sigma 公司,批号:097K4010),溶解于适量生理盐水中配成一定浓度的溶液。将基础饲粮平铺于地面上,厚度适中,然后将配制好的DON 溶液喷洒于基础饲粮上,搅拌,混匀。处理过程中保持底物含水量均匀且在20%左右,温度约28 ℃,处理7 d。将处理好的饲粮与未处理的基础饲粮按1∶1混合均匀。本试验周期为38 d,先后共处理饲料5次,每次每组取样2 份装入洁净的密闭塑料袋,标记,-20 ℃保存,用于测定DON 含量(处理后的饲粮中DON 浓度为2 mg/kg)。
1.2 试验设计 10 头25 日龄平均体重为(7.70±1.00)kg 的杜×大×长三元杂交断奶仔猪,打耳号,做好标记,随机分为两组,分别进行基础饲粮饲喂(对照组)、基础饲粮+DON 饲喂(试验组)。试验前适应性饲养7 d,正式试验期为38 d。仔猪在同一猪舍内饲养,自由采食和饮水,每天饲喂2 次(早上8:00 和下午17:00)、清圈2 次,观察仔猪采食和健康状况。分别在试验第0、8、16、24 天采血检测CD4+、CD8+淋巴细胞水平,在0、16、24、36 天采血检测血清CAT、GSH-Px、SOD、MDA 的活性。
1.3 淋巴细胞亚群的测定 (1)取2 mL 新鲜抗凝血,与中性PBS 1∶1 混匀后慢慢加人等体积本分离液之液面上;(2)以400 g(约1 500 r/min)离心(水平转子)15 min。此时离心管中由上至下细胞分4 层。第1 层为血浆层,第2 层为环状乳白色淋巴细胞层,第3 层为透明的分离液层,第四层为红细胞层。收集第二层细胞放入含中性PBS 洗涤液1mL 的试管中,充分混匀后,以500 g 约(1 800 r/min)离心20 min,弃去上清留沉淀细胞重新悬起,重复洗涤2 次即得所需淋巴细胞,所有操作均按试剂盒说明书进行。用流式细胞仪检测淋巴细胞(美国BD 公司,FACS420 型)。
1.4 血清CAT、GSH-Px、SOD、MDA 活性的测定
分别在试验第0、16、24、36 天颈静脉采血,静置30 min,离心,保留血清用来检测抗氧化指标。所用试剂盒为南京建成生物工程研究所测指标分别为谷胱甘肽-过氧化物酶(GSH-Px),过氧化氢酶(CAT),超氧化物歧化酶(SOD),丙二醛(MAD)的活性,所有指标均按照试剂盒说明书进行操作。
1.5 统计分析 试验数据采用SPSS 17.0 软件进行单因素方差分析和Duncan 氏法进行各组间多重比较,以P<0.05 作为差异性显著判断标准。试验数据以平均值±标准误表示。
2 结果与分析
2.1 CD4+、CD8+淋巴细胞亚群检测结果 由表1和图1 可知,与对照组相比DON 组CD4+、CD8+、CD4+/CD8+无明显变化,差异性不显著。且试验组和对照组数据变化趋势基本一致。
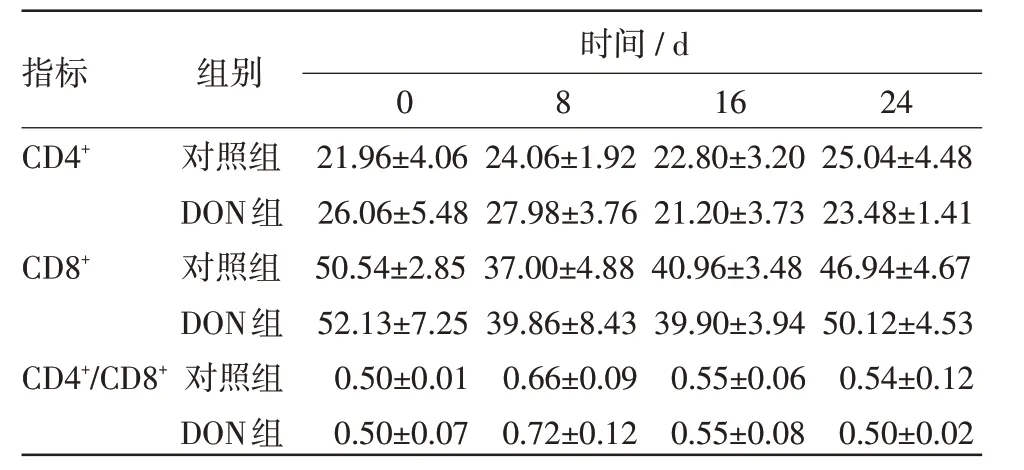
表1 淋巴细胞检测结果
2.2 血清CAT、GSH-Px、SOD、MDA 由表2 可见,与对照组相比,在试验第24 天和36 天SOD 的活性显著降低,差异极显著(P<0.01);在试验第16 天MDA 的活性显著降低,差异显著(P<0.05);在试验第16 天CAT 活性显著降低,差异显著(P<0.05),第24、36 天MDA 差异极显著(P<0.01);在试验第24、36 天,GSH-Px 活性显著降低。随着时间的增加试验组和对照组的SOD 活性逐渐降低,MDA 活性逐渐升高;CAT 指标变化为对照组先降低在第36 天升高,试验组为逐渐降低;GSH-Px 指标变化为对照组和试验组都在第24 天升高然后又降低。
3 结论与讨论
3.1 DON 对CD4+、CD8+淋巴细胞的影响 T 淋巴细胞是外周血液中的主要淋巴细胞(约占80%~90%),是机体发挥细胞免疫和免疫调节作用的主要成分,并能对B 淋巴细胞分泌免疫球蛋白的过程进行调控。 T 细胞具有多种生物学功能,如直接杀伤靶细胞,辅助或抑制B 细胞产生抗体,对特异性抗原和促有丝分裂原的应答反应以及产生细胞因子等都能起到一定的作用[9-10]。成熟的T 淋巴细胞表面均可表达CD3+分子,而CD4+、CD8+分子不能同时表达于同一成熟的T 淋巴细胞表面,故可将成熟的T 淋巴细胞分为CD4+淋巴细胞和CD8+淋巴细胞两个亚群。这两种细胞对免疫反应和维持免疫稳定起重要作用,机体细胞免疫功能正常时,CD4+/CD8+处于恒定范围,若其平衡失调,则会导致机体免疫功能紊乱,产生一系列免疫病理变化,影响机体的免疫保护机制,引起一系列免疫缺陷疾病或自身免疫病[11-12],CD4+/CD8+比值降低是疾病程度变重的主要标志之一[13],也提示患者机体处于免疫抑制状态[14]。实验室可通过检测CD4+、CD8+淋巴细胞亚群的百分率和CD4+/CD8+比值作为评价机体免疫状况高低的依据。本试验结果显示,试验组与对照组相比,CD4+、CD8+淋巴细胞亚群的百分率以及CD4+/CD8+比值未出现明显差异,但数值较正常的比值要低,说明试验组对断奶仔猪的淋巴细胞平衡产生一定的影响但不明显,可能是DON 含量剂量低,仔猪的免疫系统对DON 有一定的耐受性。试验揭示了低剂量DON 对仔猪外周血液中CD4+、CD8+、CD4+/CD8+的平衡影响非常小,在感染毒素时间不久的情况下对仔猪的外周免疫系统产生较小的毒害作用。
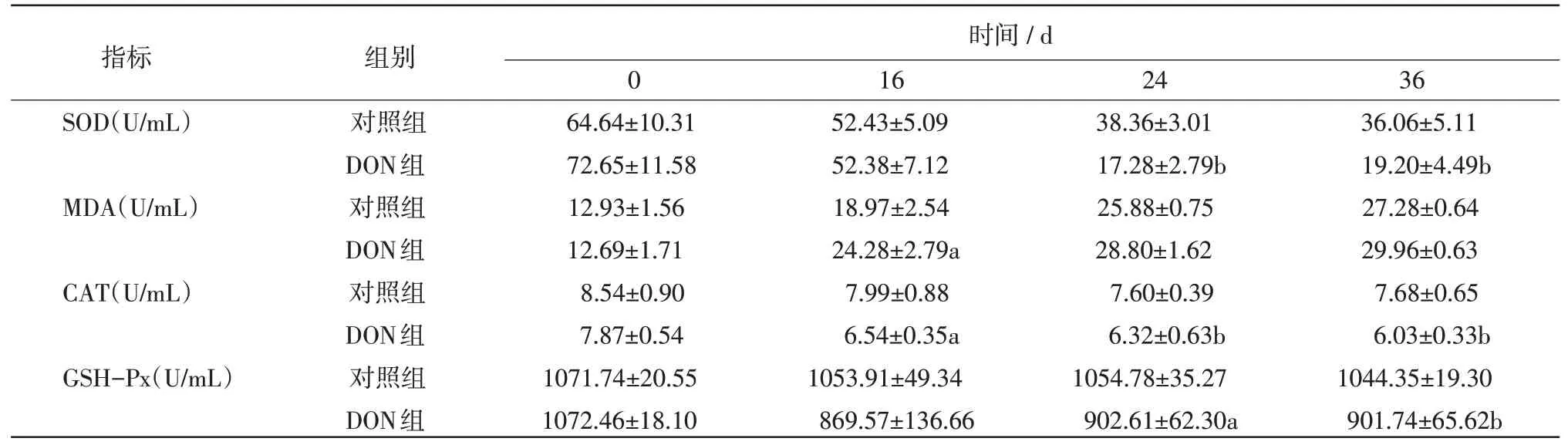
表2 酶活性检测结果
图1 淋巴细胞检测结果
3.2 DON 对血清中CAT、GSH-Px、SOD、MDA 的影响 CAT、GSH-Px、SOD、MDA 都是反应机体抗氧化水平的重要指标,正常生理状态下,机体氧自由基的生成(氧化系统)和清除(抗氧化系统)存在一种动态平衡。病理因素和外源有毒有害物质会打破这种平衡,使自由基积累,造成机体氧化损伤。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽-S-转移酶(GST)、谷胱甘肽还原酶(GR)是机体抗氧化系统的重要组成部分,在清除体内氧自由基,缓解氧化损伤方面发挥着重要作用。饲粮中添加自然霉变玉米可以降低大鼠机体抗氧化能力并损伤大鼠肝功能,其效应随饲粮中霉变玉米比例的增加而增强[15]。本次试验结果为CDA、GSH-Px、SOD、MDA 均有明显下降,可能由于长期的暴露在DON下,机体处于失代偿状态,与付莹等[16]研究的基本一致,纵使DON 含量较低,但影响代偿时间较长,也会对机体造成一定程度的损伤。且对各种指标的变化规律产生了一定影响。
3.3 结论 本研究表明,低剂量(2 mg/kg)DON 污染的饲粮虽然未明显影响断奶仔猪CD4+、CD8+淋巴细胞亚群的平衡,但是对仔猪机体的抗氧化水平造成了一定程度的损害,说明DON 在影响机体健康时,先是从破坏机体抗氧化系统开始的。
[1] UenoY,et al.赤霉病麦中毒学术讨论会论文摘要,1984:4.
[2] Pieters M N,Freijer J,Baars B J,et al.Risk assessment of deoxynivalenol in food:concentration limits,exposure and effects[J].Adv Exp Med Biol,2002,504:235-248.
[3] 李月红,张祥宏,王俊灵,等.脱氧雪腐镰刀菌烯醇对小鼠胸腺细胞凋亡和增殖的影响[J].中国病理生理杂志,2002,18(7):775-875.
[4] Preska J J,Yan D,King L E.Flowey tometrie analysis of the effeets of invitroex Posureto vomitoxin(deoxynivalenol)on apoptosis in murine T,B and IgA+ cells [J].Food Chem Toxieol,1994.
[5] 吴苗苗,肖昊,印遇龙,等.谷氨酸对脱氧雪腐镰刀菌烯醇刺激下的断奶仔猪生长性能、血常规及血清生化指标的干预作用[J].动物营养学报,2013,25(7):1587-1594,329(12):1125-1136.
[6] Eli B,Richard C,Geoffrey S.Immunology(forth edition),a short course[M].New York:Jorn Wiley & Sons Inc,2000.
[7] Rigano R E,Profumo S.Cytokine gene expression in peripheral blood mononuclear cells from patients with pharmacologically treated cystic echinococcosis[J].Clin Exp Immunol,1999b,118:95-101.
[8] 王珊,廖杰,于立方,等.流式细胞术快速检测T 细胞亚群和NKT 细胞亚群的免疫荧光变化[J].现代科学仪器,2010(3):95-97.
[9] 崔治中.兽医免疫学[M].北京:中国农业出版社,2004
[10] 龚非力.医学免疫学[M].北京:科学出版社,2004.
[11] 屈雪琪,赵建增,梁智选,等.流式细胞术检测不同试验条件对猪T 淋巴细胞亚群的影响[J].中国畜牧兽医,2011,38(4):101-104.
[12] 张振斌,蒋宗勇.超早期断奶应激对仔猪T 淋巴细胞亚群的影响[J].中国畜牧杂志.1999,35(3):16-18.
[13] 谢红兵,黄志坚,强陈,等.复方中草药免疫增强剂对断奶仔猪T 淋巴细胞亚群的影响[J].中国兽医杂志,2007,43(10):42-43.
[14] 刘弘,赵红,苑贺英,等.中药复方对解脲支原体感染小鼠T细胞亚群和细胞因子的影响[J].中国中医急症,2011(6):917-919.
[15] 虞洁,余冰,陈代文,等.饲粮中自然霉变玉米对大鼠抗氧化能力的影响[D].雅安:四川农业大学硕士论文.
[16] 付莹,马万成,王丽华,等.不同剂量T-2 毒素在不同时间对大鼠氧化抗氧化能力的影响[J].中国地方病防治杂志,2011(4):1001-1889.

