高铜日粮对肉鸡肝脏T rx2蛋白表达的影响
王荣梅,赵翠燕,闫文龙,陈立军
(1.韶关学院英东农业科学与工程学院,广东 韶关512005 ;2.广西出入境检验检疫局检验检疫技术中心,广西 南宁530021)
高剂量铜作用于肉鸡会导致其铜中毒,已有研究表明,高铜会导致机体产生活性氧分子(ROS),而ROS 能够引起脂质过氧化损伤,线粒体型硫氧还蛋白2 系统(Trx2 系统)对清除体内自由基具有重要作用,它是一种存在于线粒体中的抗氧化系统,该系统为一个控制细胞还原/氧化状态和细胞增殖/生存的广泛表达的氧化还原系统,在线粒体内行使多种生物学功能[1]。线粒体型硫氧还蛋白2(Trx2)是该系统的组成成分之一,它是Trx 家族中一种线粒体特异性蛋白,它与锰型超氧化物岐化酶(Mn-SOD)以及还原型谷胱甘肽(GSH)构成线粒体重要的抗氧化防御系统[2]。本课题组之前的研究表明高铜日粮可导致线粒体硫氧还蛋白还原酶2 mRNA 在肝脏中的表达量降低,还原活性先升高后降低[3]。本试验旨在探讨高铜日粮对肉鸡肝脏Trx2 在基因表达和蛋白表达方面的影响,以更进一步研究高铜对动物肝脏线粒体抗氧化功能的损伤机理。
1 材料与方法
1.1 试验动物 选用1 日龄Cobb 商品代肉鸡200只(购自深圳某种鸡场,平均体质量36 g±0.3 g),随机分为4 组,每组50 只。对鸡进行常规免疫,自由采食和饮水,24 h 光照。试验选用CuSO4·5H2O作为铜源,基础日粮对照组铜含量为Feedstuff 推荐的11 mg/kg(对照组,即Ⅰ组),高铜试验组分别为此标准的10、30 倍和50 倍,即110 mg/kg(Ⅱ组)、330 mg/kg(Ⅲ组)、550 mg/kg(Ⅳ组)。基础日粮以玉米、豆粕为主配制而成,蛋白质、能量以及维生素和微量元素添加量均按照NRC(1994)家禽营养需要配制。
1.2 主要试验材料 凝胶成像及分析系统(美国Perkin-Elmer 公司);高速冷冻离心机(美国Thermo IEC 公司);PCR 仪(美国Perkin-Elmer 公司);微量移液器(法国GILSON 公司);BG-verMINI 迷你垂直电泳仪和BG-blotMINI 迷你垂直转移槽(美国BAYGENE 公司);TS-2 型脱色摇床(海门其林贝尔仪器制造有限公司);手动匀浆器、RTPCR 试 剂 盒(TaKaRa PrimeScript One Step RTPCR Kit Ver.2);Trx2 鼠单抗(英国Abcam 公司);羊抗鼠IgG-HRP(南京生兴生物公司);GAPDH 标签抗体(36 kD)(康为世纪公司)。
1.3 样品采集 于试验的10 d、30 d 和50 d 每组随机选择5 只鸡宰杀、采集肝脏,单只肝脏一部分放入液氮中保存用于提取肝脏总RNA,另一部分置液氮中迅速冷冻,再置于-70 ℃保存,用于提取肝脏总蛋白以测定肝脏中Trx2 蛋白表达量。
1.4 肉鸡肝脏总RNA 的提取和测定 总RNA 提取按TaKaRa 公司的RNAiso Plus 试剂盒进行。紫外比色法测定总RNA 浓度和纯度,取10μg 总RNA,变性琼脂糖凝胶电泳分离、拍照观察RNA条带。
1.5 PCR 引物的设计及RT-PCR 反应 目的基因引物序列是根据GenBank 上鸡的Trx2、cDNA 序列按Primer6 软件自行设计的,引物序列见表1,由上海博亚工程技术服务有限公司合成。

表1 目的基因引物参数
参照TaKaRa 有限公司的One Step primeScript RT-PCR Kit Ver.2 操作说明书进行RT-PCR 反应。反应体系中模板即总RNA 为2 μg;经过多次条件优化、选择后,最终确定本试验反应条件为50 ℃30 min,94 ℃3 min,94 ℃30 s(变性),56 ℃40 s(退火),72 ℃50 s(延伸),3~5 步循环39次,72 ℃10 min。Trx2 和β-actin 目的基因的退火温度为56 ℃。
1.6 DNA 片段回收及测序 将鉴定准确的PCR产物用2.0%琼脂糖凝胶电泳分离,然后按TaKa-Ra Agarose Gel DNA Purification Kit Ver. 2.0 操作说明书将DNA 片段进行回收,送宝生物工程(大连)有限公司测序。
1.7 PCR 扩增、电泳及灰度分析 按上述条件进行RT-PCR 扩增所要测定样品,取单个样品PCR 产物5 μL 在1.5% 琼脂糖凝胶上电泳(EB 染色)。用Quanty One 图像分析软件系统分析条带灰度。目的基因条带灰度与β-actin 条带灰度的比值来表示Trx2目的基因丰度,亦即试验结果。每组5 个样品,每个样品做2 次重复。
1.8 Trx2 蛋白表达的测定 细胞裂解法提取肝脏组织总蛋白,考马斯亮蓝法进行蛋白浓度测定,SDS-PAGE 凝胶电泳,Western blot 蛋白印迹,用凝胶成像分析系统进行扫描并进行灰度分析。每组目的蛋白条带吸光度(N)与相应的GAPDH 蛋白条带吸光度(A)的比值Y(Y=N/A)作为Trx2 蛋白表达的相对含量,亦即试验结果。每组5 个样品,每个样品做2 次重复。
1.9 数据处理 数据用-X ±SE 表示,应用SPSS 统计分析软件统计各组的试验数据,通过Ducans 新复极差检验法(DMRT 法)比较组间的差异。
2 结果与分析
2.1 高铜日粮对肉鸡Trx2 基因mRNA 表达的影响 组间比较,与对照组(Ⅰ组)相比,在对应试验时间点,除Ⅳ组50 d 时Trx2 mRNA 基因表达量降低,且差异显著(P<0.05)外,其余组在各试验时间点与对照组相比虽略有升高,但差异不显著(P>0.05);组内比较,Ⅰ组、Ⅱ组、Ⅲ组在30 d、50 d 较该组10 d 时Trx2 mRNA 基因表达量升高,但差异不显著(P>0.05),Ⅳ组30 d、50 d 较该组10 d 时Trx2 mRNA 基因表达量降低,且50 d 时差异显著(P<0.05),结果见表2。
2.2 高铜日粮对Trx2 蛋白表达的影响 组间比较,与对照组(Ⅰ组)相比,在对应试验时间点,Ⅳ组50d 时Trx2 蛋白表达量升高,且差异显著(P<0.05),其余组在各试验时间点与对照组相比虽略有升高,但差异不显著(P>0.05);组内比较,Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组在30 d、50 d 较该组10 d 时Trx2 蛋白表达量均升高,但只有50 d 时差异显著(P<0.05),结果见表3。
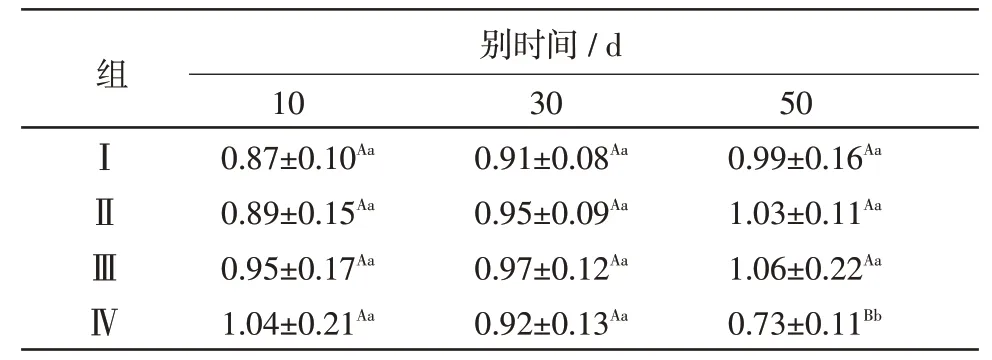
表2 高铜日粮对Trx2基因mRNA表达的影响
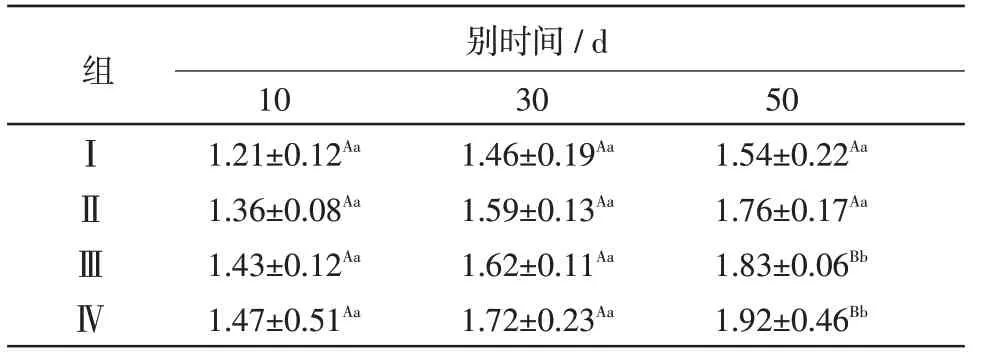
表3 高铜日粮对Trx2蛋白表达的影响
3 讨论
ROS 在启动和调节细胞凋亡中扮演重要角色[4],机体不断形成的低水平ROS 是正常氧代谢的部分产物[5-6],然而当ROS 产生增加或保护系统功能降低时会导致氧化应激,大分子不可逆性损伤、琉基氧化,引起病理过程包括凋亡[7]。活性氧一方面在生物体内发挥着重要的生理功能,同时在一定条件下有成为损害生物机体的内在因子,诱导脂质过氧化,导致细胞结构和功能损害。高铜作用于肝脏细胞导致细胞内产生大量的ROS,ROS 攻击损伤细胞线粒体DNA(mtDNA)。mtDNA 编码13 条多肽均为氧化磷酸化酶复合体的亚基,在线粒体呼吸链电子传递和氧化磷酸化产能过程中发挥重要作用[8]。mtDNA损伤致使线粒体电子传递障碍和三磷酸腺苷(ATP)能量合成障碍,电子漏产生增加,生成大量ROS,加重靶细胞损伤[9]。由此可知,线粒体既是细胞内ROS产生的主要部位又是氧化损伤的主要靶细胞器[10]。因此,如何早期提高抗氧化能力、加强对线粒体保护、减少ROS 产生[11]是降低高铜日粮对肉鸡肝脏损伤的关键。
本试验结果表明,采用高铜日粮饲喂试验鸡后,Trx2 的mRNA 表达水平和蛋白表达水平在不同组别不同时期有一定的变化趋势。Ⅰ、Ⅱ组随着试验时间的延长Trx2 的蛋白表达量升高,但差异不显著(P>0.05),同样该两组基因表达量也升高,差异不显著(P>0.05),说明饲料中铜含量在110 mg/kg 时能够提高肝脏Trx2 的基因和蛋白表达量,从而增强肝脏的抗氧化性能、提高线粒体体呼吸功能,提高肉鸡的生长性能。Ⅲ组、Ⅳ组在30 d 和50 d 时蛋白表达量升高,且50 d 时差异显著(P<0.05),但Ⅲ组基因表达量一直升高,Ⅳ组基因表达量降低且50 d 时差异显著(P<0.05),由此表明,当日粮铜含量在550 mg/kg 饲喂50 d 时,Trx2 mRNA 基因表达量降低、蛋白表达量升高,提示高铜会影响Trx2 基因表达及蛋白表达过程,原因可能是因为机体具有代偿作用,日粮铜含量为330 mg/kg~550 mg/kg 饲喂一段时间以后(30 d~50 d 左右)肝脏受到损害,结合本课题组之前的研究结果[3],铜作用下线粒体中的抗氧化系统功能降低,机体为了抵抗高铜带来的损伤而代偿性的提高硫氧还蛋白还原酶2(TrxR2)的活性,以大量还原氧化型Trx2 而达到修复肝脏Trx2 系统的作用,但是,铜同样可抑制Trx2 的基因表达,导致其基因表达量降低,机体为了达到清除越来越多的ROS 的目的,在TrxR2 活性的作用下,Trx2 蛋白表达量升高。
[1] Steph E N,Byung H H,Ning L L,et al.Selective vulnerability of late oligodendrocyte progenitors to hypoxiaischemia[J].J Neurosci,2002,22(2):455-463.
[2] 蔡成,常立文,李文斌.高氧对人肺腺癌A549 细胞中硫氧还蛋白-2 表达的影响[J].华中科技大学学报(医学版),2008,37(2):222-228.
[3] 刘好朋,唐兆新,苏荣胜,等.高铜日粮对肉鸡TrxR2 基因mRNA 表达和还原活性的影响[J].畜牧兽医学报,2011,42(3):423-428.
[4] Anantharam V,Lehrmann E,Kanthasamy A,et al . Mieroarray analysis of oxidative stress regulated genes mesencephalic dopaminergic neuronal cells:Relevance oxidative damage in Park inson‘S disease[J].Neur Ochem Int,2007,50(6):834-847.
[5] Chance B,Sies H,Boveris A.Hydroperoxide metabolism in mammalian or Pgans[J].Phsiol Rev,1979,59(3):527-605.
[6] Cadenas E.Biochemistry of oxygen toxicity[J].Annu Rev Biochem,1985,5:79-110.
[7] Zhivolovsky B,Orrenjus S,Brustugun O T,et al.Injrted cytochrome c induces apoptosis[J].Nature,1998,391(66):449-500.
[8] Xu W,Ngo L,Perez G,et al.Intrinsic apoptoticc and thioredoxin pathways in human Prostate cancer cell response to histone deacetylase inhibitor[J].Proc Natl Acad Sci USA,2006,103(42):15540-15545.
[9] Wang D,Masutani H,Oka S,el al.Control of mitoehondrial outer membrane permea Bilization and Bcl-xL levels by thioredoxin 2 in DT40 cells[J].J Biol Chem,2006,281(11):73 84-7391.
[10] Beard D A.A biophysical model of the mitochondrial respiratory system and oxidative Phosphorylation[J].PLoS Comput Biol,2005,1(4):e36.
[11] Lo H L,Nakajima S,Ma L,et al.Differential biologic effects of CPD and 6-4PP UV-Induced DNA damage on the induction of apoptosis and cell-cycle arrest[J].BMC Cancer,2005,135(5):1-9.

