川芎嗪对LPS致伤奶牛子宫内膜上皮细胞的TLR4和BNBD4 mRNA表达的影响
王自力,蒋会会,张翥,魏学良,别应堂,张家骅
(1.西南大学动物科技学院,重庆400715;2.重庆市光大集团有限公司,重庆 400020)
川芎嗪对LPS致伤奶牛子宫内膜上皮细胞的TLR4和BNBD4 mRNA表达的影响
王自力1,2,蒋会会1,张翥1,魏学良1,别应堂2,张家骅1
(1.西南大学动物科技学院,重庆400715;2.重庆市光大集团有限公司,重庆 400020)
为探讨脂多糖(LPS)对奶牛子宫内膜上皮细胞TLR4和BNBD4 mRNA表达的影响及川芎嗪的调控作用,体外培养奶牛子宫内膜上皮细胞,并分为对照组、LPS组、川芎嗪组(高、中、低浓度),利用实时荧光定量PCR法对各组细胞TLR4和BNBD4 mRNA表达进行了检测。结果表明:LPS可显著刺激奶牛子宫内膜上皮细胞TLR4及BNBD4 mRNA表达显著升高(P<0.05),川芎嗪可抑制LPS诱导子宫内膜上皮细胞TLR4升高作用,并能促进BNBD4 mRNA表达。提示川芎嗪可干预LPS诱导的奶牛子宫内膜上皮细胞炎症反应,并促进其分泌β-防御素起到改善子宫内膜炎的作用。
川芎嗪;脂多糖;子宫内膜上皮细胞;表达
奶牛子宫内膜炎是奶牛产后常见疾病,主要原因是病原微生物如大肠杆菌、金黄色葡萄球菌等感染奶牛子宫内膜,导致奶牛子宫内膜发生炎性反应,引起子宫内膜充血、炎性物分泌增多,造成繁殖障碍引起经济损失[1]。研究表明,LPS是大肠杆菌的细胞壁重要组成成分之一,可诱导严重的组织炎症过程;Toll样受体是介导先天免疫的受体(TLRs),其中TLR4是介导LPS诱发和加重组织炎症反应的重要受体;防御素是一种高效抗菌多肽,可直接杀菌,抵御入侵机体的病原微生物,调节机体免疫应答、组织创伤修复,在介导获得性免疫反应过程中起着重要作用,而BNBD4是β-防御素中的重要成员之一[2]。川芎具有活血祛瘀、行气止痛功效,常用于治疗奶牛子宫内膜炎等产科疾病。为了探讨其治疗奶牛子宫内膜炎的作用机制,本文通过体外培养奶牛子宫内膜上皮细胞,研究川芎的主要有效成分川芎嗪对LPS致伤奶牛子宫内膜上皮细胞的TLT4和BNBD4 mRNA表达的影响,以探讨川芎嗪在奶牛子宫内膜炎防治中的作用及机制。
1 材料与方法
1.1 药品与试剂 川芎嗪(批号110817-201006),中国药品生物制品检定所;RPMI-1640培养基(批号1621404),胎牛血清(批号1315148),均购自GIBCO公司;LPS(O55:B5)(批号L2880)、青链霉素溶液(批号20150513),DMSO(批号BCBJ4508V),MTT(批号410C0516),均购自Sigma公司; TRIZOL(批号A9507-1)、cDNA反转录试剂盒(批号AK3101),购自大连TakaRa公司;SYBRGreen MIX液(批号172-5271),购自BIO-RAD公司;TLR4、BNBD4引物由上海生工生物工程股份有限公司合成。
1.2 仪器设备 实时荧光定量PCR仪(美国BIO-RAD),酶标仪(680型,美国BIO-RAD),台式高速冷冻离心机(日本HITACHI),梯度PCR仪(美国Eppendorf)。
1.3 方法
1.3.1 奶牛子宫内膜上皮细胞培养 参照文献[3]方法培养奶牛子宫内膜上皮细胞。无菌手术采集3岁龄荷斯坦空怀经产奶牛子宫粘膜层,剪成1 mm3大小,于37 ℃0.1%的Ⅱ型胶原酶溶液中振荡消化40 min后,经过200目细胞筛过滤,滤液经1000 r/min离心5 min后,将所得细胞经RPMI1640完全培养基清洗和悬浮3次,台盼蓝计算细胞活性,培养和纯化细胞。
1.3.2 奶牛子宫内膜上皮细胞增殖 采用MTT法检测奶牛子宫内膜上皮细胞的增殖。将纯化后的奶牛子宫内膜上皮细胞用0.5%胰酶消化后,将5×104个/mL的细胞液接种于96孔细胞培养板中,分为对照组、川芎嗪组(分别为5、10、20、40 μg/mL浓度组),每孔100 μL,各组设10个重复,于37 ℃、5%CO2培养24 h后吸弃培养基。
分别向各孔加入含川芎嗪液,使之终浓度分别为0、5、10、20、40 μg/mL,各孔体积为100 μL,于37 ℃、5%CO2培养48 h后,加入5 mg/mL 的MTT液20 μL培养4 h后,吸弃培养基后加入150 μL DMSO震荡溶解10 min后,于490 nm测定OD值。
1.3.3 奶牛子宫内膜上皮细胞TLR4及BNBD4 mRNA的表达 将纯化培养的奶牛子宫内膜上皮细胞调整为5×104个/mL,接种于6孔细胞培养板中,于37 ℃、5%CO2培养48 h后,吸弃培养基后,向各孔细胞内加入无血清RPMI1640培养基,分别向各低、中、高浓度组细胞加入川芎嗪溶液,参照细胞增殖试验结果,使川芎嗪终浓度分别为5、10、20 μg/mL(简称低、中、高剂量组),对照组和模型组不添加任何药物,每组5个重复。
各组细胞于37 ℃、5%CO2条件下培养6 h后,分别向除对照组外的各孔细胞内加入LPS溶液以使终浓度为1 μg/mL,对照组加入相同体积的基础培养基,于相同条件下继续培养24 h后吸弃培养上清液, HBSS液冲洗细胞1次后,TRIZOL抽提各孔细胞总RNA,并按照试剂盒说明进行反转录,产物保存于-20 ℃条件保存。
1.3.4 引物设计及合成 根据GenBank中牛TLR4、BNBD4及β-actin基因序列,由上海生工生物工程股份有限公司合成。各基因引物序列如表1所示。

表1 各基因引物序列表
1.3.5 奶牛子宫内膜上皮细胞中TLR4和BNBD4 mRNA的检测 提取奶牛子宫内膜上皮细胞的总RNA,按照反转录试剂盒说明,将RNA反转录为cDNA后,进行实时荧光定量PCR反应扩增目标基因序列,反应条件为:95 ℃预变性30 min,95 ℃变性5 s,退火(TLR4 56 ℃、BNBD4 54 ℃)30 s,65 ℃延伸5 s,共进行39个循环,95 ℃延伸30 s。
2 结果与分析
2.1 川芎嗪对奶牛子宫内膜上皮细胞增殖的影响 由图1可知,分别向奶牛子宫内膜上皮细胞培养基中加入5、10、20、40 μg/mL的川芎嗪,均对各孔奶牛子宫内膜上皮细胞的增殖无显著影响(P>0.05)。
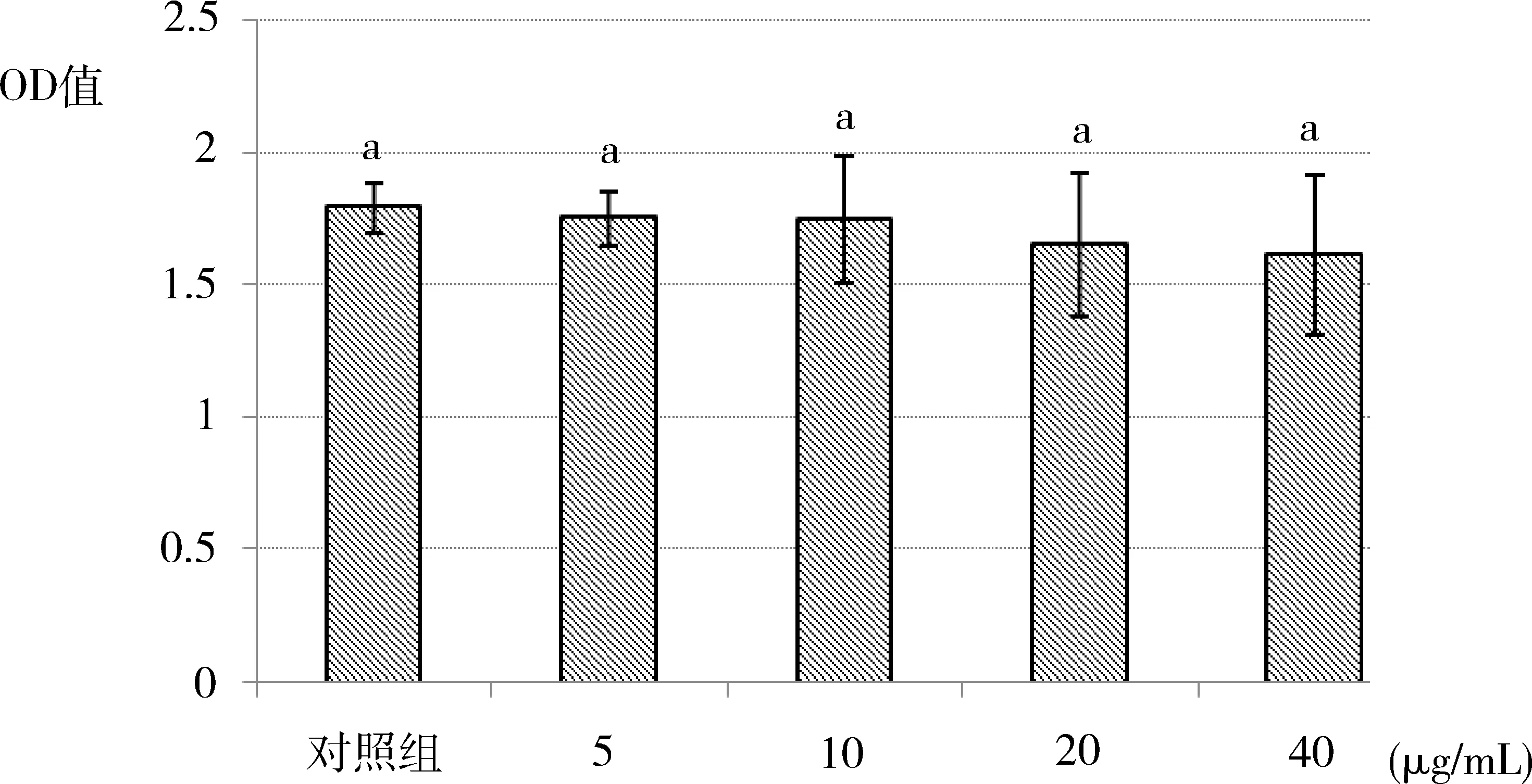
图1 川芎嗪对奶牛子宫内膜上皮细胞增殖的影响(n=10)(各组之间相比,相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05),下同)
2.2 川芎嗪对奶牛子宫内膜上皮细胞TLR4 mRNA表达的影响 由表2可知,含有1 μg/mL LPS组及低剂量组的奶牛子宫内膜上皮细胞TLR4 mRNA表达量显著高于对照组(P<0.05),而中剂量组、高剂量组细胞TLR4 mRNA表达均显著低于LPS组及对照组(P<0.05)。
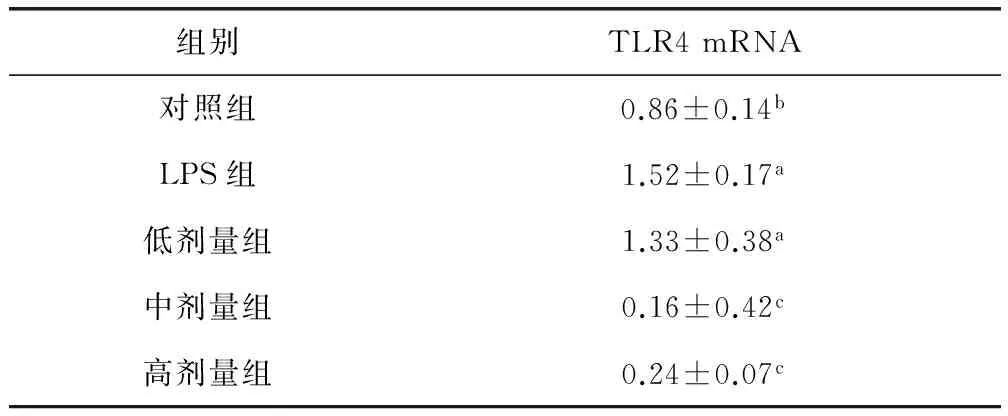
表2 川芎嗪对奶牛子宫内膜上皮细胞TLR4 mRNA表达的影响(n=5)
2.3 川芎嗪对奶牛子宫内膜上皮细胞BNBD4 mRNA表达的影响 由表3可知,LPS组及低剂量组奶牛子宫内膜上皮细胞BNBD4 mRNA表达量显著高于对照组(P<0.05),中剂量组、高剂量组细胞BNBD4 mRNA均显著低于LPS组及对照组(P<0.05)。
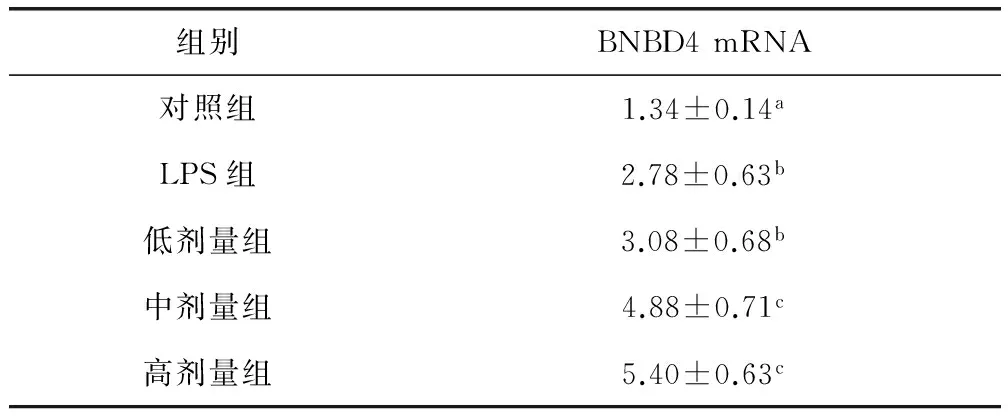
表3 川芎嗪对奶牛子宫内膜上皮细胞BNBD4 mRNA表达的影响(n=5)
3 讨论与小结
川芎具有活血行气、祛风止痛功效,常用于难产、胎衣不下等产科疾病[4]。川芎嗪是伞形科藁本属植物川芎根提取的生物碱成分,是川芎的主要有效成分之一,常用于防治脑缺血、缺氧再灌注损伤及脑梗死等,具有改善微循环、抗血栓、改善血液流变学、清除氧自由基、减轻和抑制哮喘的气道炎症、抗癌等功效[5]。
本研究表明,5、10、20、40 μg/mL的川芎嗪均对奶牛子宫内膜上皮细胞增殖无明显影响,即均对奶牛子宫内膜上皮细胞无细胞毒性。因此,本研究选用5、10、20 μg/mL三个浓度的川芎嗪进行后续研究。同时,本研究表明10、20 μg/mL的川芎嗪可显著抑制奶牛子宫内膜上皮细胞TLR4 mRNA的表达,可抑制LPS诱导的奶牛子宫内膜上皮细胞炎性反应的发生,且5、10、20 μg/mL的川芎嗪均能显著促进奶牛子宫内膜上皮细胞BNBD4 mRNA 的表达(P<0.05)。现有研究表明,川芎嗪治疗急性冠状动脉综合征中具有抗炎及促纤溶作用,可有效降低血浆C反应蛋白、血清淀粉样蛋白及纤溶酶原抑制剂-1的浓度[6]。
研究表明,TLR4可识别病原体,可向胞内传递信号激活NF-κB和AP-1等转录因子而促使细胞启动一系列免疫炎症反应,清除入侵的病原微生物,例如产生许多可扩大免疫炎症反应、增强杀菌作用的细胞因子IL-1,IL-6,IL-8,IL-12及TNF-α等引发和加重炎症反应[7]。现有研究表明,川芎嗪能抑制大鼠动脉粥样硬化形成中TLR4表达而达到抗炎以及动脉粥样硬化的功效[8]。因此,结合本研究结果可知,川芎嗪可通过干预子宫内膜上皮细胞TLR4 受体的表达,进而控制TLR4下游的炎性信号通路及炎性细胞因子的表达和分泌,参与控制局部炎症反应,起到防治子宫内膜炎的作用。
由本研究可知,LPS可诱导奶牛子宫内膜上皮细胞BNBD4 mRNA的表达增加,川芎嗪可进一步促使BNBD4的表达,而BNBD4是β-防御素的重要成员之一。研究表明,β-防御素可由皮肤、黏膜、气道等上皮细胞产生,分布在宿主机体与环境的界面位置,构成机体抵御细菌、炎性细胞因子等侵袭的第一道化学屏障,其功能的失活与病原微生物定植、集落于皮肤和黏膜上皮而导致严重的感染关系非常密切[9],对保护上皮细胞和黏膜免受感染起着屏障防御的作用[10],且对G+、G-、包膜病毒和真菌均具有强烈的杀伤作用,且对动物组织细胞无杀伤作用[11-12]。
综上所述,川芎嗪具有控制LPS诱导的奶牛子宫内膜上皮细胞炎性反应的作用,并能促进奶牛子宫内膜上皮细胞分泌β-防御素,起到控制子宫内膜炎症的作用,初步阐释了川芎在奶牛子宫内膜炎中的作用效果及可能机制,但其分子信号机制尚需进一步研究。
[1] 王孝武,王旭荣,杨志强,等.奶牛子宫内膜炎研究进展[J].动物医学进展,2014,35(7):98-102.
[2] 陶爽,曹荣峰.子宫内膜炎奶牛子宫组织β-防御素及相关因子的表达[J].中国兽医杂志,2014,1:18-20.
[3] 张雷,张振新,王亨,等.奶牛子宫内膜上皮细胞和间质细胞的组织块培养及鉴定[J].中国兽医杂志,2008,4:21-24.
[4] 刘钟杰,许剑琴.中兽医学[M].第3版.北京: 中国农业出版社,2002:233-234.
[5] 杨雪梅.川芎嗪药理作用研究进展[J].中国生化药物杂志,2010,3:215-216.
[6] 吴海云,王士雯,朱姝,等.川芎嗪在急性冠状动脉综合征中抗炎作用的研究[J].中国中西医结合急救杂志,2004,4(4):196-198.
[7] Beutler B,Poltorsk A.Sepsis and evolution of the innate immune response[J].Critical Care Medicine,2001,29(7): 2-7.
[8] 戴婷,罗超,张曼,等.川芎嗪对大鼠动脉粥样硬化形成中Toll样受体4表达的影响[J].山西医药杂志月刊,2013,1(2):6-8.
[9] Ross D J,Cole A M,Yoshioka D,etal.Increased bronchoalveolar lavage human beta defensin type 2 in bronchiolitis obliterans syndrome after lung transplantation [J].Transplantation,2004,78(8): 1222-1224.
[10]Ohara T,Morishita T,Suzuki H,etal.Pathophysiological role of human beta defensins 2 in gastric mucosa [J].Int J Mol Med,2004,124(6): 1023-1027.
[11]Pioli P A,Weaver L K,Schaefer T M,etal.Lipopolysaccharide-induced IL-1 beta production by human uterine macrophages up-regulates uterine epithelial cell expression of human beta-defensin 2 [J].J Immunol,2006,176(11): 6647-6655.
[12]冯艳,潘小玲,黄宁,等.人β-防御素基因在女性生殖道及妇女妊娠相关组织中的表达[J].四川大学学报: 医学版,2003,34(2): 217-219.
(编辑:侯向辉)
Effects ofLigustrazineon TLR4 and BNBD4 mRNA Expression Level of Endometrial Epithelial Cells in Cow Injured with LPS
WANG Zi-li1,2,JIANG Hui-hui1,ZHANG Zhu1,WEI Xue-liang1,BIE Ying-tang2,ZHANG Jia-hua1
(1.CollegeofAnimalScienceandTechnology,SouthwestUniversity,Chongqing400715,China; 2.ChongqingGondaGroupCo.,Ltd,Chongqing400020,China)
In order to investigate the effects ofLigustrazineon the TLR4 and BNBD4 mRNA expression level of endometrial epithelial cells in cow injured with LPS,the endometrial epithelial cells are cultured in vitro,and then be divided into 3 groups: control group,LPS group,Ligustrazinegroup.And then the TLR4 and BNBD4 mRNA expression level in bovine endometrial epithelial cells were menstruated with real-time PCR.The results show that the LPS could raise the TLR4 and BNBD4 mRNA expression level in bovine endometrial epithelial cells in significantly,while theLigustrazinecould decrease the TLR4 mRNA expression level and increase the BNBD4 mRNA expression level in bovine endometrial epithelial cells in significantly.Therefore,Ligustrazinecould control the inflammatory reaction caused by LPS in bovine endometrial epithelial cells throughdecreasing the TLR4 mRNA expressing level and increasing the β- defensin’s expression.
Ligustrazine;LPS;endometrial epithelial cells;expression
重庆市应用开发计划项目(cstc2014yykfB10001);重庆市博士后特别资助项目(XM20120050);中央高校基本业务经费(XDJK2016C098)
王自力,博士,副教授,从事中兽医学及中药免疫药理学研究。
2015-11-12
A
1002-1280 (2015) 12-0032-04
S853.72

