柱前衍生高效液相色谱测定糖化血红蛋白
王冬环,周伟燕,张天娇,汪 静,马 嵘,张江涛
(北京医院 卫生部临床检验中心,北京100730)
柱前衍生高效液相色谱测定糖化血红蛋白
王冬环*,周伟燕,张天娇,汪静,马嵘,张江涛
(北京医院 卫生部临床检验中心,北京100730)
摘要:目的建立一种柱前衍生高效液相色谱(high performance liquid chromatography,HPLC)测定糖化血红蛋白(HbA1c)的方法。方法蛋白内切酶 Glu-C 将血红蛋白从β链N末端水解得到糖基化和非糖基化的六肽(HbA1c六肽和HbA0六肽),HbA1c六肽和HbA0六肽与对氨基苯磺酸进行衍生反应,生成糖基化和非糖基化偶氮六肽衍生物,采用高效液相色谱对衍生物进行分离、测定,根据HbA1c衍生六肽和HbA0衍生六肽的峰面积比计算样本中HbA1c的量。结果对高、中、低不同浓度血样进行反复多次分析,总变异系数CV分别为1.61%、1.74%和0.90%;HbA1c浓度在0.3% -15.6%范围内,线性回归方程为Y=1005X+7.26,R=0.995 9,线性关系良好;对低、中、高3个浓度的HbA1c国家有证标准物质(GBW09181、GBW09182和GBW09183)进行测定,测定值与认证值的偏差在-3.81%-3.53%之间。采用本研究方法和常规方法分别对20份人血样本进行测定,相关回归方程为Y=0.928X+0.407,相关系数为R=0.996 5,二者有良好的相关性。 结论建立了柱前衍生HPLC测定HbA1c的方法,本法具有很好的稳定性、精密度和准确性。
关键词:血红蛋白A,糖基化;肽;柱前衍生;色谱法,液相
(ChinJLabDiagn,2015,19:1991)
糖尿病已成为21世纪全球范围的流行病。2014年全球糖尿病患者数为3.87亿,预计2030年将达到5.92亿[1]。而我国就有1.139亿,居世界首位,此外,还有50%的中老年人是糖尿病后备军[2]。 糖尿病是视网膜、肾脏、足及神经病变的主要危险因素,更是缺血性心脏病和中风的独立风险因子[3],严重威胁患者的生存质量以及生命[4]。糖化血红蛋白(HbA1c)是世界卫生组织及国际专家委员会推荐的糖尿病诊断标准[5],是糖尿病血糖控制的“金标准”[6],也是评估糖尿病微血管、大血管并发症的重要指标[7,8]。HbA1c可以反映最近2-3个月的平均血糖水平,与传统的糖尿病诊断指标相比,具有样本稳定、个体内生物学变异小、抽血时间不受限制、不易受干扰等优点,是糖尿病诊断、筛查和管理的有效指标[9],因此,保证糖化血红蛋白测定结果的准确性为临床提供可靠的依据至关重要。
HbA1c的常规测定方法有多种,尤其在我国,多达几十种,由于采用的原理与技术不同,因此测定结果的可比性和准确性有待提高。HbA1c测定有国际公认的参考方法,是国际临床化学与检验医学联合会(International Federation of Clinical Chemistry and laboratory medicine,IFCC)建立的高效液相串联电喷雾电离一级质谱(或高效液相串联毛细管电泳,两个方法结果一致)参考测量程序[10],并推荐使用mmol/mol为HbA1c的单位[11]。由于IFCC推荐的HbA1c参考测量程序采用一级质谱,使用氰基柱,在精准性方面有些不足。德国学者对此进行了改良,增加流动相中三氟乙酸的浓度并改变了洗脱梯度,解决了峰脱尾的问题并有效地改善了峰形,稳定了保留时间,提高了分析精密度[12],但同时增加了质谱分析响应信号的离子抑制风险[13,14]和质谱的污染;还有学者采用C12柱替代氰基柱[15],但以上两种改进都需要配备转向阀和辅助泵,增加了实验成本。
我们实验室已经建立了IFCC 推荐的LC-MS/MS测定HbA1c参考测量程序,现为IFCC网络参考实验室,考虑到质谱测定操作复杂,测定成本高昂,所需校准品运输困难,根据我们检测HbA1c的有关经验,利用HbA1c是糖基化血红蛋白与血红蛋白的比值及组成血红蛋白的活性氨基酸可以衍生的特点,探讨了一种柱前衍生高效液相色谱测定HbA1c的方法,现将结果报告如下。
1材料与方法
1.1主要试剂与仪器
1.1.1有证标准物质6个浓度水平的HbA1c国际基准校准物质Pcal2012-A-Pcal2012-F(认证值分别为:0.0 mmol/mol,29.3 mmol/mol,58.7 mmol/mol,87.5 mmol/mol,117.4 mmol/mol,146.9 mmol/mol,IFCC,比利时);3个浓度水平的HbA1c国家标准物质GBW09181- GBW09183(认证值分别为:38.4 mmol/mol (5.67%)、52.7 mmol/mol (6.97 %)、88.7 mmol/mol (10.27 %),中国)。
1.1.2试剂蛋白内切酶 Glu-C(美国NEB公司),色谱纯合成HbA1c六肽及HbA0六肽(上海科肽公司),色谱纯乙腈(美国Fisher公司),β吗啉乙磺酸(德国Sigma公司),氯化钠﹑醋酸铵﹑对氨基苯磺酸、亚硝酸钠、氯化铵、磷酸二氢钠和氢氧化钠分别为进口和国产分析纯试剂。
1.1.3仪器Ultimate 3000系统(美国Dionex公司),3K15离心机(德国Sigma公司),282A真空干燥箱(美国Fisher公司),恒温振荡器(型号Unimax1010,德国Heidolph公司),天平(型号XPE105,瑞士Mettler公司),HLC-723 G7 糖化血红蛋白检测仪及配套试剂(日本Tosoh公司)。
1.1.4血液样本 2014年北京医院内分泌科住院、门诊患者及志愿者的EDTA抗凝全血样本,其中,男23例,女16例,年龄23-68岁,平均年龄48.3岁。
1.2样品处理及测定
1.2.1衍生试剂配制A液:称取0.09 g对氨基苯磺酸,加入浓盐酸0.9 ml,加水至10 ml,超声至完全溶解,再与等体积的5%亚硝酸钠水溶液混合置棕色瓶中,放入冰箱1 h后使用;衍生B液为10%的硝酸钠溶液;氯化铵-氨水缓冲液:称取0.8 g氯化铵,置于烧杯中,加水溶解,用12 mol/L浓氨水调pH 至9.6,置于100 ml容量瓶中,定容至刻度。
1.2.2样品前处理方法
①溶血液的制备及酶解1.5 ml EDTA抗凝全血,于8 ℃ 3 000 g离心10 min,除去上层血浆;向下层红细胞中加入10 ml 0.15 mol/L 氯化钠溶液,置37 ℃温浴4 h,离心20 min,弃去上清液,重复该步骤,清洗红细胞2次;加入等体积超纯水,混匀;离心20 min,弃去沉淀物,小心吸取上层溶液,加入10 ml含稳定剂的水溶液(50 mmol/L β吗啉乙磺酸、10 mmol/L 碳酸氢钠,1 mmol/L Na2-EDTA,pH 6.2),混匀,制成溶血液,待用。取30 μl溶血液于玻璃安瓿中,加入50 μl 200 μg/ml Glu-C内切酶溶液,再用消化液(50 mmol/L醋酸铵,pH 4.3)将体积补足到500 μl,置(37±2)℃恒温振荡器18 h取出,-20 ℃冰箱停止消化,得到HbA1c六肽和HbA0六肽,待衍生用;6个浓度的HbA1c国际基准校准物质Pcal2012-A- Pcal2012-F及3个浓度的HbA1c国家标准物质GBW09181- GBW09183同步进行酶解消化。
②HbA1c六肽﹑HbA0六肽衍生化在1 ml氯化铵-氨水缓冲液中,先加入0.5 ml酶解液样品,然后分别加入1 ml衍生A液、1 ml衍生B液,摇匀,置于室温,反应20 min,进行HPLC分析。
1.2.3HPLC分析条件所用色谱柱为Zorbax Eclipse C18柱(4.6 mm*150 mm,粒径5 μm,美国Agilent公司)。柱温:25℃,流速:1.0 ml/min,进样量:20 μl,流动相A液:0.015 mmol/L 磷酸二氢钠,流动相B液:乙腈,采用梯度洗脱,洗脱程序见表1。
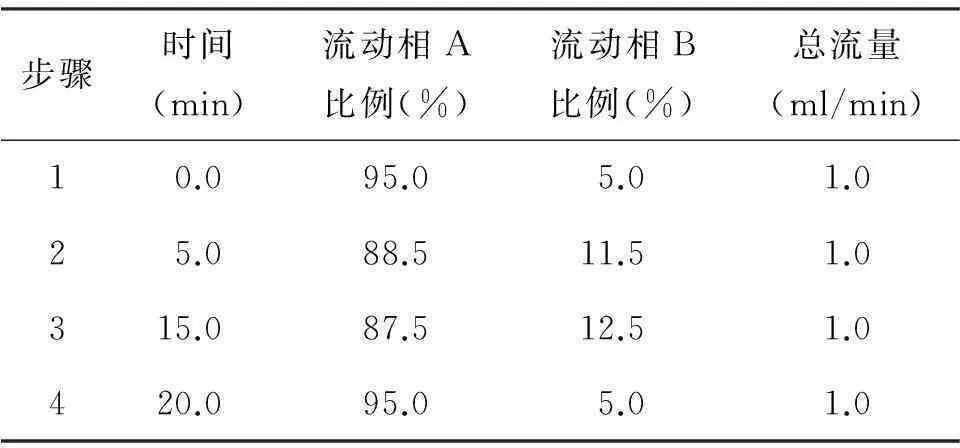
表1 液相色谱梯度洗脱程序
1.3方法性能评价
1.3.1精密度用低、中、高3个浓度的血样(HbA1c浓度分别为5.5%,6.8%和10.7%)考察本方法的精密度,用本法测定3批样本,每批每个浓度测3个平行样,每个平行样重复进针3次,将3次结果的平均值作为1个平行样的结果,这样,每个样品可得到9个测定结果,以批内CV和总CV表达本方法的精密度。
1.3.2特异性为检验本方法的特异性,首先取1份混合EDTA抗凝血样,分为3份,1份样本不做处理,另外2份样本分别进行甲酰化处理和乙酰化处理,然后分别用本方法和常规离子交换-高效液相色谱对3份样品进行处理和检测,比较样本处理前后的结果有无差异,以验证方法的特异性。样本的甲酰化处理:在1份样本中加入2 mmol/l 氰酸钾,置于37℃温育1 h;样本的乙酰化处理:在1份样本中加入5 mmol/l 乙酰水杨酸,置于37℃温育1 h。
1.3.3线性范围分析6个浓度水平的国际基准校准物质Pcal2012-A-Pcal2012-F,以HbA1c衍生六肽与HbA0衍生六肽峰面积比对相应的HbA1c认证值作线性回归,得到回归方程,以确定本方法的线性范围。
1.3.4准确性用本法对3个浓度水平的国家有证标准物质GBW09181- GBW09183进行测定,每个浓度测定3批,每批测定3个平行管,每个平行管重复进针3次,以每个浓度的平均结果与认证值进行比较,评价方法的准确性。
1.3.5与常规方法比对选取覆盖HbA1c高、中、低浓度范围共20份EDTA抗凝人血样本,分别用本方法、常规方法进行检测。常规方法采用Tosoh G7 糖化血红蛋白检测仪,检测时严格按照标准操作程序进行,采用仪器配套校准品为仪器校准。以本方法所测结果与常规方法所测结果做线性回归,进行比对。
1.3.6测量原理及数据统计蛋白内切酶Glu-C将血红蛋白β链N末端第6个氨基酸残基水解,得到糖基化和非糖基化六肽,即:HbA1c六肽﹑HbA0六肽;将HbA1c六肽与HbA0六肽衍生生成HbA1c衍生六肽与HbA0衍生六肽,用HPLC分离、定量。HbA1c在样品中的含量可根据HbA1c衍生六肽与HbA0衍生六肽的峰面积比计算得出,计算公式如下:
C =100* Ratiosig/(1+Ratiosig)
式中:C为HbA1c浓度(单位:%),Rsig为样品中HbA1c衍生六肽与HbA0衍生六肽的峰面积比。
采用微软Excel 2007进行数据统计,相关分析采用线性回归和线性相关检验。
2结果
2.1样品处理
本方法的样品处理主要由2部分组成,第一部分的溶血液制备及酶解主要目的是获得短肽,以便于分析、测定,经过Glu-C内切酶的水解作用,血红蛋白在β链N末端第6个氨基酸残基(Glu)处断开,得到糖基化HbA1c六肽和非糖基化HbA0六肽,即:C4H9O4-CO-CH2-NH-Val-His-Leu-Thr-Pro-Glu-COOH和NH2-Val-His-Leu-Thr-Pro-Glu-COOH。第二部分衍生,HbA1c六肽和HbA0六肽片段N端第二位是组氨酸残基(His),组氨酸的咪唑基与对氨基苯磺酸发生衍生化反应,生成橘红色偶氮产物,即:HbA1c衍生六肽和HbA0衍生六肽。
2.2HPLC测定条件的选择
为获得更好的色谱分离信号,本方法主要对所用色谱柱、柱温、进样量、流动相的组成、流动相的比例、流速等条件进行了优化,最终选择色谱柱为Zorbax Eclipse C18柱,(4.6 mm*150 mm,粒径5 μm,美国Agilent公司)。柱温为25℃,进样量为20 μl,流动相为0.015 mmol/L 磷酸二氢钠:乙腈,流速为1.0 ml/min。分析色谱图见图1。
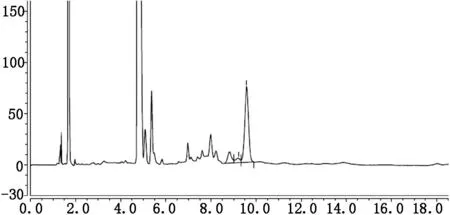
图1 HbA1c衍生六肽及HbA0衍生六肽色谱图
2.3精密度
低、中、高3个浓度水平血样的HbA1c浓度分别为S1:4.70%,S2:6.95%和S3:9.06%,对应的批内CV和总CV分别为S1:0.51%,1.61%;S2:0.75%,1.74%;S3:0.38%,0.90%,本方法精密度良好。
2.4特异性
采用本方法和常规离子交换-高效液相色谱法检测不做任何处理样本的结果分别为6.6%,6.8%;对应的经过甲酰化处理样本的结果分别为6.6%,7.1%;经过乙酰化处理样本的结果分别为6.6%,7.3%。由此可见,血红蛋白的甲酰化和乙酰化对离子交换-高效液相色谱法有影响,而本方法在样本处理前后检测结果一致,说明本方法有很好的特异性。
2.5线性范围
6个浓度水平的国际基准校准物质Pcal2012-A-Pcal2012-F 认证值分别为:0.0 mmol/mol,29.3 mmol/mol,58.7 mmol/mol,87.5 mmol/mol,117.4 mmol/mol,146.9 mmol/mol ,以HbA1c衍生六肽与HbA0衍生六肽的峰面积比对相应的认证值作线性回归,回归方程为:y=1005x+7.26(R2=0.992),由此可见本方法的线性范围至少为7.26 mmol/mol-146.9 mmol/mol,也可换算为0.3%-15.6%HbA1c[16],本方法线性范围能够满足临床应用的需求。
2.6准确度
用本法对3个浓度水平的国家有证标准物质GBW09181- GBW09183进行测定,每个浓度测定3批,每批测定3个平行管,每个平行管重复进针3次,测定结果的均值分别为:5.58% HbA1c,7.01% HbA1c,10.46% HbA1c,与认证值的偏差分别为:-0.09%,-0.04%,0.19%,对应的偏倚分别为-3.81%,0.96%,3.53%。
2.7与常规方法比对
选取覆盖高、中、低浓度范围的20份EDTA抗凝人血样本,分别用本方法、常规方法进行检测。以本方法所测结果对常规方法所测结果做线性回归,回归方程为y=0.928x+0.407,相关系数R2=0.993,显示二者有良好的相关性。
3讨论
本研究主要基于以下2个特点进行实验设计与研究:①利用HbA1c定义为糖基化血红蛋白与血红蛋白比值的特点,根据HbA1c衍生六肽与HbA0衍生六肽的峰面积比计算得出HbA1c的量;②利用血红蛋白的活性氨基酸可以进行衍生化反应的特点,以提高液相色谱分析的分离率与灵敏度。
多肽是一类具有重要生物功能的化合物,不仅是蛋白质和氨基酸之间的桥梁,也是蛋白质测序中能够直接测定的对象,与其它氨基酸相比,组氨酸常为活性中心,组氨酸残基的咪唑基可与对氨基苯磺酸进行衍生化反应,生成棕红色的偶氮化合物,即Pauly反应。血红蛋白由氨基酸组成,其β链N末端第2个氨基酸残基恰为组氨酸,本研究将血红蛋白水解为六肽,并与对氨基苯磺酸进行衍生化反应,由于氨基酸的衍生实验具有操作简洁、不产生或易于排出干扰物、色谱分离率高、灵敏度高等优点[17],可增加HPLC分析、测定HbA1c的精密度与特异性。
本研究中色谱条件是定量HbA1c的关键环节,为此对色谱条件进行了详细的优化,最终确定了本方法的条件。在色谱条件优化过程中,使用了合成HbA1c六肽与HbA0六肽,对合成六肽进行衍生化反应后,根据合成HbA1c衍生六肽与HbA0衍生六肽的分离条件及吸收峰位置确定色谱条件。在应用本方法时,流动相的配制是整个实验是否成功的关键所在。首先,在称量磷酸二氢钠时,称量误差不能大于0.020 g;另一个关键问题是,精确调节流动相的pH,pH对本方法HbA1c衍生六肽与HbA0衍生六肽分离的影响极大,对出峰时间也有影响。因此,需使用pH计,仔细认真调节pH。另:流动相最好不要保存,每次使用都现配现用。
作为一个检测方法,精准性至关重要。本研究对低、中、高3个浓度全血样本进行反复多次分析,最后得出总CV依次为1.61%、1.74%和0.90%,说明本方法精密度良好;对3个浓度水平的国家有证标准物质GBW09181- GBW09183进行测定,测定结果与认证值的偏差分别为:-0.09%,-0.04%,0.19%,对应的偏倚分别为-3.81%,0.96%,3.53%,结果偏倚在允许范围内。本方法使用对氨基苯磺酸作为衍生试剂,精密度良好,如采用带全自动衍生功能的自动进样器进行在线衍生,衍生后直接进样分析,可消除离线衍生进样时间不同和手工操作产生的误差,避免衍生产物衰减的可能性,保证进样时间的一致,不仅可提高精密度,还可提高准确性。如为提高衍生效果,也可使用两种衍生试剂。
本方法采用国际基准校准物质进行线性范围的确定,国际基准校准物质给出的是国际单位:mmol/L,为方便临床应用,根据目前国际HbA1c标准化规定,采用回归方程NGSP-HbA1c=0.915(IFCC-HbA1c)+2.15%[16]进行了换算,相应的单位为:%。
HbA1c测定方法会受到不同干扰因素的影响,常见的主要为变异血红蛋白和衍生血红蛋白,为证明本方法的特异性,对此进行了实验。由于本方法测定水解后的衍生六肽片段,常见的变异血红蛋白对本方法不形成干扰,因此进行了衍生血红蛋白的干扰实验。如长期服用阿司匹林,可使血红蛋白乙酰化;慢性肾病患者,可使血红蛋白甲酰化,本研究对此进行了实验。结果表明本方法不受衍生血红蛋白干扰,同时也验证了常规离子交换高效液相色谱法受衍生血红蛋白干扰。
本研究还测定了20份人血样本,以初步评价本方法与常规离子交换高效液相色谱法测定结果的偏差,结果表明本方法与常规离子交换高效液相色谱法有很好的相关性,进一步证明常规离子交换高效液相色谱法与本方法是两种可靠的检测方法。
本方法使用对氨基苯磺酸为衍生化试剂,通过HPLC进行分离、测定。测定准确度、稳定性及特异性结果表明,本方法设计合理,毋需质谱,可报告范围满足临床需求,适用于HbA1c的定量分析。
参考文献:
[1]International Diabetes Federation.Diabetes:fact and figures [EB/OL].(2014-12-16) [2015-08-03].https://www.idf.org/worlddiabetesday/toolkit/gp/facts-figures.
[2]Xu Y,Wang L,He J,et al.Prevalence and control of diabetes in Chinese adults [J].JAMA,2013,310(9):948.
[3]Lozano R,Naghavi M,Foreman K,et al.Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010 [J].Lancet,2012,380(9859):2095.
[4]Murray CJ,Vos T,Lozano R,et al.Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions,1990-2010 [J].Lancet,2012,380(9859):2197.
[5]World Health organization.Use of glycated haemoglobin(HbA1c)in the diagnosis of diabetes mellitus:abbreviated report of a WHO consultation[EB/OL].[2014-08-17].http://www.who.int/diabetes/publications/diagnosis_diabetes2011/en/.
[6]American Diabetes Association.Standards of medical care for patients with diabetes mellitus[J].Diabetes Care,2003,26:S33.
[7]Diabetes Control and Complications Trial Research Group.The effect of intensive treatment of diabetes on the development and progression of long-term complication in insulin-dependent diabetes mellitus[J].J N Engl J Med,1993,329:977.
[8] UK Prospective Diabetes Study Group:Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes(UKPDS 33)[J].Lancet ,1998,352:837.
[9]王冬环.解析糖化血红蛋白测定专家共识[J].中华糖尿病杂志,2014,6(12):849.
[10]IFCC.Approved IFCC reference method for the measurement of HbA1c in human blood[J].Clin Chem Lab Med,2002,40:78.
[11]IFCC:Recommendation for term and measurement unit for “HbA1c”[J].Clin Chem Lab Med,2007,45:1081.
[12]Kaiser P,Akerboom T,Dux L,et al.Modification of the IFCC reference measurement procedure for determination of HbA1c by HPLC-ESI-MS[J].GMS Ger Med Sci,2006,4:Doc06.
[13]Apffel A,Fischer S,Goldberg G,et al.Enhanced sensitivity for peptide mapping with electrospray liquid Chromatography-mass spectrometry in the presence of signal suppression due to trifluoroacetic acid-containing mobile phases[J].Journal of Chromatography A,1995,712:177.
[14]Annesley TM.Ion suppression in mass spectrometry[J].Clin Chem,2003,49:1041.
[15]Kaiser P,Akerboom T,Molnar P,et al.Modified HPLC-electrospray ionization/mass spectrometry method for HbA1c based on IFCC reference measurement procedure[J].Clin Chem,2008,54:1018.
[16]Hoelzel W,Weykamp C,Jeppsson J-O,et al.IFCC reference system for measurement of hemoglobin A1c in human blood and the national standardization schemes in the United States,Japan,and Sweden:A method-comparison study[J].Clin Chem,2004,50:166.
[17]Hermann K,Meinhard J,Dobrev P,et al.1-Aminocyclopropane-l-carboxylic acid and abscisic acid during the germination of sugar beet(Beta vulgaris L.):a comparative study of fruits and seeds[J].J Exp Bot,2007,58(11):3047.
Determination of glycated hemoglobin by pre-column derivatization and HPLC separationWANGDong-huan,ZHOUWei-yan,ZHANGTian-jiao,etal.(NationalCenterforClinicalLaboratory,BeijingHospital,Beijing100730,China)
Abstract:ObjectiveA method for separation and quantification of glycated hemoglobin by pre-column derivatization and HPLC was developed.MethodsHaemoglobin is cleaved into peptides by the enzyme endoproteinase Glu C,the glycated and non-glycated N-terminal hexapeptides of the β chain (HbA1chexapeptides and HbA0hexapeptides)were obtained,separated and quantified of HbA1chexapeptides and HbA0hexapeptides by derivation with p-aminobenzenesulfonic acid and HPLC.The percentage of HbA1cin the sample can be calculated from the peak area ratios for the HbA1cderivative hexapeptides and HbA0derivative hexapeptides.ResultsThe investigation obtain the total coefficients of variation (CV) for sample analysls were 1.61%,1.74% and 0.90%.A standard curve regression equation Y=1005X+7.26,R=0.995 9,The linearity range was 0.3% -15.6% HbA1c.The results on certified reference materials showed bias of -3.81%-3.53%%.ConclusionA highly precise and accurate method for measuring HbA1chas been developed by pre-column derivatization and HPLC.
Key words:Hemoglobin A,glycosylated; peptide; pre-column derivatization; Chromatography,liquid
(收稿日期:2015-01-14)
文献标识码:A
中图分类号:R446.11
文章编号:1007-4287(2015)12-1991-05
*通讯作者
基金项目:国家自然科学基金(项目号:81171665,81201337,81301488)

