肿瘤可溶性抗原联合超抗原致敏的DC诱导CIK对鼻咽癌细胞杀伤作用的研究
李付贵,陈 京,李晓玲,方慧云,季明芳,程伟民*
(1.中山大学附属肿瘤医院,广东 广州510060;2.中山大学附属中山医院肿瘤研究所,广东 中山528400)
肿瘤可溶性抗原联合超抗原致敏的DC诱导CIK对鼻咽癌细胞杀伤作用的研究
李付贵1,2,陈京2,李晓玲2,方慧云2,季明芳2,程伟民2*
(1.中山大学附属肿瘤医院,广东 广州510060;2.中山大学附属中山医院肿瘤研究所,广东 中山528400)
摘要:目的探讨肿瘤可溶性抗原联合超抗原致敏的树突状细胞(dendritic cells,DCs)诱导细胞因子激活的杀伤细胞(cytokine-induced kill cells,CIK)对鼻咽癌细胞CNE-1的体外杀伤作用。方法分离人外周血单个核细胞(peripheral blood mononuclear cell,PBMC),采用GM-CSF、IL-4和TNF-α体外诱导培养DC,采用CD3Ab、IFN-γ、IL-2、IL-1等细胞因子诱导培养CIK细胞。鼻咽癌肿瘤可溶性抗原(tumor soluble antigen,TSA)联合超抗原金黄色葡萄球菌肠毒素C(staphylococcal enterotoxin C,SEC)致敏DC;将未负载抗原的DC、单纯负载鼻咽癌抗原TSA的DC、单纯负载超抗原SEC的DC及负载TSA和SEC的DC分别与CIK细胞共同孵育,诱导产生特异性的细胞毒性T细胞(cyctotoxic T lymphocyte,CTL)(各组效应细胞分别简称为DC-CIK、TSA-DC-CIK、SEC-DC-CIK、TSA-SEC-DC-CIK);采用CCK-8法检测各效应细胞对靶细胞CNE-1的杀伤作用。结果成功培养出高表达HLA-DR、CD1a、CD80的DC;效靶比为50∶1时,TSA-SEC-DC-CIK对靶细胞CNE-1的杀伤率为85.46±2.12%,明显高于DC-CIK(51.36±0.61%)、TSA-DC-CIK(63.15±2.25%)及SEC-DC-CIK(65.32±3.24%)。结论肿瘤可溶性抗原联合超抗原致敏的DC诱导CIK对鼻咽癌细胞有高效特异杀伤作用。
关键词:树突状细胞;超抗原;金黄色葡萄球菌肠毒素C;鼻咽癌
(ChinJLabDiagn,2015,19:1987)
鼻咽癌是我国南方地区和东南亚国家常见的恶性肿瘤之一,发病率达10-50/10万[1]。由于鼻咽癌发病部位比较隐匿,多数患者确诊时已是晚期,常伴淋巴结转移。同期放化疗为晚期鼻咽癌患者的标准治疗模式,但患者5年生存率仅为50%-70%。局部复发和远处转移是治疗失败的主要原因[2-5]。研究证实,在放化疗后,以树突状细胞(dendritic cells,DCs)为基础的细胞免疫治疗可以增强免疫系统的功能,加强抗肿瘤能力,抑制肿瘤生长[6]。本研究采用鼻咽癌肿瘤可溶性抗原(tumor soluble antigen,TSA)联合超抗原金黄色葡萄球菌肠毒素C(staphylococcal enterotoxin C,SEC)致敏DC诱导CIK产生特异性的细胞毒性T细胞(cyctotoxic T lymphocyte,CTL),并探讨其对鼻咽癌细胞的体外杀伤作用,为细胞免疫治疗应用于鼻咽癌治疗提供实验依据。
1材料与方法
1.1材料人鼻咽癌细胞株CNE-1(香港大学提供)。GT-T551无血清培养基(TaKaRa公司),H-DMEM培养基(Hyclone公司),CD3单抗(RD公司),GM-CSF、IL-1、IFN-γ、TNF-α、IL-2、IL-4(美国PEPRO TECH公司),胎牛血清(美国Hyclone公司),人外周血淋巴细胞分离液(天津市灏洋生物制品科技有限公司),cell counting-cit8(CCK-8,日本同仁化学研究所),鼠抗人CD3-FITC、CD8-PE、CD14-FITC、CD1a-PE、HLA-DR-FITC、CD80-PE(美国Beckman公司),超抗原SEC(沈阳协和生物制药股份有限公司)。
1.2方法
1.2.1鼻咽癌细胞培养从液氮中取出人鼻咽癌细胞株CNE-1复苏,以一定密度接种于75 cm2培养瓶中,采用含10%FBS的H-DMEM培养液作为完全培养液,置于37℃,5%CO2饱和湿度培养箱内进行培养。每2-3天换液1次,待细胞达80%融合时,用0.25%胰酶+0.02%EDTA消化,以1∶3的比例传代培养。
1.2.2鼻咽癌可溶性抗原制备将培养3天左右处于对数生长期的CNE-1细胞用0.25%胰酶+0.02%EDTA消化,无菌生理盐水洗涤3次,制备成浓度为1×107-1×108/ml细胞悬液,封装入冻存管。然后置-80℃冰冻2 h,取出立即于37℃水浴30 min,如此反复冻融4次,5 000 r/min,离心40 min,收集上清即为TSA。检测TSA蛋白含量,0.22 μm滤膜过滤,-20℃保存备用。
1.2.3DC的培养与鉴定取健康供者抗凝外周血50 ml,用密度为1.077 g/L的淋巴细胞分离液2 000 r/min离心15 min,收集白膜层,生理盐水漂洗2次,以含10%FBS的GT-T551无血清培养基作为完全培养液,一定密度接种于25 cm2培养瓶中,置于37℃,5%CO2饱和湿度培养箱内培养3 h,去除非贴壁细胞,加入终浓度为1 000 U/ml的GM-CSF、500 U/ml的IL-4及含10%FBS的GT-T551无血清培养基培养扩增,第三天换液补充细胞因子,第5天加入终浓度为50 μg/ml的TSA及10 ng/ml的SEC,第6天加入终浓度为1 000 U/ml的TNF-α,第7天收集DC细胞。光学显微镜观察DC细胞形态。流式检测DC表型。
1.2.4CIK的培养与鉴定收集上一步骤中的未贴壁细胞,一定密度接种于75 cm2培养瓶中,加入终浓度为40 ng/ml的CD3单抗、300 U/ml的IL-2、1 000 U/ml 的IFN-γ、500 U/ml的IL-1及含10%自体血浆的GT-T551无血清培养基作为完全培养液,置于37℃,5%CO2饱和湿度培养箱内培养扩增。光学显微镜观察CIK细胞形态。流式检测细胞表型。
1.2.5DC和CIK混合培养将负载TSA和SEC的DC设为实验组,同时设单纯负载TSA的TSA-DC对照组、单纯负载SEC的SEC-DC对照组和未负载抗原的DC对照组。收集培养7天的四组DC细胞分别与培养7天的CIK细胞按1∶10的比例混合培养,诱导CTL细胞产生。各组效应细胞分别简称为DC-CIK、TSA-DC-CIK、SEC-DC-CIK、TSA-SEC-DC-CIK。光学显微镜观察各组效应细胞形态。流式检测效应细胞表型。
1.2.6细胞杀伤试验以混合培养7天的各组效应细胞,分别作用于靶细胞CNE-1,效靶比分别按10∶1、20∶1和50∶1共同培养,24 h后光镜观察效应细胞对靶细胞的杀伤效果,CCK-8法测定实验孔和对照孔450 nm处光密度(oplical Density,OD)值并计算杀伤率。杀伤率=[1-(实验组OD 值-效应细胞组OD值)/靶细胞组OD值]×100%。
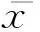
2结果
2.1细胞形态观察从外周血采集的PBMC培养3h后,光镜可见贴壁细胞多为体积较小的单个圆形细胞。经细胞因子GM-CSF、IL-4诱导24h后,可见部分细胞体积增大,悬浮于培养基中;第4天,可见细胞聚集成团,形态不规则。于培养第5天负载TSA和SEC,第6天加入TNF-α诱导成熟后,大部分细胞表面出现树突状突起,呈典型DC形态。未贴壁细胞经CD3单抗、IL-2、IFN-γ、IL-1诱导3d后,光镜可见细胞增殖迅速,大多聚集成细胞团。
2.2细胞表型鉴定DC经流式鉴定,结果显示高表达HLA-DR(99.9%)、CD1a(70.2%)、CD80(97.9%),低表达CD14(0.2%)(图1)。CIK细胞经诱导培养后,高表达CD3+CD56+(29.3%)(图2)。DC和CIK混合培养7天后,流式检测各组CTL细胞表型,发现TSA-SEC-DC-CIK组CD3+CD8+T细胞百分比最高(表1)(P<0.05)。
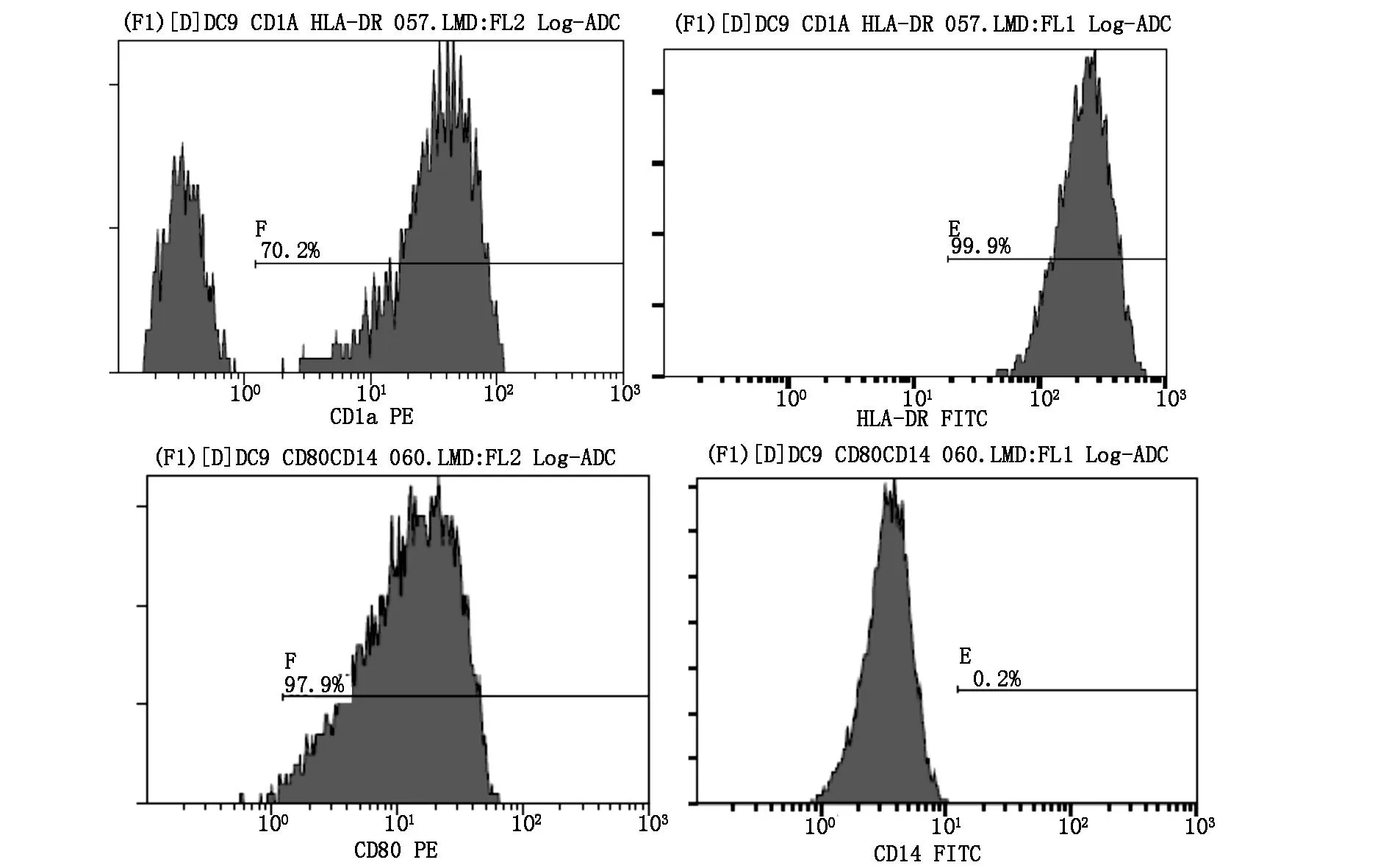
图1 DC细胞高表达CD1a、HLA-DR、CD80,低表达CD14

图2 CIK细胞表型
2.3细胞杀伤试验采用CCK-8法检测细胞杀伤率,结果见表2。由表可看出,在同一效靶比时,TSA-SEC-DC-CIK组对靶细胞CNE-1的杀伤率明显高于DC-CIK组(P<0.05)、TSA-DC-CIK组(P<0.05)及SEC-DC-CIK组(P<0.05),这说明经鼻咽癌TSA及超抗原SEC联合刺激的DC-CIK具有高效而特异性的杀伤作用;各组细胞对靶细胞的杀伤率随着效靶比提高而增强(P<0.05)。

表1 各组CTL细胞表型比较
注:*TSA-SEC-DC-CIK组与其余各组相比,P<0.05。
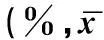
表2 效应细胞对靶细胞的杀伤率比较±s)
注:*TSA-SEC-DC-CIK组与其余各组相比,P<0.05。#效靶比20∶1与效靶比10∶1相比,P<0.05。△效靶比50∶1与效靶比20∶1相比,P<0.05
3讨论
DC是功能最强的抗原提呈细胞,DC可以捕获、加工抗原,迁移到淋巴器官中激活T细胞,尤其是初始T细胞(naïve T cells)和静息T细胞(resting T cells)。T细胞介导的细胞免疫特别是CTL在机体抗肿瘤和抗感染中发挥重要作用[7],利用负载相关抗原的DC作为疫苗进行肿瘤生物治疗大有前景[8]。
金黄色葡萄球菌肠毒素C是一种外源性超抗原,具有高效刺激T细胞增殖、增强免疫功能等生物学活性,它必须先与APC或靶细胞表面的MHC-II类分子抗原结合槽结合为复合体,才能被TCR识别出来提呈给T细胞,使T细胞激活,产生免疫应答。超抗原发挥作用主要表现在以下3个方面。(1)直接激活细胞毒性T细胞,使之杀伤靶细胞(2)被激活的T细胞分泌多种细胞因子,直接或间接杀伤靶细胞(3)借超抗原依赖细胞介导的细胞毒性杀伤靶细胞[9-12]。KatoM[13]研究发现DC联合超抗原能显著提高抗肿瘤免疫。将小鼠骨髓来源DC与肿瘤相关抗原OVA257-264及金葡菌肠毒素SEA、SEB共处理后接种给C57B L/6小鼠,结果显示经过超抗原及肿瘤相关抗原联合致敏修饰的DC疫苗能显著提高CD8+T细胞发挥OVA257-264特异的细胞杀伤活性及IFN-γ的产生,诱导针对EG7(T淋巴细胞瘤细胞)的抗肿瘤免疫。张庆波[14]等研究发现肿瘤可溶性抗原与超抗原SEC联合应用能诱导效应细胞明显增殖、活化,产生高效特异抗肿瘤效果。Yu J[15]采用脂质体将金葡菌肠毒素SEA基因转染至小鼠黑色素瘤细胞B16,在合成宿主体内诱导产生SEA TDLN,与来自母本的野生型TDLN作对照。结果显示,与野生型TDLN细胞相比,采用CD3、CD28及IL-2激活后,SEA TDLN细胞增殖更旺盛,产生更多的IFN-γ,激活更强的CTL反应。此外,DC联合肿瘤抗原及CD3、CD28、IL-2共刺激能提高SEA TDLN细胞的免疫功能及治疗效果。DC刺激的SEA TDLN细胞能清除B16黑色素瘤小鼠90%的肺转移。
本实验从健康供者外周血中分离得到PBMC,在细胞因子GM-CSF、IL-4诱导培养下,得到大量DC,在相差显微镜下呈现典型DC形态,在培养第5天,流式鉴定显示DC高表达未成熟DC细胞表面标志物CD1a,在培养第6天加入TNF-α诱导DC成熟后,在培养第7天收集细胞进行流式鉴定显示DC高表达MHCⅡ类分子HLA-DR、成熟DC表面标志共刺激分子CD80,低表达单核细胞表面标志CD14。Yang HX[16]研究发现负载抗原的DC正是通过DC表面MHCⅡ类分子和共刺激分子将抗原信息呈递给T细胞以产生特异性的抗瘤效应。我们将负载鼻咽癌TSA和超抗原SEC的DC设为实验组,同时设单纯负载TSA的TSA-DC对照组、单纯负载SEC的SEC-DC对照组和未负载抗原的DC对照组。收集培养7天的四组DC细胞分别与培养7天的CIK细胞按1∶10的比例混合培养,诱导CTL细胞产生。混合培养7天后,研究显示TSA-SEC-DC-CIK组CD8+T细胞百分比最高。将四组效应细胞分别与靶细胞CNE-1共培养进行细胞杀伤实验,结果显示TSA-SEC-DC-CIK对靶细胞CNE-1的杀伤率明显高于DC-CIK、TSA-DC-CIK及SEC-DC-CIK。由此可见,经鼻咽癌TSA及超抗原SEC联合致敏DC具有更强大的激活CTL能力,产生更高效特异的抗肿瘤效应。
参考文献:
[1]Cao SM,Simons MJ,Qian CN.The prevalence and prevention of nasopharyngeal carcinoma in China[J].Chin J Cancer,2011,30(2):114.
[2]Lin S,Lu JJ,Han L,et al.Sequential chemotherapy and intensity-modulated radiation therapy in the management of locoregionally advanced nasopharyngeal carcinoma:experience of 370 consecutive cases[J].BMC Cancer,2010,10:39.
[3]Wei KR,Yu YL,YangYY,et al.Epidemiological trends of nasopharyngeal carcinoma in China[J].Asian Pac J Cancer Prev,2010,11(1):29.
[4]Rottey S,Madani I,Deron P,et al.Modern treatment for nasopharyngeal carcinoma:current status and prospects[J].Cur Opin Oncol,2011,23(3):254.
[5]Komatsu M,Tsukuda M,Matsuda H,et al.Comparison of concurrent chemoradiotherapy versus induction chemotherapy followed by radiation in patients with nasopharyngeal carcinoma[J].Anticancer Res,2012,32(2):681.
[6]Casati A.The immunogenicity of dendritic cell-based vaccines is not hampered by doxorubicin and melphalan administration[J].J Immunol,2005,174(6):3317.
[7]Morel PA,Turner MS.Designing the optimal vaccine:the importance of cytokines and dendritic cells[J].Open Vaccine J,2010,3:7.
[8]Koido S,Homma S,Hara E,et al.Regulation of tumor immunity by tumor/dendritic cell fusions[J].Clin Dev Immunol,2010:516768.
[9]郝林,贡震,韩从辉.超抗原靶向抗肿瘤研究进展[J].国际肿瘤学杂志,2008,35(7):486.
[10]Perabo FG,Willert PL,Wirger A,et al.Preclinical evaluation of superantigen(staphylococcal enterotoxin B) in the intravesical immunotherapy of superficial bladder cancer[J].Int J Cancer,2005,115(4):591.
[11]Pumphrey N,Vuidepot A,Jakobsen B,et al.Cutting edge:Evidence of direct TCR alpha-chain interaction with superantigen[J].J Immunol,2007,79(5):2700.
[12]Thamm DH,Kurzman ID,Macewen EG,et al.In tralesionaI lipid complexed cytokine/superantigen immunogene therapy for spontaneous canine tumors[J].Cancer Immunol Immunother,2003,52(8):473.
[13]Kato M,Nakamura Y,Suda T,et al.Enhanced anti-tumorimmunity by superantigen-pulsed dendritic cells[J].Cancer Immunol Immunother,2011,60(7):1029.
[14]张庆波,幺文博,徐卫国,等.可溶性抗原联合超抗原诱导的CTL抗瘤作用的实验研究[J].现代肿瘤医学,2012,20(7):1341.
[15]Yu J,Tian R,Xiu B,et al.Antitumor activity of T cells generated from lymph nodes draining the SEA-expressing murine B16 melanoma and secondarily activated with dendritic cells[J].Int J Biol Sci,2009,5(2):135.
[16]Yang HX,Xu Y.Effect of bladder-tumor lysate on capaciof DCs excreting IL-12[J].Chin J Mod Med,2006,16(16):2433.
Effect of cytokine-induced killer cells induced by dendritic cells pulsed with tumor soluble antigen and superantigen on cytotoxicity against nasopharyngeal carcinoma cellLIFu-gui,CHENJing,LIXiao-ling,etal.(CancerResearchInstitution,ZhongshanAffiliatedHospitalofSunYat-senUniversity,Zhongshan528400,China)
Abstract:ObjectiveTo investigate the killing effect of dendritic cells (DCs) allergized by tumor soluble antigen and superantigen combining with cytokine-induced killer (CIK) cells on human nasopharyngeal carcinoma cell lines CNE-1 in vitro.MethodsPBMCs were isolated from healthy donors and DCs were induced and cultured by GM-CSF,IL-4 and TNF-α,CIK cells were induced by CD3Ab,IFN-γ,IL-2,IL-1.DCs modified by nasopharyngeal carcinoma tumor soluble antigen (TSA) and staphylococcal enterotoxin C (SEC);DCs modified by nothing or DCs modified by TSA or DCs modified by SEC or DCs modified by TSA and SEC were cultivated together with CIK cells,and the obtained cells were named DC-CIK or TSA-DC-CIK or SEC-DC-CIK or TSA-SEC-DC-CIK as effector cells.The anti-tumor activity of every effector cells against target cells was assayed with CCK-8 method.ResultsInduced DCs expressed more CD1a,CD80 and HLA-DR.When the E:T is 50∶1,the killing ratio of the TSA-SEC-DC-CIK in vitro to CNE-1 is 85.46±2.12%,which is higher than DC-CIK(51.36±0.61%),TSA-DC-CIK(63.15±2.25%) and SEC-DC-CIK(65.32±3.24%).ConclusionDCs allergized by tumor soluble antigen and superantigen can induce specific CIK cells which can significantly enhance antitumor effect on nasopharyngealcarcinoma cell.
Key words:Dendritic cell;Superantigen;Staphylococcal enterotoxin C;nasopharyngeal carcinoma
(收稿日期:2015-09-14)
作者简介:李付贵,男,31岁,博士,主管技师,研究方向:干细胞分化机理和肿瘤防治机理。
文献标识码:A
中图分类号:R739.6
文章编号:1007-4287(2015)12-1987-05
*通讯作者
基金项目:广东省自然科学基金博士启动基金(2014A030310013);中国博士后基金(2014M562244);中山市科技计划项目(编号:2014A1FC048)

