转化生长因子β1与乳腺癌微血管密度及预后的相关性
沈叶 徐梅玉 盛友华
(上海市奉贤区中心医院普外科,*病理科,上海 201400)
·论著·
转化生长因子β1与乳腺癌微血管密度及预后的相关性
沈叶徐梅玉盛友华*
(上海市奉贤区中心医院普外科,*病理科,上海201400)
摘要目的:探讨乳腺癌组织中转化生长因子β1(transforming growth factor β1,TGF-β1)与微血管密度(microvessel density,MVD)及乳腺癌预后的相关性。方法: 采用免疫组织化学方法检测62例乳腺癌组织及30例乳腺腺瘤组织中TGF-β1的表达水平,计数MVD,分析二者与乳腺癌病理特征的关系。结合随访资料分析TGF-β1与乳腺癌的复发转移及患者生存率的相关性。结果:乳腺癌组织中TGF-β1蛋白表达的阳性率、MVD计数均明显高于乳腺腺瘤组织(P<0.05);乳腺癌组织中TGF-β1蛋白表达的阳性率随肿瘤直径的增加、临床分期增高及淋巴结转移而增高(P<0.05),且MVD计数与临床分期及淋巴结转移相关(P<0.05)。TGF-β1蛋白表达水平与乳腺癌组织MVD计数呈正相关(r=0.705,P<0.05)。术后5年,TGF-β1蛋白阳性表达患者的生存率明显低于阴性表达患者(P<0.05)。结论:TGF-β1在乳腺癌组织中呈过表达状态且与MVD计数呈正相关,在乳腺癌发生、发展过程中发挥重要作用,有望成为乳腺癌抗血管形成治疗的生物靶点。
关键词乳腺癌;转化生长因子β1;微血管密度;预后
乳腺癌发病率占女性恶性肿瘤的首位,外科手术治疗乳腺癌仍是目前最有效的治疗手段。研究[1]显示,即使是T0~T1、N1~N2等早期乳腺癌患者,其术后5年的复发转移率仍达60%,而肿瘤的侵袭性与转移性是导致患者死亡的主要原因。乳腺癌的生长、转移与肿瘤血管生成密切相关,抑制血管生成已成为乳腺癌治疗的一个新靶点[2]。目前已发现多种血管生成因子,其中转化生长因子β1(transforming growth factor β1,TGF-β1)因其在体内外对血管增殖的作用不一致,一直是临床研究的热点[3-4]。肿瘤微血管密度(microvessel density,MVD)是特定肿瘤区域的微血管计数,是肿瘤侵袭转移潜能的预测指标,但目前针对乳腺癌组织中TGF-β1与MVD间的关系的研究仍较少。本研究拟通过检测乳腺癌组织中TGF-β1的表达,探讨其与MVD及预后的相关性,为乳腺癌的基因靶向治疗提供参考。
1资料与方法
1.1一般资料选择2010年12月—2014年1月在上海市奉贤区中心医院手术并经组织病理学确诊的女性乳腺癌患者62例。入组标准:(1)均保留手术切除的乳腺癌组织标本,并经手术及组织病理学确诊;(2)均为首次确诊,可耐受手术,且术前未接受任何放化疗治疗;(3)排除合并其他部位肿瘤或严重脏器功能不全者。本研究经本院伦理学委员会批准,患者或家属均签署知情同意书。62例患者的年龄40~75岁,平均(53.6±5.8)岁;组织学分型:浸润性导管癌38例,导管内癌19例,浸润性小叶癌5例;根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)分期标准:Ⅰ期23例,Ⅱ期14例,Ⅲ期21例,Ⅳ期4例。同时选择同期收治的30例乳腺腺瘤患者的乳腺组织作为对照组。
1.2方法将乳腺组织标本制作成连续4 μm的组织切片,采用免疫组织化学三步法进行免疫组织化学染色。TGF-β1兔抗人单克隆抗体购自美国Santa Cruz生物技术公司,CD34鼠抗人单克隆抗体购自上海森雄科技实业有限公司,采用已知阳性切片作为阳性对照,以磷酸盐缓冲液代替一抗作为阴性对照。
1.3判定标准
1.3.1TGF-β1免疫组织化学结果的判定标准随机选择5个高倍镜视野,每个视野计数200个细胞,采用半定量计分方法评价[5]。染色强度:无着色为0分;着色弱为1分;着色适中为2分;着色深为3分。阳性细胞比例:着色的阳性细胞数百分比≤5%为0分; 6%~25%为1分; 26%~50%为2分; ≥51%为3分。两项积分乘积≥3分为阳性。
1.3.2MVD的判定标准参照Weidner[6]的方法,在低倍镜(×100)下选择5个肿瘤病灶中染色清晰、微血管最为密集的区域,再切换到高倍镜(×400),计算5个区域的MVD平均值。

2结果
2.1乳腺癌组织与乳腺腺瘤组织中TGF-β1蛋白的表达及MVD计数比较乳腺癌组织TGF-β1蛋白表达的阳性率、MVD计数均明显高于乳腺腺瘤组织,差异均有统计学意义(P<0.05)。见表1。

表1 乳腺癌组织与乳腺腺瘤组织中TGF-β1蛋白表达及MVD计数比较
注:与乳腺腺瘤组织比较,*P<0.05
2.2TGF-β1蛋白表达、MVD计数与乳腺癌临床病理特征的关系乳腺癌组织中TGF-β1蛋白表达的阳性率随肿瘤直径的增加、临床分期增高及淋巴结转移而增高,差异均有统计学意义(P<0.05)。Ⅲ期、Ⅳ期乳腺癌患者MVD显著高于Ⅰ期、Ⅱ期乳腺癌患者,伴有淋巴结转移的乳腺癌患者MVD高于不伴有淋巴结转移的乳腺癌患者,差异均有统计学意义(P<0.05)。见表2。
2.3TGF-β1蛋白表达水平与乳腺癌组织MVD计数的相关性 经Spearman秩相关分析,TGF-β1蛋白表达水平与乳腺癌组织MVD计数呈显著正相关(r=0.705,P<0.05)。
2.4乳腺癌组织TGF-β1蛋白表达与预后的关系 乳腺癌患者术后1、3、5年,TGF-β1蛋白阳性表达与阴性表达患者的复发转移率比较,差异均无统计学意义(P>0.05);术后1、3年,TGF-β1蛋白阳性表达患者的生存率与阴性表达患者比较差异无统计学意义(P>0.05);术后5年TGF-β1蛋白阳性表达患者的生存率明显低于阴性表达患者,差异有统计学意义(P<0.05),见表3。

表2 TGF-β1蛋白表达、MVD计数与乳腺癌临床病理特征的关系
注:不同临床分期、肿瘤直径、有无淋巴结转移比较,*P<0.05
表3乳腺癌组织TGF-β1蛋白表达与预后的关系 (n,%)
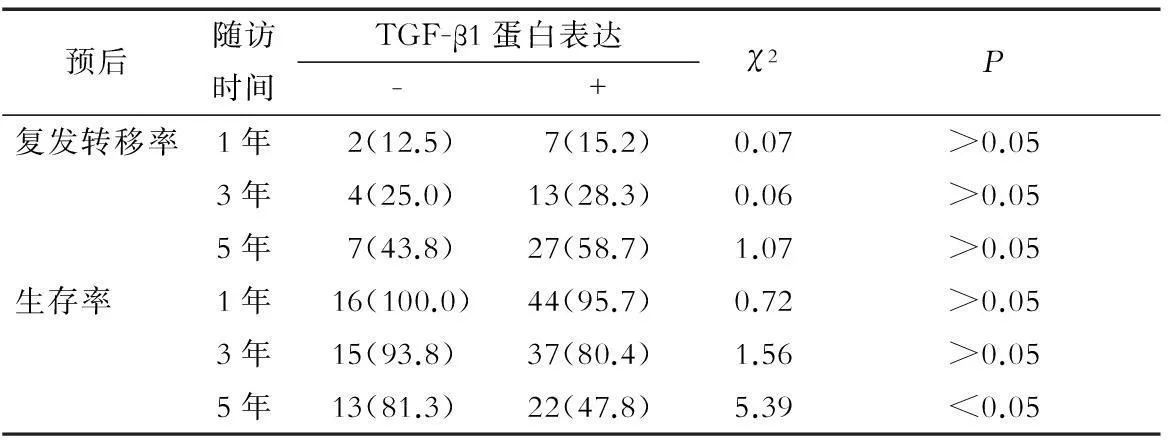
预后随访时间TGF-β1蛋白表达-+χ2P复发转移率1年 2(12.5)7(15.2)0.07>0.053年 4(25.0)13(28.3)0.06>0.055年 7(43.8)27(58.7)1.07>0.05生存率 1年 16(100.0)44(95.7)0.72>0.053年 15(93.8) 37(80.4)1.56>0.055年 13(81.3) 22(47.8)5.39<0.05
注:与TGF-β1蛋白阴性表达患者比较,*P<0.05
3讨论
乳腺癌的生长、转移是一个极为复杂过程,而新生血管的形成是其中不可或缺的环节之一。有研究[7]认为,肿瘤作为典型的血管依赖性病变,肿瘤血管生成对其侵袭性与不良预后具有重要预测价值,同时发现,MVD与肿瘤大小、分期、淋巴结转移及早期死亡密切相关。TGF-β是一种细胞内源性生长抑制因子,可调节多种靶基因的表达,在细胞分化、增殖及凋亡中发挥重要作用,同时因其在肿瘤发生发展过程中的双向调节作用而备受关注[8]。在肿瘤发生的初期,TGF-β1抑制肿瘤形成,而在肿瘤发展过程中则起促进作用[9]。目前,TGF-β1与肿瘤血管形成的关系已有共识,但其与MVD的相关性及对乳腺癌患者预后的预测性研究较少。
本研究结果显示,乳腺癌组织中TGF-β1蛋白表达的阳性率、MVD计数均明显高于乳腺腺瘤组织(P<0.05)。进一步分析发现,乳腺癌组织中TGF-β1蛋白表达的阳性率随肿瘤直径的增加、临床分期增高及淋巴结转移而增高(P<0.05),且MVD计数也与临床分期及淋巴结转移密切相关(P<0.05)。以上说明,随着乳腺癌的进展,TGF-β1的表达水平随之升高,且MVD也参与了新生血管的形成,二者对判断乳腺癌的恶性程度、浸润及转移具有重要价值。Fils-Aimé等[10]研究认为,TGF-β1的高表达促进了癌组织的血管生成,但由于新生血管结构缺乏完整性,基底膜变薄或缺如,易进入血管而发生转移。此外,本研究还发现,TGF-β1蛋白表达水平与乳腺癌组织MVD计数呈显著正相关(P<0.05),TGF-β1的过表达可促进MVD的增高,二者相互协同,为乳腺癌肿瘤细胞的侵袭性生长提供了条件。
目前,临床上对乳腺癌切除后的复发和高转移人群尚缺乏有效的预测指标,故难以在复发前进行相应的治疗。TGF-β1对乳腺癌患者预后的影响尚有争议。Divella等[11]研究指出,TGF-β1过表达预示乳腺癌患者的不良预后,其表达阳性率越高,预后越差。殷科等[12]近期研究发现,TGF-β1与人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性乳腺癌患者预后无明显关系,认为TGF-β信号途径主要通过TGF-β受体发挥作用。本研究中,TGF-β1蛋白阳性表达与阴性表达的乳腺癌患者的复发转移率在术后5年内差异无统计学意义(P>0.05),而术后5年TGF-β1蛋白阳性表达患者的生存率明显低于阴性表达患者(P<0.05),说明TGF-β1对早期预后的影响甚小,但可作为远期不良预后的预测因子。
总之,TGF-β1在乳腺癌组织中呈过表达状态且与MVD计数呈正相关,TGF-β1在乳腺癌发生、发展过程中可能发挥了重要作用,有望成为乳腺癌抗血管形成治疗的重要生物靶点。但本研究样本量较少,TGF-β1能否准确预测乳腺癌患者术后的复发转移及生存时间,尚需进一步研究。
参考文献
[1]Biesaga B, Niemiec J, Ziobro M, et al. Prognostic potential of topoisomerase IIa and HER2 in a retrospective analysis of early advanced breast cancer patients treated with adjuvant anthracycline chemotherapy[J]. Breast, 2011, 20(4):338-350.
[2]Kim MS,You MK,Rhuy DY,et al.Loquat(Eriqbotrya japonica) extracts suppress the adhesion,migration and invasion of human breast cancer cell line[J].Nutr Res Pract,2009,3(4):259-264.
[3]李军川,竺红宇,陈延煊,等.乳腺癌TGF-β1和BRCA2表达与临床因素相关性研究[J].中国医师杂志,2009,11(3):344-346.
[4]Paiva CE,Serrano SV,Paiva BS,et al.Absence of TGF-βRII predicts bone and lung metastasis and is associated with poor prognosis in stage III breast tumors[J].Cancer Biomark,2012,11(5):209-217.
[5]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
[6]Weidner N.Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumor[J].Breast Cancer Res Treat,1996,36(2):169-180.
[7]Juárez P,Guise TA.TGF-β in cancer and bone:implications for treatment of bone metastases[J].Bone,2011.48(1):23-29.
[8]刘春富,李卫,许军,等.乳腺癌组织中转化生长因子-β1和血管内皮生长因子的表达及其与血管生成的关系[J].现代生物医学进展,2014,14(26):5104-5107.
[9]吴韶娜,齐凤杰,方亚.乳腺癌预后与肿瘤相关因子关系研究进展[J].中国公共卫生,2010,26(6):695-697.
[10]Fils-Aimé N,Dai M,Guo J,et al.MicroRNA-584 and the protein phosphatase and actin regulator1(PHACTR1),a new signaling route through which transforming growth factor-β Mediates the migration and actin dynamics of breast cancer cells[J].J Biol Chem,2013,288(17):11807-11823.
[11]Divella R,Daniele A,Savino E,et al.Circulating levels of transforming growth factor-βeta (TGF-β) and chemokine(C-X-C motif) ligand-1(CXCL1) as predictors of distant seeding of circulating tumor cells in patients with metastatic breast cancer[J].Anticancer Res,2013,33(4):1491-1497.
[12]殷科,郭宇.转化生长因子βⅡ受体与人表皮生长因子受体2阴性乳腺癌患者预后的关系[J].中国临床药理学杂志,2014,30(4):306-308.
Correlation of Transforming Growth Factor β1 with Microvessel Density and Prognosis in Breast Cancer
SHENYeXUMeiyuSHENGYouhua*DepartmentofGeneralSurgery,*DepartmentofPathology,ShanghaiFengxianDistrictCentralHospital,Shanghai201400,China
AbstractObjective:To explore the correlation of the expression of transforming growth factor β1(TGF-β1) in breast cancer tissues with the microvessel density(MVD) in breast cancer tissues, as well as the prognosis of breast cancer patients. Methods: The expression of TGF-β1 in the tissues of breast cancer(n=62) and breast fibroadenoma(n=30) were detected with immunohistochemical staining, and the MVD was counted. The correlation of the two factors with the pathological features were analyzed.The influence of TGF-β1 on recurrence, metastasis and survival rate were analyzed in combination with the follow-up data. Results: The positive expression rate of TGF-β1 protein and the count of MVD in breast cancer tissues were significantly higher than those in breast fibroadenoma tissues (P<0.05).The positive expression rate of TGF-β1 protein in breast cancer tissues increased as the increase of tumor diameter,clinical stage,lymph node metastasis(P<0.05),and the count of MVD was correlated with clinical stage and lymph node metastasis(P<0.05).The expression level of TGF-β1 protein was positively correlated with the count of MVD in breast cancer tissues (r=0.705,P<0.05).The 5-year survival rate in patients with positive expression of TGF-β1 was significantly lower than those with negative expression of TGF-β1(P<0.05). Conclusions: TGF-β1 is overexpressed in breast cancer tissues and is positively correlated with the count of MVD. TGF-β1 plays an important role during the process of occurrence and development in breast cancer, and it is a potential biological target for anti-angiogenesis therapy in breast cancer.
Key WordsBreast cancer;Transforming growth factor β1;Microvessel density;Prognosis
通讯作者汪强,E-mail:wq.516@163.com
中图分类号R737.9
文献标识码A

