利用啤酒糟固体发酵产虫草菌素的研究
羊 悦,祝燕燕,杨胜利
(浙江工业大学药学院,浙江 杭州 310014)
虫草素(Cordycepin)是Cunningham 等在1951 年从蛹虫草的培养滤液中得到的第一个从真菌里分离出来的核苷类抗生素[1],是冬虫夏草的有效成分,也是虫草中特有的成分[2]。虫草素作为一个细胞毒性物质具有抗癌、抑制病毒、抑菌、抑制蛋白激酶等作用[3-8],在治疗白血病、降血脂血糖及十大恶性疾病的临床治疗上有着广阔的应用前景。
目前,虫草素的来源主要包括从天然或人工培养的子实体中提取,发酵培养的菌丝体及发酵液中提取以及化学法合成。受野生虫草生存环境的特殊性、寄主专一性及滥采滥挖的影响,野生虫草资源日益枯竭,因此从野生虫草中提取虫草素成本高昂且含量少,不足以满足市场需求。化学合成技术路线复杂且产生大量对环境有害的物质。随着发酵技术的发展,通过菌种发酵产虫草菌素的技术也日益成熟,主要可分为固体发酵和液体发酵。相比于液体发酵固体发酵具有能耗低、设备技术简易、废水废渣少等优点。
啤酒糟(Brewer’s spent grain,BSG)俗称为麦糟,是麦芽和大米、淀粉等辅料经过糊化、糖化、过滤糖化醪后分离得到的一种不溶性残渣,是啤酒工业的主要副产物,是一种低成本的食品级废弃物。其主要成分为麦芽壳,含丰富的粗蛋白和粗纤维,可以作为食用菌生长的培养基[9-11]。
迄今,国内外许多学者对虫草菌的液体深层培养进行了大量的研究,但对于固体发酵虫草菌的研究较少。本研究拟对利用啤酒糟为基质固体发酵产虫草素的培养基条件进行探索及优化。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株
尖头北虫草,购自梁山正大食用菌研究所。
1.1.2 培养基
斜面培养基:蛋白胨10.0 g/L,葡萄糖40 g/L,琼脂15 g/L,氯霉素0.1 g/L;种子培养基:葡萄糖10 g/L,K2HPO4·3H2O 0.5 g/L,KH2PO40.5 g/L,L-甘氨酸1.0 g/L,MgSO4·7H2O 0.5 g/L,氯霉素0.1 g/L;
1.2 方法
1.2.1 培养方法:
斜面培养:挑取保藏的虫草菌种菌丝体接种于斜面,22 ℃恒温培养7~10 d,至菌丝体布满斜面。
种子液培养:将活化后的斜面接种于种子培养基中,在22 ℃,170 r/min 的摇床条件下振荡培养7 d,至培养基中有均匀分布的松散菌丝体。
固体发酵:将烘干至恒重的啤酒糟粉末与水混合均匀作为初始固体培养基,121 ℃灭菌30 min,冷却待用。将培养好的种子液以10%(v/w)接种量接入固体培养基中,在22 ℃下进行恒温发酵培养。
取样:发酵完的固体培养物取出与真空干燥箱中烘干至恒重,经研磨后得待测样品粉末。样品中虫草素的含量用HPLC 法检测。
1.2.2 含水量的筛选
调整啤酒糟粉末与水的料水比(50%、55%、60%、65%、70%、75%、80%、85%),使培养基湿重为50 g。在无菌操作下每瓶接种5 mL 种子液。在暗处萌发菌丝至菌丝长满后进行光照培养。以虫草素的积累量为指标,选出最佳含水量。
1.2.3 碳源及其浓度的筛选
在确定最佳含水量的固体发酵培养基基础上,对培养基的碳源进行优化。实验中分别以20 g/L 蔗糖、葡萄糖、麦芽糖、淀粉、甘露醇为唯一碳源加入营养液,在无菌操作下每瓶接种5 mL种子液。以虫草素的积累量为指标,选出最适碳源,后在最适碳源基础上对其浓度进行一系列优化。
1.2.4 氮源及其浓度的筛选
在最适碳源及其浓度的基础上分别以20 g/L的蛋白胨、豆粕、牛肉膏、酵母膏、硫酸铵作为唯一氮源加入营养液,在无菌条件下每瓶接种量5 mL 以虫草素的积累量为指标,选出最适氮源,后在最适氮源基础上对其浓度进行优化。
1.2.5 无机盐的筛选
在上述优化后的培养基基础上,设置6 种无机盐作为6 个因素,进行6 因素2 水平的正交试验,对比不同无机盐对虫草素在啤酒糟固体培养基上的积累的影响,实验因素和水平见表1。
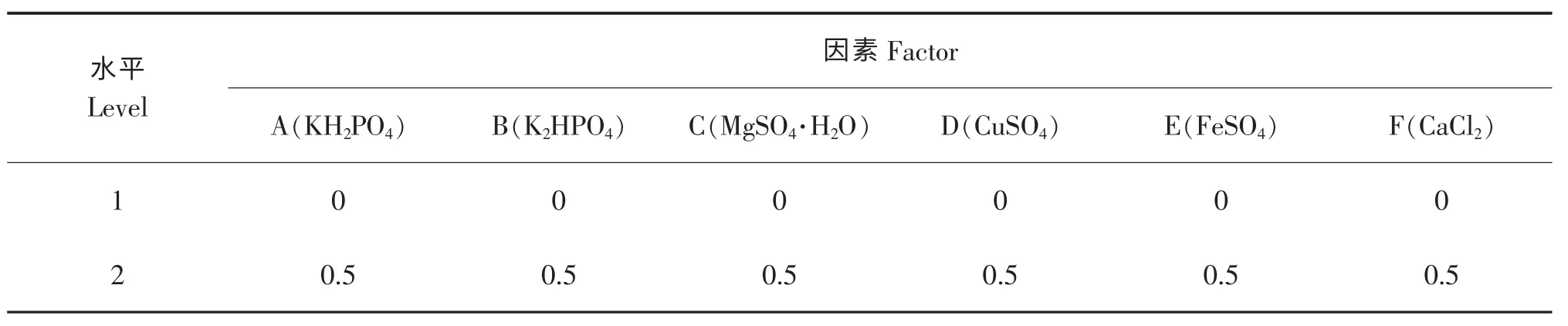
表1 无机盐优化正交实验Table 1 orthogonal dsign for inorganic salts
1.3 试验样品中虫草素含量的检测
取发酵后的基质,经低温干燥至恒重后粉碎,精密称取0.5 g 加10 mL 蒸馏水,冰水浴超声提取60 min,离心分离上清液后经双层0.45 μm水系膜过滤,用HPLC 测定。
色谱条件:Ecilipse XDB-C18(5 μm,4.6×250 mm);流动相:甲醇:水=15:85;柱温:30 ℃;紫外波长:259 nm;进样量:10 μL。
2 结果与分析
2.1 不同含水量对虫草素积累的影响
图1 为不同含水量条件下固体培养基基质中虫草素含量的柱状图,结果显示,不同浓度的含水量对虫草素含量的积累存在不同的作用。在含水量较低时,菌丝体生长速度较快(数据未体现),但菌丝体呈现较稀疏,不浓密的状态且不利于代谢产物虫草素的积累。随着含水量浓度的增加,培养基中的虫草菌丝体生长旺盛有活力,同时虫草素含量也相应的呈现增加趋势。其中,在含水量65%、70%、75%时有较大量的虫草素,分别为1761±129.25 μg/g、2137±31.7 μg/g 和2460±214.1 μg/g。当培养基中含水量增加80%以上时,培养基中虫草素的积累量出现迅速下降的趋势,说明过高浓度的含水量并不适宜虫草素的积累。
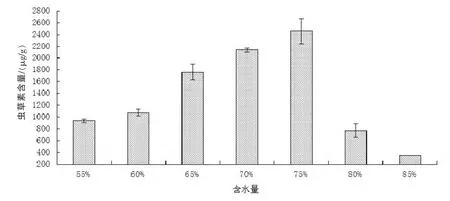
图1 含水量对虫草素积累量的影响Fig 1 .Effects of moisture content on cordycepin accumulation by SSF
2.2 碳源对虫草素积累的影响
在65%、70%、75%含水量的固体培养基中不同碳源种类对虫草素产量的影响结果如图2 所示。结果表明,淀粉对虫草素积累量较其他碳源具有优势。且随着培养基中含水量的增加呈现先上升后下降的趋势,在70%含水量时有最大虫草素积累量2102.4±103.3 μg/g。蔗糖、麦芽糖及甘露醇虽也能促进的虫草素积累,但由于其原料价较淀粉高,因此实验中选取淀粉为唯一碳源,加入70%含水量的培养基。
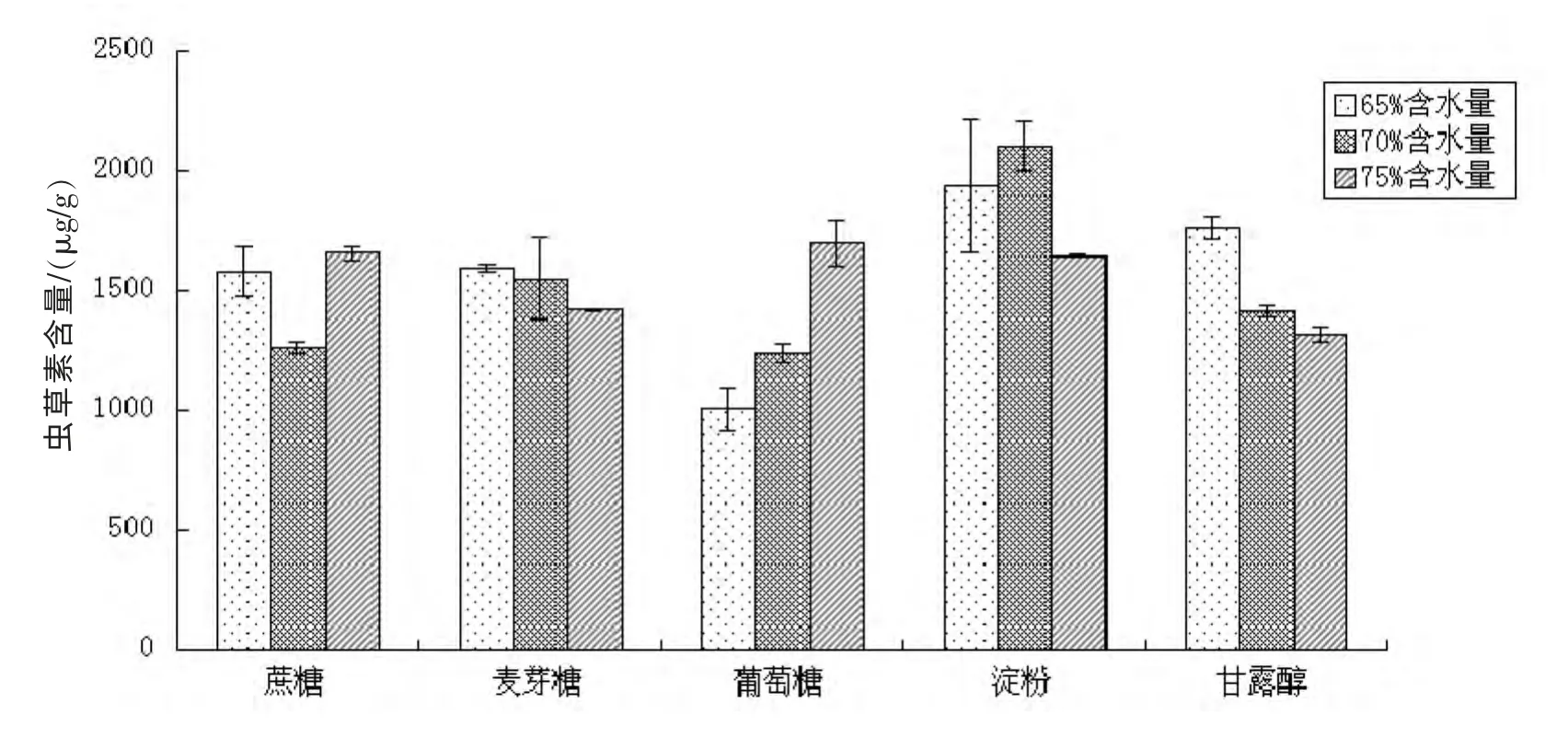
图2 不同含水量条件下碳源对虫草素积累量的影响Fig 2 .Effects of various carbon sources on cordycepin accumulation by SSF
碳源浓度优化结果如图3 可知,虫草素的积累量随着淀粉添加浓度的升高而升高,在添加量为2%时有最大积累量1873.0±97.67 μg/g,随后随着淀粉浓度的上升呈下降趋势。故实验中选取2%的淀粉浓度作为辅助碳源的添加浓度。
2.3 氮源对虫草素积累的影响
实验过程中,分别选取相同浓度的硫酸铵、蛋白胨、牛肉膏、酵母膏及豆粕作为唯一氮源加入培养基中,结果如图4 可知,有机氮类较适宜虫草素的积累,其中以蛋白胨的效果最好,虫草素积累量为2179.2±339.98 μg/g,促进作用明显高于其他几种有机氮源。硫酸铵作为实验中添加的无机氮源,虽然也能促进培养基中虫草素的积累,但其效果均不如有机氮类,因此选择蛋白胨作为固体发酵培养基中的辅助氮源。

图3 碳源浓度对虫草素积累量的影响Fig 3 .Effects of initial carbon concentration on cordycepin accumulation by SSF
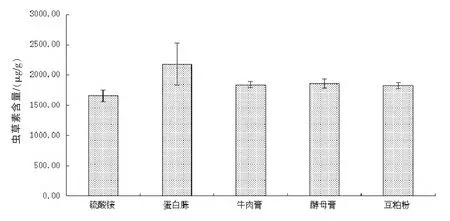
图4 氮源对虫草素积累量的影响Fig 4 .Effects of various nitrogen sources on cordycepin accumulation by SSF
在氮源浓度优化实验中分别选取0.5%、1%、2%、3%、4%、5%的蛋白胨浓度进行实验,结果如图5 所示,虫草素的积累量随着辅助氮源的添加量的增加而增加,其中在蛋白胨的添加浓度为1%时,有虫草素的积累较大值4330.16±521.71 μg/g,当蛋白胨浓度继续增大时,虫草素积累量随之减少,故实验选取1%浓度的蛋白胨作为辅助氮源的添加浓度。
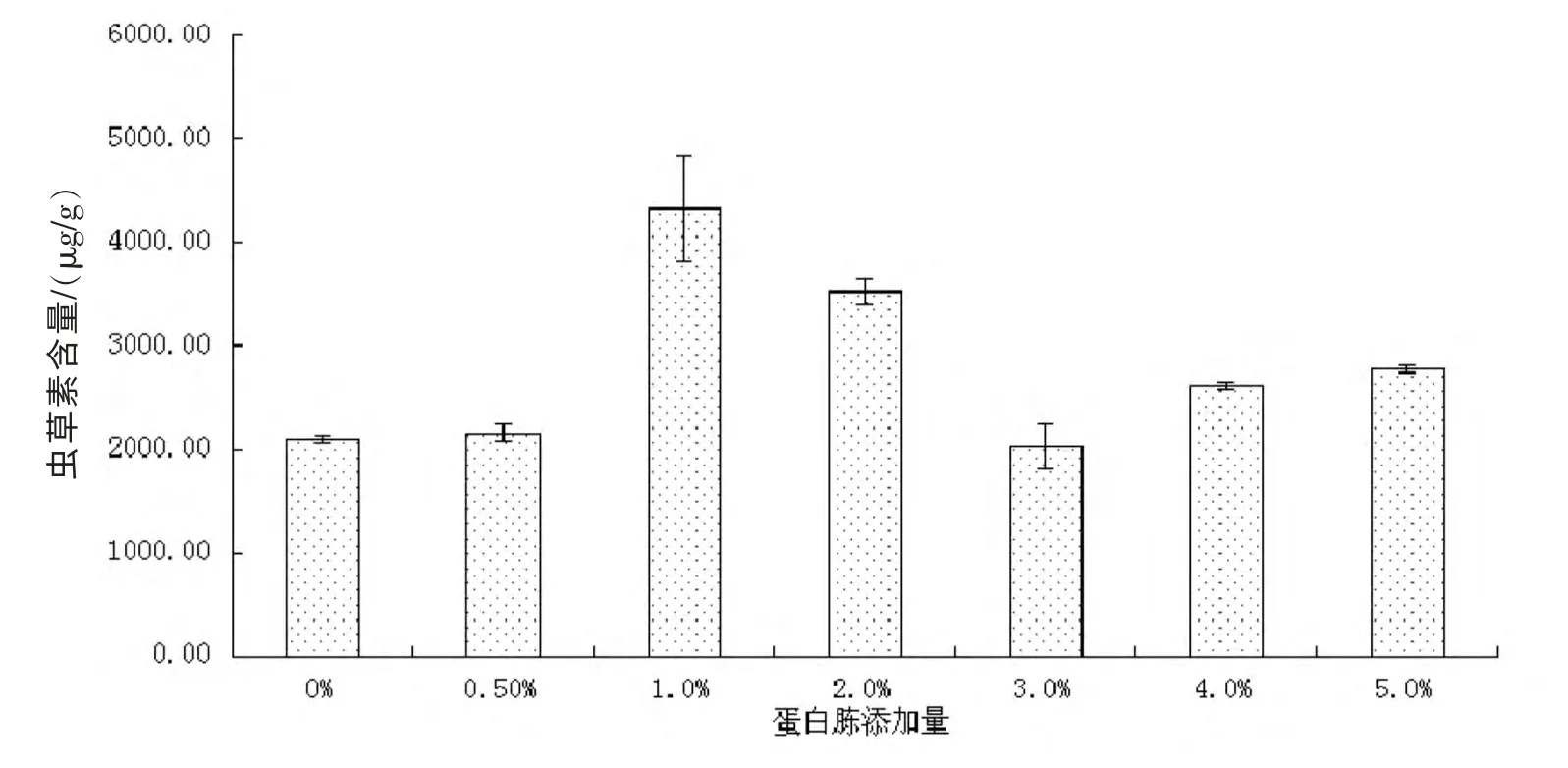
图5 氮源浓度对虫草素积累量的影响Fig 5 .Effects of initial nitrogen concentration on cordycepin accumulation by SSF
2.4 无机盐对虫草素积累的影响

表2 L8(26)正交实验结果及极差分析表(x±s)Table 2 Results and analysis of orthogonal design for inorganic salts

表3 无机盐方差分析表T able 3 Analysis of variance for inorganic salts
结果表明,无机盐对虫草素积累量的影响表现为FeSO4(E)>K2HPO4(B)>CuSO4(D)>MgSO4·7H2O(C)>CaCl2(F)>KH2PO4(A),最佳配比为A2B2C1D1E1F1,即在培养 基中加入0.5 g/L 的KH2PO4和0.5 g/L 的K2HPO4。
因此,最适虫草素积累的培养基组成为:70%含水量,2%淀粉,1%蛋白胨,0.05% KH2PO4和0.05% K2HPO4。在此培养基条件下有虫草素积累量5000.48±213.3 μg/g。
3 结论
在虫草菌固体培养阶段,过低或过高的含水量都不利于虫草素的积累。含水量过低会影响营养物质向细胞的传输及菌体形态;含水量过高则会影响菌体的生长速度,降低菌体对杂菌的抵抗能力,易染菌或导致菌体老化或窒息死亡。
碳源和氮源也是菌体生长中必不可少的重要物质:氮源是合成细菌蛋白质,特别是核蛋白的重要物质,也是细胞核、细胞浆和其他的基本结构的氮的来源。而碳源也是微生物生存、生长发育、新陈代谢的不可缺少的物质,是构成生物体中有机酸、糖类、DNA、RNA、脂类等的一个主要原料。啤酒糟虽然含有丰富的营养成分,但并不能很快的被菌体吸收利用,通过向固体培养基中加入一定量的辅助碳源及辅助氮源可有助于菌体细胞的生长,利于对酒糟中营养成分的吸收。优化结果表明:不同含水量条件下加入相同质量的碳源的虫草菌素的产量有不同的影响,在70%含水量,2%淀粉,1%蛋白胨,0.05% KH2PO4和0.05% K2HPO4条件下,有较高的虫草素的积累。
[1]Cuningham K G,Hutchinson S A,Manson W,et al.Cordycepin,a metablic product from cultures of Cordyceps militaris(Linn.)link,PartⅠ:isolation and characterisation[J].Journal of the Chemical Society(Resumed),1951:2299-2300.
[2]张平,朱述钧,蒋宁,等.北冬虫夏草功能成分及保健作用分析[J].江苏农业科学,2003,6:106-107.
[3]丁向萍,马力,魏书堂,等.虫草素诱导人肝癌HepG-2细胞凋亡及对端粒酶活性影响的研究[J].中华肿瘤防治杂志,2008,15(2):109-113.
[4]Kubo E,Sato A,Yoshikawa N,et al.Effect of cordyceps sinensis on TIMP-1 secretion from mouse melanoma cell[J].Central European Journal of Biology,2012,7(1):167-171.
[5]Choi S,Lim M H,Kim K M,et al.Cordycepin induced apoptosis and autophagy in breast cancer cells are independent of the estrogen receptor [J].Toxicology and Applied Pharmacology,2011,257(2):165-173.
[6]韦会平,肖波,胡开治,等.蛹虫草药用价值考[J].中药材,2004,3:15.
[7]Suger A M,McCaffrey R P.Antifungal activity of 3'-deoxyadenosine [J].Antimicrob Agents Chemother,1998,42(6):1424-1427.
[8]马力,丁向萍.虫草素抗肿瘤机制研究进展[J].第四军医大学学报,2009,30(8):764-766.
[9]潘真清,陈涛.利用啤酒糟深层液体培养风尾菇产木聚糖酶的初步研究[J].安徽工程科技学院学报,2010,25(2):30-32.
[10]梁向忠,占文辉.啤酒糟种植平菇新技术[J].长江蔬菜,1996(3):34-35.
[11]朱斌,颜延宁.啤酒糟发酵牛粪栽培双孢菇的研究[J].北方园艺,2010(9):199-200.

