(S)-3-{[2'-氰基联苯-4-基]甲基}缬氨酸甲酯盐酸盐合成工艺改进
金 灿,臧永军,俞传明
(浙江工业大学药学院 绿色制药技术与装备教育部重点实验室,浙江 杭州 310014)
缬沙坦(valsartan)是第一个不含咪唑环的非肽类血管紧张素P 受体拮抗剂,其拮抗活性强、半衰期长,副作用小,耐受性好,服用方便,为目前抗高血压药方面的首选药物[1-3]。随着越来越多的医学研究的证明,缬沙坦的临床应用已经从高血压的治疗阶段发展到对冠心病、糖尿病、肾病、心力衰竭等全面心血管疾病的干预阶段[4-6]。
(S)-3-{[2'-氰基联苯-4-基]甲基}缬氨酸甲酯盐酸盐是合成缬沙坦的关键中间体,文献[7-8]报道的合成方法主要以L-缬氨酸甲酯盐酸盐和4'-溴甲基-2-氰基联苯为原料,以有机碱或无机碱为缚酸剂,在有机溶剂中反应得到。其合成过程中存在反应时间长、收率低、杂质多、后处理复杂等问题,因而开发出一种新的合成工艺解决上述问题具有重大意义。
本文采用球磨方法合成(S)-3-{[2'-氰基联苯-4-基]甲基}缬氨酸甲酯盐酸盐,该方法具有反应时间短、条件温和、收率高、操作简便等特点,合成过程中未使用有机溶剂,是一种较好的绿色合成方法[9]。
1 实验部分
1.1 仪器与试剂
B-540 型电热熔点仪(温度未校正);Varian_400 型核磁共振仪(CDCl3)为溶剂,TMS 为内标;Thermo Finnigan LCQ Advantage 质谱仪;QM-3A 高速摆振球磨机。
2-氰基-4-溴甲基联苯、L-缬氨酸甲酯盐酸盐为工业品,其余所用试剂均为分析纯。
1.2 合成方法
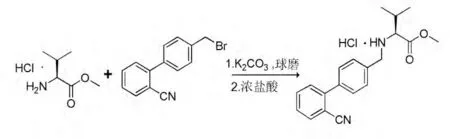
Scheme 1 化合物的合成路线
实验步骤:向球磨罐中依次加入适量钢珠,硅胶(4.00 g),2-氰基-4-溴甲基联苯2.73 g(10 mmol),L-缬氨酸甲酯盐酸盐1.68 g(10 mmol),无水K2CO32.76 g(20 mmol),密封球磨罐,将球磨罐放入球磨反应器中室温反应20 min。反应过程用TLC 监测。
实验后处理方法:向反应后的球磨罐中加入乙酸乙酯(20 mL),适当搅拌后过滤,滤饼用乙酸乙酯洗涤(10 mL×2)洗涤。滤液用蒸馏水(15 mL×2)洗涤。有机层减压浓缩至约剩10 mL,冰浴下向乙酸乙酯层中滴加浓盐酸调节溶液pH 至2~3,维持冰浴搅拌1 h,有大量白色产品析出。过滤烘干得产品2.97 g,收率92% 。
产品数据表征:白色固体,mp:179.2 ℃~181.8℃。1H-NMRδ(ppm):10.97(s,1H),9.96(s,1H),7.77~7.79(d,J=8 Hz,2H),7.75 J 7.89(m,2H),7.56~7.60(m,4H),4.37(s,2H),3.76(s,3H),3.54(d,1H),2.72(m,1H),1.16(d,J=6.8 Hz,3H),1.13(d,J=7.2 Hz,3H);ESI-MS:m/z:323.1{[M+H]+}。
2 结果与讨论
2.1 助磨剂对反应的影响

表1 助磨剂以及用量对反应收率的影响
考察了助磨剂对反应的影响,结果如表1 所示。不加助磨剂时,大量原料不反应,原因是因为产物为油状液体,在无助磨剂条件下与底物粘黏,底物不能充分有效接触。使用硫酸钠和氯化钠为助磨剂时,收率偏低,可能是因为与同质量的硅胶相比,前两者体积较小,接触不充分,底物易发生粘黏。而用氯化钙做助磨剂收率很低,原因可能是氯化钙遇到反应产生的液体易结块,导致后面反应很难进行。硅胶的用量对反应也有影响,当用量少时,底物不能充分接触,收率低;当用量过多时,反应体系中浓度降低,收率也会降低。最后确定硅胶用量为4 g 时最适宜。
2.2 缚酸剂对反应的影响

表2 缚酸剂以及用量对反应收率的影响
考察了缚酸剂对反应的影响,不加缚酸剂时,反应无法进行。使用NaOH 时,碱性太强,导致杂质增加,产率稍低;使用NaHCO3,碱性太弱,产率不高;综合Na2CO3与K2CO3来看,K2CO3效果最好。而当K2CO3用量低于2.0 eq 时,反应不充分,收率较低;当K2CO3用量大于2.0 eq 对反应结果基本没影响。故最后确定使用2.0 eq 的K2CO3做缚酸剂。
2.3 反应时间对反应的影响

表3 反应时间对反应的影响率的影响
考察了反应时间对反应的影响,可以看出,反应时间为20 min 时,收率最高。时间较短,反应不充分,收率低;而当时间超过20 min 时,产率变化不大,甚至降低,可能是因时间过长,产物稳定性差,副产物增加,导致总收率降低。
3 结论
本文实现了对缬沙坦关键中间体(S)-3-{[2'-氰基联苯-4-基]甲基}缬氨酸甲酯盐酸盐的一种新的制备方法,该方法反应时间短,条件温和,产物产率高,操作简便,环境友好,是一种较好的绿色合成方法,对工业化生产有较高的参考价值。
[1]Bühlmayer P,Boehm F,Criscione L,et al.Valsartan,a potent,orally active angiotensin II antagonist developed from the structurally new amino acid series[J].Bioorg.Med.Chem.Lett.,1994,4(1):29-34.
[2]Beutler U,Matthias B,Fuenfschilling P C,et al.A highthroughput process for valsartan [J].Org.Process Res.Dev.,2007,11:892–898.
[3]Goossen L J,Melzer B.Synthesis of valsartan via decarboxylative biaryl coupling [J].J.Org.Chem.,2007,72:7473-7476.
[4]Chen X Z,Guo J Z,Fu Q B,et al.A simple and efficient synthesis of the valsartan [J].Chinese Chemical Let ters,2008,19 :759-761.
[5]Nie Y Y,Da Y J,Zheng H,et al.Synthesis and biological evaluation of novel potent angiotensin II receptor [J].Bioorganic &Medicinal Chemistry,2012,20:2747-2761.
[6]Aalla S,Gilla G,Bojja Y,et al.An efficient and telescopic process for valsartan,an angiotensin II receptor blocker[J].Org.Process Res.Dev.,2012,16:682-686.
[7]Ghosh S,Kumar A S,Soundararajan R,et al.Improved synthesis of via nucleophilic aromatic substitution on aryloxazoline[J].Synthetic Communications,2009,39:3880-3887.
[8]N S K,Reddy B K,Sinha B K,et al.New and improved manufacturing process for valsartan[J].Org.Process Res.Dev.,2009,13:1185-1189.
[9]朱兴一,陈媛媛,苏为科.球磨法促进芳香醛与丙二睛的Knoevenagel 缩合反应[J].浙江化工,2014,45(10):39-42.

