毛细管电泳法测定L-谷氨酰胺呱仑酸钠颗粒中2种主成分的含量Δ
周 洁,左利民,王智亮,姜 威,任连杰,山广志#(.中国医学科学院医药生物技术研究所,北京 00050;.潍坊市人民医院,山东 潍坊 604;.北京市药品检验所,北京 0005)
L-谷氨酰胺呱仑酸钠颗粒(L-glutamine and sodium gualenate granules,商品名:麦滋林)是日本寿制药株式会社生产的以L-谷氨酰胺与呱仑酸钠为主成分的复方制剂,主要用于治疗口腔溃疡[1]、胃炎、胃溃疡和十二指肠溃疡[2]等疾病。
因L-谷氨酰胺与呱仑酸钠极性不同,且含量相差悬殊,同时测定二者含量相对困难。在L-谷氨酰胺呱仑酸钠颗粒进口注册标准[3]中,分别采用定氮法和高效液相色谱(HPLC)法对L-谷氨酰胺与呱仑酸钠的含量进行测定。另有文献报道,利用紫外分光光度法[4]、反相高效液相色谱(RP-HPLC)[5]法等方法检测呱仑酸钠含量,采用HPLC法[6]、纸层析法[7]、毛细管电泳法[8]等方法以及借助氨基酸自动分析仪[9]检测L-谷氨酰胺的含量。最近有研究人员采用离子对HPLC法,以乙腈-0.05%癸烷磺酸钠溶液为流动相,实现了L-谷氨酰胺呱仑酸钠颗粒中L-谷氨酰胺与呱仑酸钠含量的同时测定[10]。
毛细管电泳法以绿色、经济、环保、简便等特点广泛应用于药物分析的各个领域,尤其适合带电物质的分离,是传统RP-HPLC方法的有效补充。本文尝试采用成本低、柱效高的毛细管电泳法同时测定L-谷氨酰胺呱仑酸钠颗粒中2种主要成分的含量,以为国内产品的药品标准提高,以及极性较强且酸碱性相差悬殊的复方制剂的开发、质量研究与控制提供参考和借鉴。
1 材料
P/ACE MDQ毛细管电泳系统(美国Beckman Coulter有限公司);CP214型电子天平(美国奥豪斯仪器有限公司);Integral 10型超纯水仪(德国Merck Millipore公司);无涂层石英毛细管柱(河北永年光导纤维厂);Seven Easy S20 pH计(瑞士梅特勒-托利多有限公司)。
L-谷氨酰胺对照品(美国Agilent Technologies有限公司,批号:BCBG1414V,纯度:100.0%);呱仑酸钠对照品(日本寿制药株式会社,批号:I07N,纯度:100.6%);L-谷氨酰胺呱仑酸钠颗粒样品(日本寿制药株式会社,批号:S49P、S56Q,规格:0.67 g/袋,每袋含L-谷氨酰胺663.3 mg、呱仑酸钠2.0 mg);十水合四硼酸钠、硼酸均为分析纯,水为超纯水。
2 方法与结果
2.1 电泳条件
色谱柱:采用无涂层石英毛细管柱(总长度60.2 cm,有效长度50 cm,内径50 μm);运行缓冲液:40 mmol/L硼砂缓冲液(pH=9.22);样品缓冲液:4 mmol/L硼酸缓冲液(pH=6.97);温度:20 ℃;进样方式:压力进样;进样压力:0.5 psi;进样时间:5 s;分离电压:15 kV;检测波长:220 nm。
试验前石英毛细管柱分别用0.1 mol/L氢氧化钠冲洗20 min,超纯水冲洗5 min,运行缓冲液冲洗5 min,以保证毛细管柱充分清洗并平衡。每次进样前依次用0.1 mol/L氢氧化钠、超纯水、运行缓冲液各冲洗3 min,以保证待测样品的重复性。
2.2 溶液的配制
2.2.1 运行缓冲液(空白溶液)的配制 称取十水合四硼酸钠380.0 mg,加100 ml超纯水溶解,摇匀,调pH至9.22,用0.22 μm滤膜过滤,即得40 mmol/L运行缓冲液。
2.2.2 样品缓冲液的配制 称取硼酸120.0 mg,加500 ml超纯水溶解,摇匀,调pH至6.97,用0.22 μm滤膜过滤,即得4 mmol/L样品缓冲液。
2.2.3 系列混合对照溶液的制备 称取呱仑酸钠对照品25.0 mg,置于50 ml量瓶中,加样品缓冲液溶解并稀释至刻度,摇匀,用0.22 μm滤膜过滤。称取L-谷氨酰胺对照品332.5 mg,置于25 ml量瓶中,精密加入上述呱仑酸钠溶液2.0 ml,加样品缓冲液溶解并稀释至刻度,即得含13.30 mg/mlL-谷氨酰胺与40.0 μg/ml呱仑酸钠的混合对照品贮备液。精密量取上述对照品贮备液适量,加样品缓冲液逐级稀释至L-谷氨酰胺质量浓度分别为13.30、6.650、3.325、0.665 0、0.332 5 mg/ml,呱仑酸钠质量浓度分别为40.0、20.0、10.0、2.00、1.00 μg/ml的系列混合对照溶液。
2.2.4 供试品溶液的制备 分别称取批号为S49P、S56Q的2批L-谷氨酰胺呱仑酸钠颗粒样品0.670 0 g,分别置于100 ml量瓶中,加样品缓冲液溶解并稀释至刻度,摇匀,用0.22 μm滤膜过滤;精密量取5.0 ml,置于10 ml量瓶中,加样品缓冲液稀释至刻度,摇匀,即得。
2.3 系统适用性试验
精密吸取空白溶剂(样品缓冲液)、3.325 mg/mlL-谷氨酰胺与10.0 μg/ml呱仑酸钠的混合对照品溶液和批号为S56Q的供试品溶液,分别注入毛细管电泳仪检测。色谱见图1。结果,L-谷氨酰胺对照品迁移时间为6.6 min,呱仑酸钠对照品迁移时间为7.9 min;空白溶液在相应位置未见色谱峰,不干扰L-谷氨酰胺和呱仑酸钠的测定。
2.4 线性范围考察
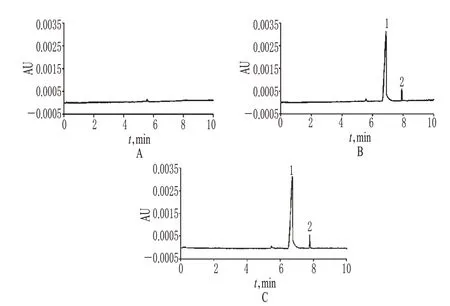
图1 毛细管电泳色谱图A.空白溶液;B.混合对照品溶液;C.供试品(S56Q)溶液;1.L-谷氨酰胺;2.呱仑酸钠Fig 1 Capillary electrophoresis chromatogramsA.blank solution;B.mixed reference solution;C.test sample(S56Q)solution;1.L-glutamine;2.sodium gualenate
取L-谷氨酰胺与呱仑酸钠的系列混合对照溶液适量,分别按“2.1”项下电泳条件进样,记录色谱峰,以质量浓度(x,mg/ml)为横坐标、峰面积(y)为纵坐标进行线性回归,得L-谷氨酰胺和呱仑酸钠的回归方程为y=1.34×10-4x-0.12(r=0.998 3),y=8.26×10-4x+0.36(r=0.999 3)。结果表明,L-谷氨酰胺和呱仑酸钠质量浓度分别在0.332 5~13.30、1.00~40.0 μg/ml范围内与各自峰面积呈良好的线性关系。
2.5 检测限和定量限
以信噪比为10计算最低定量限(LOQ),以信噪比为3计算最低检出限(LOD)。结果,L-谷氨酰胺的LOQ为66.50 μg/ml,LOD为33.25 μg/ml;呱仑酸钠的LOQ为1.00 μg/ml,LOD为0.500 μg/ml。
2.6 精密度试验
取含有5.50 mg/mlL-谷氨酰胺与16.0 μg/ml呱仑酸钠的混合对照品溶液,按“2.1”项下电泳条件,连续进样5次,记录峰面积。结果,L-谷氨酰胺峰面积的RSD为2.53%(n=5),呱仑酸钠峰面积的RSD为1.55%(n=5),表明仪器精密度良好。
2.7 稳定性试验
精密量取同一批样品(批号:S49P)适量,按“2.2.4”项下方法制备供试品溶液,分别于室温下放置0、2、4、6、8 h时按“2.1”项下电泳条件进样,记录峰面积。结果,L-谷氨酰胺峰面积的RSD为2.83%(n=5),呱仑酸钠峰面积的RSD为1.73%(n=5),表明供试品溶液在8 h内稳定性良好。
2.8 加样回收率试验
精密量取“2.2.4”项下供试品溶液5.0 ml(批号:S49P)共9份,置于10 ml量瓶中,分别加入质量浓度为5.50 mg/ml的L-谷氨酰胺与16.0 μg/ml的呱仑酸钠混合对照品溶液各1.8、3.0、4.2 ml,加样品缓冲液稀释至刻度,摇匀,每个质量浓度平行3份。按“2.1”项下电泳条件进样,计算加样回收率,结果详见表1。
2.9 样品含量测定
取2批供试品(批号:S49P、S56Q),按“2.2.4”项下方法制备供试品溶液,按“2.1”项下电泳条件,分别进样测定,按外标法计算2批样品中L-谷氨酰胺与呱仑酸钠的含量。结果,批号为S49P的供试品中含L-谷氨酰胺占标示量的100.3%,含呱仑酸钠占标示量的100.0%;批号为S56Q的供试品中含L-谷氨酰胺占标示量的103.2%,含呱仑酸钠占标示量的109.0%。该结果与按进口注册标准方法检测所得结果基本一致。
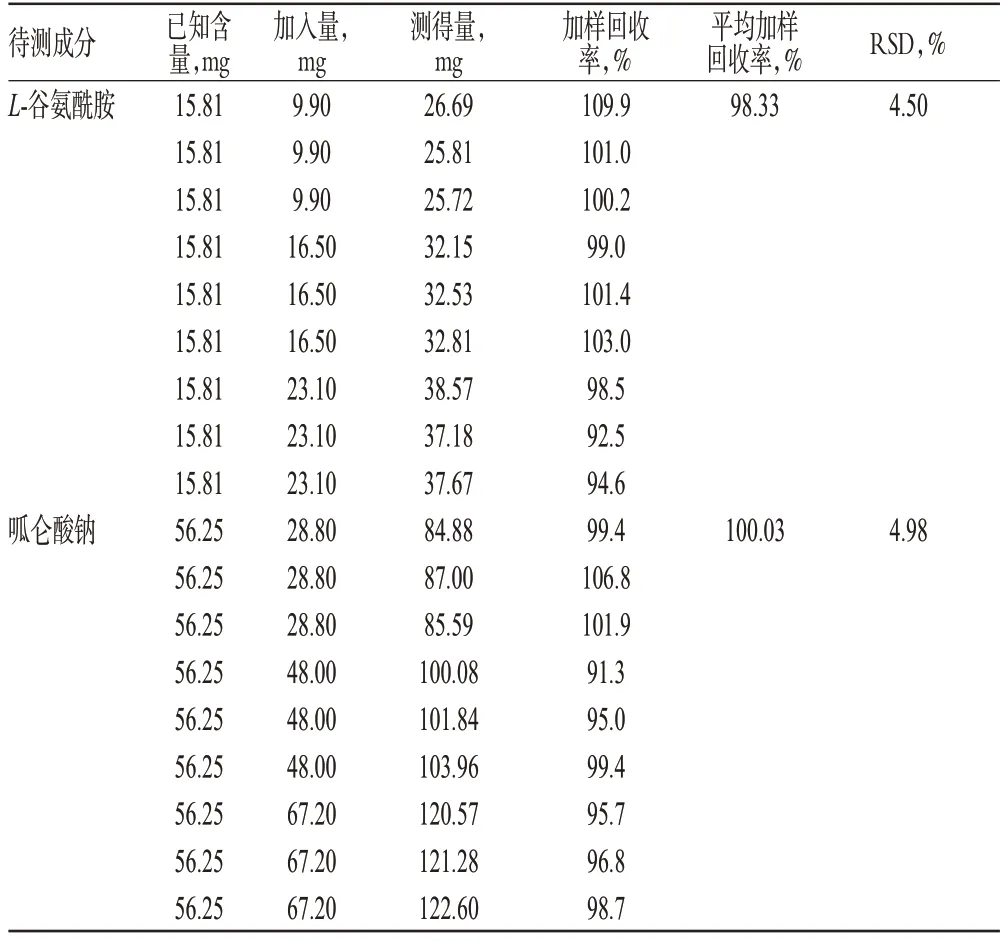
表1 加样回收率试验结果(n=9)Tab 1 The result of recovery test(n=9)
3 讨论
3.1 检测方法的选择
L-谷氨酰胺和呱仑酸钠在水溶液中分别带正电荷和负电荷,两者极性均较大,难以用传统的RP-HPLC法进行分离。本文采用毛细管电泳法,依靠电泳和电渗两种作用,利用40 mmol/L硼砂缓冲液(pH=9.22),使极性相反的L-谷氨酰胺和呱仑酸钠得到了良好的分离和检测。
3.2 检测波长的选择
呱仑酸钠在246、293、370 nm波长处均有最大特征吸收峰,通常选择290 nm作为其检测波长[7],但L-谷氨酰胺在此波长下无紫外吸收。为了满足呱仑酸钠与L-谷氨酰胺的同时测定,故选择较低的220 nm波长作为本研究的检测波长,保证了二者响应良好,实现了L-谷氨酰胺与呱仑酸钠的同时检测。
3.3 运行缓冲液pH的选择
硼酸盐缓冲液因pH缓冲范围较宽、紫外吸收较低而成为毛细管电泳试验中较常用的分离缓冲体系。本试验结合L-谷氨酰胺与呱仑酸钠的pKa值对运行缓冲液浓度及其pH进行选择和优化。最终,选择40 mmol/L硼砂缓冲液(pH=9.22)作为本研究运行缓冲液。
3.4 样品缓冲液pH的选择
利用毛细管电泳检测时,要求样品缓冲液电导值≤运行缓冲液电导值,以促使电泳区带聚焦,获得良好峰形[13]。本试验利用4 mmol/L硼酸缓冲液(pH=6.97)作为样品缓冲液,其浓度为运行缓冲液浓度的1/10。样品缓冲液电导值<运行缓冲液电导值,可使待测物保持良好峰形;同时,能确保样品缓冲液pH与运行缓冲液pH保持一定的差异,以利于样品分离和检测。
3.5 分离电压的选择
分离电压可直接影响电渗流、迁移时间、灵敏度和分离度等因素[13-14]。本试验比较了10、15、20 kV分离电压对L-谷氨酰胺与呱仑酸钠分离度的影响。结果表明,随着分离电压的增大,L-谷氨酰胺与呱仑酸钠的迁移时间减小,同时L-谷氨酰胺峰展宽;当电压为15 kV时,2种成分具有良好的分离度、迁移时间较短,且基线平稳,峰形相对较好。因此,确定分离电压为15 kV。
综上所述,本文建立的毛细管电泳法操作简便、准确性高、专属性强,能够满足复方制剂中L-谷氨酰胺与呱仑酸钠含量的同时测定。
[1]陈红,白学敏,孙建枢,等.麦滋林-S口腔溃疡膜剂的研制及其质量控制[J].中国临床药学杂志,2006,15(2):120.
[2]彭兴盛,叶晓霞.麦滋林颗粒剂中奥磺酸钠的HPLC测定[J].中国医药工业杂志,2005,36(6):361.
[3]国家食品药品监督管理局.L-谷氨酰胺呱仑酸钠颗粒进口注册标准:JX20030254[S].2003.
[4]佟爱东,李薇,廖燕玲,等.分光光度法测定麦滋林-S颗粒中水溶性奥的含量[J].药物分析杂志,1994,14(5):55.
[5]张占辉,刘庆彬,薄海静,等.高效液相色谱法测定呱仑酸钠的含量及有关物质[J].药物分析杂志,2001,21(5):339.
[6]Arnal JF,Münzel T,Venema RC,et al.Interactions between L-arginine and L-glutamine change endothelial NO production.An effect independent of NO synthase substrate availability[J].J Clin Invest,1995,95(6):2 565.
[7]王霞,张伟国.发酵液中L-谷氨酰胺的定性定量测定[J].食品与生物技术学报,2008,27(6):111.
[8]Kaneta T,Maeda H,Miyazaki M,et al.Determination of amino acids in urine by cyclodextrin-modified capillary electrophoresis-laser-induced fluorescence detection[J].J Chromatogr Sci,2008,46(8):712.
[9]Van Loon LJ,Saris WH,Verhagen H,et al.Plasma insulin responses after ingestion of different amino acid or protein mixtures with carbohydrate[J].Am J Clin Nutr,2000,72(1):96.
[10]张帆,罗域城.反相高效液相色谱法同时测定L-谷氨酰胺呱仑酸钠颗粒中L-谷氨酰胺和呱仑酸钠的含量[J].药物分析杂志,2010,30(8):1 448.

