基于胃镜的个体化诊断在幽门螺杆菌根除中应用研究*
张灵云 宋志强 周丽雅 张建中 丁 钰
(北京大学第三医院消化科,北京 100191)
·临床论著·
基于胃镜的个体化诊断在幽门螺杆菌根除中应用研究*
张灵云①宋志强***周丽雅**张建中②丁 钰
(北京大学第三医院消化科,北京 100191)
目的 探讨基于胃镜的个体化根除治疗在幽门螺杆菌感染初治和复治患者中的疗效、安全性和依从性。方法 2013年3月~2014年6月于我院行胃镜检查并明确幽门螺杆菌感染的患者,胃镜下取胃黏膜标本进行幽门螺杆菌菌株培养、药物敏感性试验和细胞色素P450同工酶2C19基因型检测。根据克拉霉素是否敏感选用克拉霉素或替硝唑,基因型为快、慢及中间代谢型分别选用雷贝拉唑或埃索美拉唑,联合阿莫西林组成三联方案,疗程10天,治疗结束后4~12周复查尿素呼气试验,确定幽门螺杆菌感染是否被成功根除。 结果 共318例初治和62例复治患者幽门螺杆菌培养成功,接受个体化治疗,培养成功率分别为90.9%(318/350)和91.2%(62/68),纳入意向性分析;最终298例初治和59例复治患者完成治疗和随访,纳入遵循方案分析。幽门螺杆菌感染初治及复治患者的根除率,意向性分析分别为88.7%(95%可信区间为85.2%~92.1%)和75.8%(65.1%~86.5%),遵循方案分析分别为93.3%(89.9%~96.0%)和79.7%(69.7%~89.7%)。2组不良反应发生率分别为22.0%(70/318)和33.9%(21/62),依从性分别为94.3%(300/318)和95.2%(59/62)。 结论基于胃镜的个体化治疗在幽门螺杆菌感染初治患者中根除率较为理想,而在复治患者中疗效欠佳。
幽门螺杆菌; 根除率; 个体化方案; 抗生素耐药; 胃镜
尽管幽门螺杆菌(Helicobacterpylori,Hp)的研究已经开展30余年,但由于相关抗生素的耐药率迅速明显升高[1],Hp感染的临床根除越来越困难,疗效越来越差[2]。为了应对这一严峻形势,国内外纷纷更新了Hp诊治指南。欧洲幽门螺杆菌学组的Maastricht Ⅳ共识意见[3]推荐在克拉霉素高耐药地区使用经典铋剂四联方案、序贯方案和伴同方案;而我国第四次幽门螺杆菌诊治共识意见[4]推荐使用质子泵抑制剂(proton pumper inhibitor,PPI)、铋剂、两种抗生素的四联方案。然而近年来的临床研究结果显示,目前没有一种方案能够符合疗效满意(遵循方案分析根除率90%以上)、安全性好、临床能够广泛应用的标准。而在复治患者中,Hp感染根除治疗更加困难。
Hp感染最佳的治疗方案应根据其菌株抗生素耐药情况和影响PPI代谢的细胞色素P450同工酶2C19(CYP2C19)相关基因多态性来选择药物,进行有针对性的个体化治疗,才能取得更好且持久的根除效果。我国胃镜检查普及率很高,为胃镜下取材从而进行个体化Hp感染根除提供了便利条件。目前这方面的研究还较少。在现今耐药形势异常严峻、经验性治疗策略难以取得良好持久疗效的背景下,个体化治疗具有很重要的临床价值和意义。
因此,本研究的主要目的是探讨以胃镜为指导的个体化Hp感染根除治疗在初治和复治患者中的疗效,次要目的是观察其安全性和依从性。
1 材料与方法
1.1 研究对象
2013年3月~2014年6月因消化不良症状于北京大学第三医院内镜中心行胃镜检查的患者,年龄18~70岁,男女不限,存在Hp现症感染,被征集入组。排除标准:①入组前4周曾服用可能影响研究结果的药物,如PPI、H2受体阻滞剂、铋剂或抗生素等;②消化道恶性肿瘤;③上消化道手术;④严重的心、肺、肾、血液、肝脏、神经、精神或内分泌系统疾病;⑤对本研究中所用药物过敏;⑥孕妇或哺乳妇女;⑦合并其他可能增加治疗副反应的医学状况。
1.2 研究设计
本研究通过北京大学第三医院伦理委员会审批[(2013)医伦审第(132-2)号],遵循赫尔辛基宣言,严格按照临床研究相关方案开展。所有受试者均签署知情同意书。
经过充分知情同意后,由医务人员询问患者一般人口学数据及医学病史,胃镜下取胃黏膜标本进行Hp菌株培养和CYP2C19基因型检测。Hp菌株培养成功后,行药物敏感性检测。所获信息将指导个体化药物选择进行Hp根除治疗。
1.3 研究方案
1.3.1 Hp检测、培养和药敏检测 所有符合条件的患者入组后均行胃镜检查,取胃窦小弯侧黏膜行快速尿素酶试验(HPUT-H102,福建三强,中国)。若快速尿素酶试验阳性,考虑患者为Hp现症感染。从胃窦及胃体各取一块胃黏膜标本放入同一培养瓶中行Hp菌株培养。Hp菌株培养成功后,在体外采用E试验方法检测抗生素敏感性[5]。抗生素耐药界值:阿莫西林和克拉霉素均≥1.0 μg/ml,甲硝唑≥8.0 μg/ml。
1.3.2 CYP2C19基因多态性检测[6]采用实时PCR分析CYP2C19的突变基因(Qiagen,Düsseldorf,Nordrhein-Westfalen,德国)。检测野生型基因(CYP2C19*1)和2个突变的等位基因(CYP2C19*2和CYP2C19*3):没有突变基因(*1/*1)为快代谢型;只有一个突变基因(*1/*2或*1/*3)为杂合子中间代谢型;有2个突变基因(*2/*2,*3/*3或*2/*3)为慢代谢型。
1.3.3 治疗方案 个体化治疗方案依据克拉霉素的敏感性及CYP2C19基因类型选药(具体用药见表1)。初治组和复治组均采用同样的用药原则、方法。

表1 个体化治疗方案Table 1 Regimens of tailored therapy
hom EM,快代谢,homozygous extensive metabolizer;het EM,中间代谢,heterozygous extensive metabolizer;PM,慢代谢,poor metabolizer;bid,每日2次;tid,每日3次
治疗结束后1~3天电话随访,评价不良反应及依从性。治疗结束4~12周后复查13C呼气试验(UCBT Kit,原子高科,北京,中国),若呼气试验阴性,考虑Hp感染根除成功[7]。
1.3.4 安全性和依从性评价 副反应评估采用开放性问题,由患者以自我汇报的方式采集数据。依从性通过患者遵医嘱服用的药片数量计算[8],依从性(%)=(实服药片数/应服药片数)×100%。依从性≥80%被认为依从性好;依从性不足80%则被认为依从性差,不计入遵循方案分析。
1.4 统计学分析
2 结果
共350例初治和68例复治患者同意参加本研究并进行Hp菌株培养,最终318例初治和62例复治患者Hp菌株培养成功,接受个体化治疗。初治和复治患者培养成功率分别为90.9%(318/350)和91.2%(62/68)。药敏结果显示复治患者克拉霉素及甲硝唑的耐药率高,初治组和复治组患者的基线资料见表2。复治组既往根除次数1~5次,中位数1次,根除方案为三联6例,四联17例,其他39例。
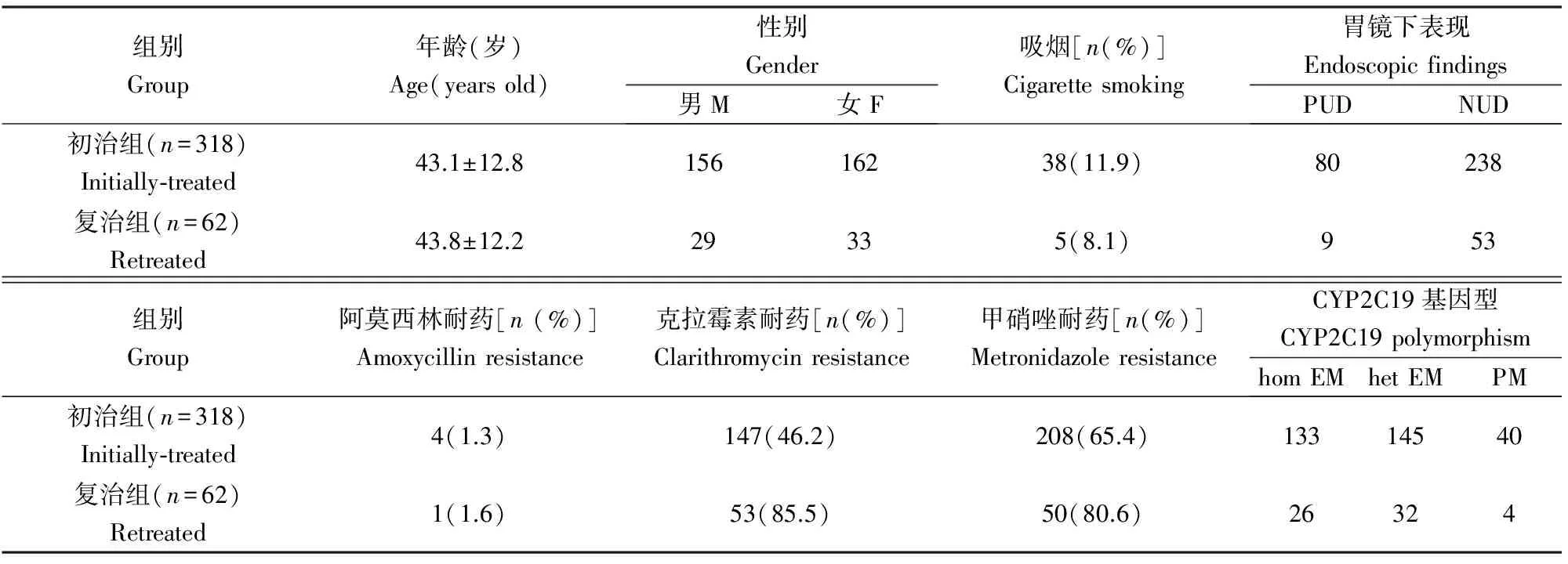
表2 基线资料Table 2 Baseline characteristics
PUD, 消化性溃疡, peptic ulcer disease; NUD, 非溃疡性消化不良, non-ulcer dyspepsia; hom EM, 快代谢, homozygous extensive metabolizer; het EM, 中间代谢, heterozygous extensive metabolizer; PM, 慢代谢,poor metabolizer
在318例初治患者中,298例遵循研究方案完成治疗和随访,6例失访、4例无法耐受药物不良反应、3例违反试验方案和7例依从性差而未纳入遵循方案分析。在62例复治患者中,59例遵循研究方案完成治疗和随访,1例失访、1例违反试验方案和1例依从性差而未纳入遵循方案分析。
在初治患者中,个体化治疗意向性分析和遵循方案分析的根除率分别为88.7%和93.3%;但在复治患者中,个体化治疗的根除率较低,意向性分析和遵循方案分析的根除率分别仅为75.8%和79.7%(表3)。
在不良反应和依从性方面,初治组和复治组患者的不良反应总发生率为22.0%(70/318)和33.9%(21/62),依从性分别为94.3%(300/318)和95.2%(59/62)(表4)。

表3 根除率Table 3 Eradication efficacy
95%CI:95%可信区间,95% confidence interval
3 讨论
在我国,由于Hp菌株抗生素耐药现象严重、缺乏有效的经验性治疗方案,个体化治疗可能是未来最有效而持久的治疗方法。胃镜检查在中国十分普及,这为基于胃镜的个体化方案的诊治提供了有利的条件。而鉴于Hp菌株培养及CYP2C19代谢基因型检测条件的限制,目前关于个体化方案的研究较少。

表4 不良反应[n(%)]Table 4 Adverse events
影响Hp根除效果的因素很多,其中最重要的是抗生素耐药(特别是克拉霉素)和CYP2C19代谢基因型的不同[9],本研究的个体化方案就是着眼于这两个方面。我们之前的研究结果[10]显示,如果Hp菌株对克拉霉素敏感,标准三联方案的根除率依然能够达到90%,因此本研究中对克拉霉素敏感患者仍然选择标准三联方案。但若是克拉霉素耐药,根除率就会明显减低[11,12]。因此,在克拉霉素耐药患者中,我们选择替硝唑代替克拉霉素。尽管硝基咪唑类抗生素的耐药率较高,但有研究显示增加其应用频率和剂量,在一定程度上可以克服耐药[3]。本研究中,我们将替硝唑的用药频率增加为每日3次。
仅仅调整替硝唑的作用可能还不够有效,我们同时调整了阿莫西林。阿莫西林是时间依赖性抗生素,若是每日增加口服频次为3次或4次,有利于其血浆浓度持续高于Hp的最低有效抑菌浓度,因此其根除效果也会优于每日2次的用药方式[13];但鉴于每日4次的用药方式会影响患者的用药依从性[14],本研究采用阿莫西林用药频率为每日3次。
为了使PPI能有较好的抑制胃酸的效果,对于CYP2C19快代谢型患者,多建议将PPI剂量加倍或是选用非酶代谢途径的雷贝拉唑来提高其抑酸效果。但对于CYP2C19中间代谢及慢代谢型患者,CYP2C19基因类型对PPI的抑酸效果影响较小[15]。但在中国目前的社会保险政策下,PPI只能以标准剂量每日2次应用。因此,本研究对于CYP2C19中间代谢型及慢代谢型患者,选用目前在中国应用最广的埃索美拉唑每次20 mg,每日2次;而对于CYP2C19快代谢型患者,则选用非酶代谢途径的雷贝拉唑每次10 mg,每日2次。
本研究结果显示,在初治患者中,基于胃镜的Hp感染个体化治疗取得了较好的疗效,意向性分析和遵循方案分析的根除率分别为88.7%和93.3%,说明这种个体化治疗方案对一线治疗的患者是有效的。但在复治患者中,个体化治疗的根除率较低,意向性分析和遵循方案分析的根除率均不足80%,难以令人满意。这可能主要是由于复治人群对克拉霉素及甲硝唑的广泛高耐药率所致。在本研究中,复治患者只有15%对克拉霉素敏感,其余均对克拉霉素耐药,很明显对于这样小比例的对克拉霉素敏感的人群,检测克拉霉素的耐药性必要性不大,经济学上也不划算,因此在Hp复治患者中,可默认为克拉霉素耐药,而避免应用克拉霉素。而对于克拉霉素耐药的复治患者,尽管我们将阿莫西林及替硝唑的剂量均增加至每日3次,根除率依然不足80%。因此,该个体化方案的复治根除率总体不理想。对于复治患者,Maastricht Ⅳ的推荐方案为含铋剂的标准四联及含左氧氟沙星的三联方案[3],但在中国,由于四环素在临床很难获得、喹诺酮类药物的明显高耐药率[1,4],这些方案均不适合;在目前个体化方案效果也不佳的情况下,迫切需要进一步的临床研究探索新的根除Hp的药物及方案。
因为中国的社会保险政策限制,对于CYP2C19快代谢型的患者,我们应用雷贝拉唑(非酶代谢途径)来代替埃索美拉唑。但是,近期的研究显示雷贝拉唑的代谢也会在一定程度受到CYP2C19基因类型的影响,其抑酸效果并不一定比埃索美拉唑更好[16,17]。因此,对于快代谢型的患者,选择增加PPI的剂量或频率可能更为合适。本研究中,我们选择经典的方法(Hp培养和E试验)来检测克拉霉素的耐药性,这种方法相对耗时,而且对检测设备条件要求高、培养假阴性率高,很难在临床中推广。近年来,随着分子学的快速发展,基因学检测克拉霉素的耐药类型已经显出准确、快速和敏感的优势[18,19]。一些研究已经证实了基因方法的检测结果和经典的检测方法一致性好[20,21]。我们计划在以后临床研究中应用更为简单可行的基因检测方法来明确克拉霉素的耐药性,在临床中指导个体化方案的诊断及治疗。
总之,本研究中对基于胃镜的个体化根除方案重新进行了评估,结果显示其对于初治患者显示了较好的疗效,但在复治患者中疗效欠佳。本研究所有入选的患者都有抗生素药敏及CYP2C19基因多态性的信息,使我们的结果更为可靠,有利于指导临床治疗方案的选择,也非常有利于我们对根除失败原因的分析。
1 Song Z,Zhang J,He L,et al.Prospective multi-region study on primary antibiotic resistance of Helicobacter pylori strains isolated from Chinese patients.Dig Liver Dis,2014,46(12):1077-1081.
2 Graham DY,Fischbach L.Helicobacter pylori treatment in the era of increasing antibiotic resistance.Gut,2010,59(8):1143-1153.
3 Malfertheiner P,Megraud F,O’Morain CA,et al.Management of Helicobacter pylori infection-the Maastricht IV/Florence Consensus Report.Gut,2012,61(5):646-664.
4 中华医学会消化病学分会幽门螺杆菌学组,全国幽门螺杆菌研究协作组.第四次全国幽门螺杆菌感染处理共识报告.中华内科杂志,2012,51(10):832-837.
5 Liu G,Xu X,He L,et al. Primary antibiotic resistance of Helicobacter pylori isolated from Beijing children.Helicobacter, 2011, 16(5):356-362.
6 Yamada S,Onda M,Kato S,et al.Genetic differences in CYP2C19 single nucleotide polymorphisms among four Asian populations.J Gastroenterol,2001,36(10):669-672.
7 Treiber G,Wittig J,Ammon S,et al.Clinical outcome and influencing factors of a new short-term quadruple therapy for Helicobacter pylori eradication: a randomized controlled trial (MACLOR study).Arch Intern Med,2002,162(2):153-160.
8 Lesaffre E,de Klerk E.Estimating the power of compliance-improving methods.Control Clin Trials,2000,21(6):540-551.
9 Rimbara E,Fischbach LA,Graham DY.Optimal therapy for Helicobacter pylori infections.Nat Rev Gastroenterol Hepatol,2011,8(2):79-88.
10 Zhou L,Zhang J,Chen M,et al.A comparative study of sequential therapy and standard triple therapy for Helicobacter pylori infection:a randomized multicenter trial.Am J Gastroenterol,2014,109(4):535-541.
11 Megraud F.The challenge of Helicobacter pylori resistance to antibiotics:the comeback of bismuth-based quadruple therapy.Therap Adv Gastroenterol,2012,5(2):103-109.
12 Fischbach L,Evans EL.Meta-analysis:the effect of antibiotic resistance status on the efficacy of triple and quadruple first-line therapies for Helicobacter pylori.Aliment Pharmacol Ther,2007,26(3):343-357.
13 Furuta T,Sugimoto M,Yamade M,et al.Effect of dosing schemes of amoxicillin on eradication rates of Helicobacter pylori with amoxicillin-based triple therapy.J Clin Pharmacol,2014,54(3):258-266.
14 O’Connor JP,Taneike I,O’Morain C.Improving compliance with helicobacter pylori eradication therapy: when and how?Therap Adv Gastroenterol,2009,2(5):273-279.
15 Furuta T,Graham DY.Pharmacologic aspects of eradication therapy for Helicobacter pylori Infection.Gastroenterol Clin North Am,2010,39(3):465-480.
16 Hunfeld NG,Touw DJ,Mathot RA,et al.A comparison of the acid-inhibitory effects of esomeprazole and rabeprazole in relation to pharmacokinetics and CYP2C19 polymorphism.Aliment Pharmacol Ther,2012,35(7):810-818.
17 Sugimoto M,Shirai N,Nishino M,et al.Rabeprazole 10 mg q.d.s. decreases 24-h intragastric acidity significantly more than rabeprazole 20 mg b.d. or 40 mg o.m.,overcoming CYP2C19 genotype.Aliment Pharmacol Ther,2012,36(7):627-634.
18 Furuta T,Shirai N,Kodaira M,et al.Pharmacogenomics-based tailored versus standard therapeutic regimen for eradication of H. pylori.Clin Pharmacol Ther,2007,81(4):521-528.
19 Sugimoto M,Furuta T.Efficacy of tailored Helicobacter pylori eradication therapy based on antibiotic susceptibility and CYP2C19 genotype.World J Gastroenterol,2014,20(21):6400-6411.
20 De Francesco V,Margiotta M,Zullo A,et al.Clarithromycin-resistant genotypes and eradication of Helicobacter pylori.Ann Intern Med,2006,144(2):94-100.
21 Liou JM,Chen CC,Chang CY,et al.Efficacy of genotypic resistance-guided sequential therapy in the third-line treatment of refractory Helicobacter pylori infection:a multicentre clinical trial.J Antimicrob Chemother,2013,68(2):450-456.
(修回日期:2015-03-18)
(责任编辑:王惠群)
·消息·
《中国微创外科杂志》已开通微信公众号

我刊2015年1月开通微信公众号:wcwkzazhi_010,将及时上传当期杂志目录、文章摘要,以及各科名家精彩手术视频,欢迎关注,欢迎提供视频,欢迎投稿。
《中国微创外科杂志》编辑部
Application of Endoscopy-based Tailored Therapy in the Eradication ofHelicobacterpylori
ZhangLingyun,SongZhiqiang*,ZhouLiya*,etal.
*DepartmentofGastroenterology,PekingUniversityThirdHospital,Beijing100191,China
Correspondingauthor:ZhouLiya,E-mail:zhouliya123456@163.com
Objective To determine the eradication efficacy, safety, and compliance of endoscopy-based tailored therapy in the initial and retreated patients withHelicobacterpyloriinfection. Methods Between May 2013 and June 2014, patients with dyspepsia (18-70 years old) diagnosed as having infection ofHelicobacterpyloriunder gastroscopy in our hospital were recruited into the study. Gastric mucosa specimens taken with the gastroscopy were cultured forHelicobacterpyloriand then antibiotics sensitivity and cytochrome P450 isoenzyme 2C19 genotype were detected. Medications for tailored therapy included amoxicillin and were adjusted based on clarithromycin sensitivity (clarithromycin or tinidazole) and cytochrome P450 isoenzyme 2C19 genotype (rabeprazole or esomeprazole). Eradication status was assessed 4-12 weeks after treatment with urea breath test. Results A total of 318 initially-treated and 62 retreated cases of infection ofHelicobacterpylorihad successful culture ofHelicobacterpyloriand the culture success rates were 90.9% (318/350) and 91.2% (62/68), respectively. These cases were included in the intention-to-treat analyses. Finally 298 initially-treated and 59 retreated cases completed the treatment and follow-up and were included in the per-protocol analyses. The eradication rates of endoscopy-based tailored therapy in the initially-treated and the retreated cases were 88.7% (95% confidence interval, 85.2%-92.1%) and 75.8% (95% confidence interval,65.1%-86.5%) in intention-to-treat analyses, and 93.3% (95% confidence interval,89.9%-96.0%) and 79.7% (95% confidence interval,69.7%-89.7%) in per-protocol analyses. The rates of adverse effects were 22.0% (70/318) and 33.9% (21/62) in the two groups. The compliance of the two groups was 94.3% (300/318) and 95.2% (59/62), respectively. Conclusion Endoscopy-based tailored therapy has a satisfactory eradication efficacy in initially-treated patients withHelicobacterpyloriinfection, but a poor eradication efficacy in retreated patients.
Helicobacterpylori; Eradication; Tailored therapy; Antibiotic resistance; Gastroscopy
“十二五”国家支撑计划课题(2012BAI06B02);首都卫生发展科研专项(2011-4032-02)
R573
A
1009-6604(2015)06-0497-05
10.3969/j.issn.1009-6604.2015.06.005
2015-02-22)
** 通讯作者,E-mail:zhouliya123456@163.com
*** 共同第一作者
① (北京大学第四临床医学院,北京 100096)
② (中国疾病预防控制中心传染病预防控制所,北京 102206)

