Omi/HtrA2 在无镁外液致痫海马神经元凋亡中的作用机制及其特异性抑制剂UCF-101 的神经元保护作用
金 迪,连亚军,张海峰,谢南昌,高延伦
癫痫是多种原因导致的脑部神经元高度同步化异常放电所致的临床综合征[1],其发作形式复杂,反复发作给患者的生活带来了极大的痛苦,因此明确癫痫的发病机制、寻找新的治疗靶点尤为重要。近年来,癫痫导致神经元凋亡的相关分子机制受到人们的很大关注,外来因素致痫神经元后,坏死的、凋亡的以及抗凋亡的信号途径均被激活,它们之间的平衡被破坏,促凋亡蛋白表达相对更高,进而促进神经元凋亡的发生[2]。如何精确调控神经元凋亡,有望成为抗癫痫治疗的新靶点。Omi/HtrA2 是一种定位于线粒体膜间隙的丝氨酸蛋白酶,是细胞内线粒体凋亡途径中重要的信号分子。既往有研究证明,Omi/HtrA2 在脑缺血/再灌注损伤[3]、肾脏缺血再灌注损伤以及高氧诱导的肺泡上皮细胞凋亡等疾病中,均发挥重要作用。但其是否参与体外癫痫模型中神经元的凋亡过程,目前国内外尚缺乏这方面的研究。本研究通过Sombati 法建立海马神经元自发性癫痫样放电的细胞模型,该模型与临床颞叶癫痫较为贴近,旨在观察Omi/HtrA2 在体外癫痫模型神经元凋亡中的作用机制,以及应用其特异性抑制剂UCF-101 后,对神经元凋亡以及XIAP、caspase3等蛋白表达的影响,探讨UCF-101 的神经保护作用,为临床上癫痫的治疗提供理论依据。
1 材料和方法
1.1 动物和主要试剂 新生24 h 以内SD 大鼠,SPF 级[郑州大学动物实验中心提供,许可证号SCxK(豫)2010-0002];DMEM/HIGH GLUCOSE 培养基、PBS 液(HyClone);转铁蛋白、牛胰岛素、L-多聚赖氨酸、胰蛋白酶(Sigma);特级胎牛血清、B27 及Glutamax-I 谷氨酰胺(Gibco);青链霉素混合液(北京索莱宝);NSE 多克隆抗体(北京博奥森生物技术有限公司);山羊抗兔IgG/Cy3 荧光二抗(北京博奥森生物技术有限公司);基础培养基:DMEM+0.2%转铁蛋白+0.4%NaHCO3+1%青链霉素混合液;种植液:90%基础培养基+10%FBS+1%Glutamax-I+2%牛胰岛素;维持液:93%基础培养基+2%B27 +0.25% Glutamax-I+5% FBS;无镁细胞外液(pH 7.4):145 mmol/L NaCl、2.5 mmol/L KCl,10 mmol/L HEPES,2 mmol/L CaCl2,10 mmol/L 葡 萄 糖,0.002 mmol/L甘氨酸;正常细胞外液:无镁外液各成分+1 mmol/L MgCl2;Anti-active caspase-3 抗体(abcam);Anti-HtrA2/Omi 抗体(abcam);Anti-XIAP 抗体(santa cruz);Anti-HAX-1 抗体(santa cruz)。线粒体和胞浆蛋白分离提取试剂盒(上海生工)。
1.2 原代海马神经元的培养 新生24 h 内的SD 大鼠,常规消毒,断头取脑,置于加有预冷PBS的培养皿中,分离双侧海马,剔除表面血管,并剪成约1 mm×1 mm×1 mm 的组织块,转移至15 ml 的离心管中,加入0.125%的胰酶后,置于37 ℃恒温箱中消化15 min,期间每隔数分钟轻微振荡,消化完毕后1500 r/min 离心5 min,加入PBS 洗涤并终止消化,弃上清,加入种植液,吹打均匀制成细胞悬液。取少量细胞悬液用于台盼蓝染色计数,调整细胞密度为5 × 105/ml,接种于6 孔培养板中(预先以0.01%L-多聚赖氨包被),每孔约2 ml。置于37.5 ℃恒温,5% CO2培养箱中培养24 h 后,等量换成含有B27 的维持液,以后每周2~3 次进行半量换液,并于倒置相差显微镜下观察细胞生长情况,培养至7~10 d 用于后续实验[4]。
1.3 NSE 染色鉴定海马神经元 海马神经元在放置有爬片的24 孔板中生长至7 d 后,进行NSE鉴定。吸弃培养基,PBS 漂洗1 遍,然后用4%多聚甲醛固定20 min,PBS 漂洗3 遍,每次5 min;0.25%Triton 穿孔15 min,吸弃Triton,PBS 漂洗3 次,每次5 min;1%BSA 室温下封闭30 min,加入兔抗大鼠NSE 多克隆抗体(稀释200 倍)4℃过夜,TBST 漂洗3 次,每次5 min,加入山羊抗兔IgG/Cy3 荧光二抗,以下操作步骤均需避光进行,37 ℃作用1 h;TBST漂洗3 次,每次5 min,5 μg/ml DAPI 染色2 min,吸弃DAPI,TBST 漂洗,抗荧光猝灭封片剂封片,放入湿盒避光保存,择期在荧光显微镜下观察。
400 倍荧光显微镜下随机选择10 个视野,以视野中阳性神经元数目占观察细胞总数的百分率为神经元纯度。
1.4 造模分组
1.4.1 海马神经元培养至10 d,随机分为对照组和模型组 对照组用正常细胞外液培养3 h 后,更换为正常维持液继续培养。模型组以无镁细胞外液作用3 h 后,更换为正常维持液,并分别于造模后3 h、8 h、24 h 终止细胞培养,用于后续试验。
1.4.2 海马神经元培养至10 d,随机分为对照组、致痫24 h 组、UCF-101 干预组、DMSO 组 其中UCF-101 干预组,在无镁细胞外液作用前,加入10 μmol/L UCF-101(溶于DMSO 中)事先作用24 h,再行无镁细胞外液诱导,造模后继续培养24 h,终止培养。DMSO 组致痫前给予相同浓度的DMSO 作用24 h,再行无镁外液诱导,造模后继续培养24 h,终止培养。
1.5 western blot 法检测Omi/HtrA2、caspase3、XIAP、HAX-1 蛋白表达变化 分别提取各组海马神经元线粒体蛋白、胞浆蛋白及细胞总蛋白。BCA 法测蛋白浓度,调整上样量,每个泳道保证总蛋白量相等。SDS-PAGE 凝胶电泳(上层胶80 V 30 min;下层胶120 V 60 min),电泳结束后将胶上的蛋白质条带转移到PVDF 膜上(半干转),5%脱脂奶粉封闭3 h。一抗孵育,兔抗大鼠Omi/HtrA2(1∶ 1000);兔抗大鼠caspase3(1 ∶ 200);兔抗大鼠XIAP(1 ∶200);兔抗大鼠HAX-1(1 ∶ 200),4 ℃冰箱过夜。TBST 洗膜每次10 min,共3 次,洗膜后加入辣根过氧化物酶标记山羊抗兔IgG(1∶ 8000),室温摇床缓慢孵育1 h,ECL 显影成像重复3 次。采用Image J测定条带光密度,以目的蛋白与相应内参条带光密度比值作为目的蛋白的相对表达量。
1.6 TUNEL 法检测神经元凋亡 采用TUNEL法原位标记DNA 片段来检测凋亡细胞数量,具体步骤按试剂盒提供的说明书进行操作,荧光素染色,荧光显微镜下进行观察,每片选取10 个高倍视野,分别计数阳性细胞数,重复3 次,取其均数作为该例凋亡细胞数。
2 结果
2.1 海马神经元形态学特征 海马神经元刚接种时形态基本呈圆形,体积较小,单个分布。培养3 h 后逐渐开始贴壁,24 h 后绝大部分细胞贴壁,而且部分神经元长出短小突起,少数未能贴壁的细胞死亡。随着培养时间的延长,神经元突起逐渐增多并延长,粗细不等,有的突起在远端形成分支,3 d后明显增长的突起开始相互连接成稀疏的网络。神经元生长至7 d,细胞间连接更为紧密,立体感较强,神经元胞体大多呈椭圆形或三角形,此时细胞较为丰满,突起清晰,神经元网络密集(见图1)。

图1 倒置相差显微镜下观察体外培养不同时间新生大鼠海马神经元(A:24 h;B:3 d:C:5 d;D:7 d)
2.2 海马神经元纯度测定 海马神经元培养至7 d,经神经元特异性烯醇化酶NSE 染色鉴定,纯度为90%以上(见图2)。

图2 培养至7 d 的海马神经元NSE 免疫荧光染色
2.3 Western Blot 检测各组海马神经元中Omi/HtrA2、caspase3、XIAP、HAX-1 蛋白表达的变化
2.3.1 Omi/HtrA2 在海马神经元中的表达以及致痫后其位置的改变 Western Blot 结果显示,正常对照组中Omi/HtrA2 主要位于线粒体中,即线粒体中的蛋白表达量较高,随着造模后时间的延长,Omi/HtrA2 逐渐释放入胞浆内,这种移动尤其在致痫后8 h、24 h 较为明显,与正常对照组比较有统计学差异(P <0.05)。而致痫后3 h 线粒体中的Omi/HtrA2 表达量较正常组线粒体中表达量有所上升,存在统计学差异(P <0.05)。由此说明,海马神经元致痫后,Omi/HtrA2 在线粒体中的含量短时间内有所上升,随后发生了显著的移位,即由线粒体移位到了胞浆中(见图3)。
2.3.2 UCF-101 对各组海马神经元中XIAP、active-caspase3、HAX-1 蛋白表达的影响 正常对照组中HAX-1 表达相对较高,致痫24 h 后,HAX-1 蛋白表达量显著下降,与正常对照组相比有统计学差异(P <0.05)。预先使用UCF-101 作用后,HAX-1表达量有所上升,与模型组有统计学差异(P <0.05)。DMSO 组与模型组相比,无统计学差异(P>0.05)(见图4)。XIAP 表达量在模型组或DMSO组中均有所升高,但与正常组比较均无统计学差异,使用UCF-101 预处理后,XIAP 表达量较另外3 组有明显的升高,存在统计学差异(P <0.05)。正常对照组海马神经元中active-caspase3 的蛋白表达量很低,模型组中此蛋白表达量明显上调,与正常对照组比较有统计学意义(P <0.05)。UCF-101 处理组中此蛋白表达量明显低于模型组(P <0.05),DMSO组与模型组相比无统计学差异(P >0.05)(见图5)。

图3 WB 检测各组Omi/HtrA2 在线粒体和胞浆中的相对含量

图4 WB 检测各组海马神经元中HAX-1 蛋白相对含量

图5 WB 检测各组海马神经元中XIAP 蛋白以及activecaspase3 蛋白相对含量
2.4 UCF-101 对体外癫痫模型中神经元凋亡的影响 正常对照组荧光显微镜下观察偶见少量TUNEL 染色阳性的细胞,模型组(致痫24 h 组)镜下可见大量凋亡细胞,与正常对照组相比有统计学差异(P <0.05)。UCF-101 组凋亡细胞数较模型组显著减少,与模型组相比有统计学差异(P <0.05)。DMSO 组凋亡细胞数与模型组相比无统计学差异(P >0.05)(见图6)。
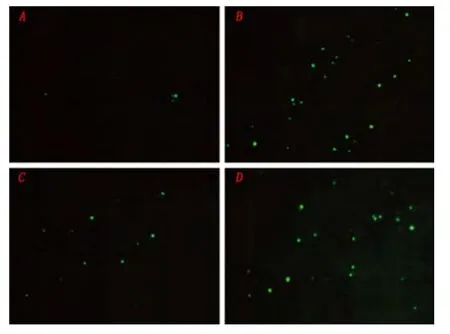
图6 TUNEL 染色检测神经元凋亡:A 正常组B 致痫24 h 组C UCF-101 处理组D DMSO 组
3 讨论
癫痫是仅次于脑卒中的最常见的神经退行性疾病[5],近年来,线粒体在后天获得性癫痫例如颞叶癫痫中的作用日益受到人们重视。线粒体中某些蛋白在癫痫发作过程中从线粒体释放入胞浆,从而对促凋亡、抗凋亡、坏死途径的激活产生一定影响。因此,癫痫发作过程中发生亚细胞移位的蛋白,有望成为癫痫治疗的新靶点。
IAPs 是细胞内可以调控caspase 活性的凋亡抑制因子,这些因子包括XIAP、c-IAP1、c-IAP2 等。据报道这些凋亡抑制因子通过直接抑制起始caspase和效应caspase 来阻断凋亡途径[6]。IAPs 包含一个或多个保守区域,即BIRs,这些BIR 区域在抑制caspase 活性方面发挥重要作用。BIR 区域和它们之间的连接部分直接与caspase 结合,并抑制其活性,但IAPs 的抗凋亡活性又可以被一些蛋白所调控,这些蛋白连接在BIR 区域上,通过破坏caspase-IAPs 复合体或促使IAPs 泛素化降解来激活caspase活性,其中就包括Omi/HtrA2。Omi/HtrA2 是一种位于线粒体膜间隙的促凋亡的丝氨酸蛋白酶,据报道它主要通过两种途径促进细胞发生凋亡,即caspase 依赖性途径和caspase 非依赖性途径。和AIF、细胞色素C 一样,Omi/HtrA2 在凋亡过程中,从线粒体膜间隙释放到胞浆中,通过与IAPs 结合而激活caspase,发挥其促凋亡作用,此即caspase 依赖性促凋亡途径[7]。但也有文献报道,Omi/HtrA2 可以单独依赖其蛋白酶活性发挥caspase 非依赖性促凋亡作用。
HAX-1 是一个分子量为35Kd 的抗凋亡蛋白,与BCL-2 家族的BH1 区和BH2 区有同源性。其可以在体内或体外条件下通过Omi/HtrA2 的蛋白酶活性被裂解,而且其降解在凋亡过程中发生较早,Cilenti 等[8]早在2004 年就研究得出在Omi/HtrA2尚位于线粒体时,线粒体中的HAX-1 就已经被其降解了。此项研究表明Omi/HtrA2 在线粒体中就可以通过裂解HAX-1 发挥其促凋亡作用,而这种作用与其在胞浆中通过裂解XIAP,激活caspase 发挥促凋亡作用,显然是不同的。据相关文献报道[9],来自mnd2 鼠的细胞系携带有突变的Omi/HtrA2 基因,从而影响其蛋白酶活性,当给这种细胞系诱导凋亡时,HAX-1 几乎不发生降解。而当功能性的Omi/HtrA2 基因导入此种细胞系后,HAX-1 发生了降解。而用Omi/HtrA2 的特异性抑制剂UCF-101 预先作用于细胞后,HAX-1 的降解明显减少,这些结论在Cilenti 等的研究中也都有提到。除此之外,既往有学者以出生14 d 的Wistar 大鼠为研究对象,以氯化锂-匹鲁卡品制造癫痫持续状态模型,研究Omi/Htra2 在癫痫发生过程中的作用机制,免疫荧光双标显示几乎所有caspase3 阳性的细胞胞浆中都高表达Omi/HtrA2,但并不是所有高表达Omi/HtrA2 的细胞都是caspase3 阳性[10],由此也提示Omi/HtrA2 可以通过caspase 非依赖性的方式促进细胞发生凋亡。
神经元体外原代培养模型是研究神经元发育、分化、神经再生、神经系统疾病的发生机制等众多领域的重要模型,近年来在癫痫的研究中越来越受到重视。本次研究创新性的以体外培养的新生大鼠海马神经元为研究对象,利用Sombati 法制造体外癫痫模型。进一步探索了Omi/HtrA2 在癫痫过程中的亚细胞移位,以及其对caspase3、XIAP、HAX-1 蛋白表达的影响。
研究结果得出,Omi/HtrA2 于细胞致痫后3h 在线粒体中的表达升高,随后于致痫后8 h、24 h 发生了显著的移位,胞浆中的Omi/HtrA2 含量在细胞致痫后3 h、8 h、24 h 均有提高,其中以8 h、24 h 最为显著。其移位于胞浆中后,通过裂解XIAP 发挥其caspase 依赖性的致凋亡作用。但本次研究得出XIAP 表达在正常组与致痫24 h 组并无统计学差异,初步考虑可能是由于细胞遭遇应激反应后,为了维持细胞功能和结构的完整性,海马神经元内的XIAP保护性的增多,但随着时间的延长,Omi/HtrA2 逐渐从线粒体释放入胞浆内,裂解并中和XIAP,又使其表达量下降,两种作用综合起来导致XIAP 表达量与正常组相比无明显差异。但使用UCF-101 预处理后,其特异性的抑制Omi/HtrA2 的活性,而减弱了Omi/HtrA2 对XIAP 的降解作用,导致XIAP 表达量有明显的提升。XIAP 被裂解后,解除了其对caspase3 的抑制作用,导致active-caspase3 蛋白的表达明显上升。而HAX-1 在Omi/HtrA2 的作用下显著减少,使用UCF-101 后HAX-1 表达量上升,差异有统计学意义,这与Lucia Cilenti 等人的研究结果是一致的。致痫24 h 后,TUNEL 染色结果显示神经元凋亡数目显著增多,而使用UCF-101 后凋亡细胞有所减少,就是由于UCF-101 特异性的抑制了Omi/HtrA2 的促凋亡活性,从而抑制了神经元的凋亡。
本次研究得出在无镁外液诱导的神经元痫性放电过程中,Omi/HtrA2 发生了明显移位,并且通过降解XIAP、HAX-1 发挥其caspase 依赖性和caspase 非依赖性的两种促凋亡方式,使用其特异性抑制剂UCF-101 后,上述两种蛋白降解明显减弱,抑制了caspase 的激活及神经元的凋亡,对致痫海马神经元发挥一定的保护作用。但更需要进一步的研究,明确HAX-1、XIAP 被其裂解的具体时相,且UCF-101作为其特异性抑制剂,还有没有别的不为人知的作用与抗凋亡相关,尚待进一步研究。
[1]Ferriero DM.Protecting neurons[J].Epilepsia,2005,46(Suppl 7):45-51.
[2]Althaus J,Siegelin MD,Dehghani F et al.The serine protease Omi/HtrA2 is involved in XIAP cleavage and in neuronal cell death following focal cerebral ischemia/reperfusion[J].Neurochem Intern,2007,50(1):172-180.
[3]张 伟,崔艳艳,姜寰宇,等.UCF-lOl 对大鼠脑缺血再灌注损伤的神经保护作用[J].解剖科学进展,2010,16(4):335-337.
[4]徐祖才,徐 平,张 骏,等.新生大鼠海马神经元原代培养及膜片钳全细胞记录[J].重庆医学,2012,41(31):3241-3242.
[5]Sloviter RS.The neurobiology of temporal lobe epilepsy:too much information,not enough knowledge[J].Comptes Rendus Biol,2005,328(2):143-153.
[6]Deveraux QL,Leo E,Stennicke HR,et al.Cleavage of human inhibitor of apoptosis protein XIAP results in fragments with distinct specificities for caspases[J].EMBO J,1999,18(19):5242-5251.
[7]Verhagen AM,Silke J,Ekert PG,et al.Omi/HtrA2 promotes cell death through its serine protease activity and its ability to antagonize inhibitor of apoptosis proteins[J].J Biol Chem,2002,277(1):445-454
[8]Cilenti.L,Soundarapandian MM,Zervos AS.Regulation of HAX-1 anti-apoptotic protein by Omi/HtrA2 protease during cell death[J].J Biol Chem,2004,279(48):50295-50301.
[9]Jones JM,Datta P,Srinivasula SM,et al.Loss of Omi mitochondrial protease activity causes the neuromuscular disorder of mnd2 mutant mice[J].Nature,2003,425(6959):721-727.
[10]Rami A,Kim M.Translocation of the Serine Protease Omi/HtrA2 from Mitochondria into the Cytosol Upon Seizure-Induced Hippocampal Injury in the Neonatal Rat Brain[J].Neurochem Res,2010,35(12):2199-2207.

