新诊断2型糖尿病患者血清网膜素1水平与亚临床动脉粥样硬化的相关性研究
廖春梅,马 薇
(1.广西桂林市人民医院综合内科,广西 桂林 541000; 2.广西医科大学病理教研室,南宁 530021)
新诊断2型糖尿病患者血清网膜素1水平与亚临床动脉粥样硬化的相关性研究
廖春梅1,马薇2※
(1.广西桂林市人民医院综合内科,广西 桂林 541000; 2.广西医科大学病理教研室,南宁 530021)
摘要:目的探讨新诊断2型糖尿病(T2DM)患者血清网膜素1水平与亚临床动脉粥样硬化的关系。方法选取2012年1月至2013年5月桂林市人民医院收治的新诊断T2DM患者85例作为研究对象,依据颈动脉超声检查结果分为T2DM无斑块组(42例)和T2DM伴斑块组(43例),另外同期选择42例门诊健康体检者作为对照组,测定各组受试者血清网膜素1水平,颈动脉内膜-中膜厚度(IMT),空腹血糖、空腹胰岛素(FINS)、糖化血红蛋白(HbA1c)、高敏C反应蛋白(hs-CRP)、血脂等指标,计算稳态模式评估的胰岛素抵抗指数(HOMA-IR)、体质指数(BMI)、腰臀比,分析网膜素1水平与亚临床动脉粥样硬化的相关性。结果血清网膜素1在对照组、T2DM无斑块组、T2DM伴斑块组中逐渐降低,组间两两比较差异均有统计学意义(P<0.05)。血清网膜素1水平与BMI、腰臀比、TC、TG、LDL-C、HbA1c、hs-CRP、HOMA-IR、FINS、FBG均呈负相关(P<0.05),而与HDL-C呈正相关(P<0.01)。多元线性逐步回归分析显示:腰臀比、BMI、HOMA-IR是影响血清网膜素1水平的独立危险因素。结论血清网膜素1水平的改变与胰岛素敏感性、肥胖密切相关,故可能参与胰岛素抵抗与亚临床动脉粥样硬化发生和发展。
关键词:网膜素1;亚临床动脉粥样硬化;新诊断2型糖尿病;胰岛素抵抗
2型糖尿病(type 2 diabetes mellitus,T2DM)血管病变的危害性越来越被人们所重视,其根本致病原因是动脉粥样硬化。亚临床动脉粥样硬化早期是无症状的,可仅表现为颈动脉内膜-中膜厚度(intima-media thickness,IMT)增加和(或)血管内动脉粥样硬化斑块形成。糖尿病患者动脉硬化具有发生早、预后差的特点。网膜素1是脂肪细胞因子,近年来被证明是由脂肪组织特异分泌的多肽类激素,具有多种生物学功能,与代谢综合征、肥胖、脂糖代谢、炎症及斑块等危险因素关系密切。因此,推测网膜素1可能参与了糖尿病患者动脉粥样硬化的病理生理过程。本研究通过测定新诊断T2DM患者的血清网膜素1水平,以了解网膜素1水平对动脉粥样硬化的影响。
1资料与方法
1.1一般资料选取2012年1月至2013年5月桂林市人民医院收治的新诊断T2DM患者85例为研究对象,将符合纳入与排除标准的T2DM患者依据颈动脉超声检查结果分为T2DM伴斑块组与T2DM无斑块组。T2DM伴斑块组43例,男22例、女21例,年龄39~70岁,平均(59±9)岁;T2DM无斑块组42例,男21例、女21例,年龄37~68岁,平均(58±9)岁。另选同期门诊健康体检者42例作为对照组,男22例、女20例,年龄35~67岁,平均(57±9)岁。
1.2纳入和排除标准纳入标准:①诊断均符合1999年世界卫生组织对T2DM的诊断标准;②起病半年内无酮症或其他应激情况;③年龄为35~70岁;④体质指数(body mass index,BMI)为19~35 kg/m2;⑤病程在1年内;⑥至少2个月未服用降血脂、降血压、抗氧化、抗凝血及雌激素、胰岛素、噻唑烷二酮类等药物。排除标准:①排除其他类型糖尿病;②肝肾功能不全(丙氨酸转氨酶大于正常上限2倍,血肌酐大于正常上限1.2倍); ③合并肝胆实质性疾病、脂肪肝、心功能不全、血液系统疾病、肾脏疾病、肿瘤及慢性消耗性疾病;④已合并心、脑、肾及外周血管病变并有临床表现者,静息12导联心电图有明显心肌缺血表现。
1.3方法
1.3.1一般检查询问受试者病史。检查日清晨,测量3组受检者的臀围、腰围、身高、体质量,计算BMI和腰臀比,BMI=体质量(kg)/身高2(m2),腰臀比=腰围/臀围。测量血压,采用医用电子血压计(omron HEM-907型),根据研究对象选择适当袖带,受试者双足平放在地面上,至少休息5 min以上,取坐位测量右上臂收缩压与舒张压,连续测3次,每次间隔10 min,研究对象的血压值取3次测量的平均值。
1.3.2颈动脉超声检查彩色多普勒超声诊断仪采用GE公司LO GIQ。测试前休息 10~15 min,患者仰卧肩部垫枕,头转向对侧,先从颈动脉根部作纵向及横向扫描,颈总动脉、颈内动脉、颈外动脉依次被测量,观察有无管壁增厚及斑块形成。IMT测量部位:选取颈动脉膨大下1 cm处及远心1 cm、近心1 cm处测量其厚度,取两侧6点的均值作为IMT。以IMT≥1.0 mm视为IMT增厚,局限性回声结构突入管腔且IMT≥1.2 mm视为斑块形成。本研究将未出现冠状动脉粥样硬化性心脏病、脑血管病、四肢大血管病变等临床大血管并发症,但满足以上情况的患者均归于亚临床动脉粥样硬化范畴。
1.3.3实验室检查在禁食12 h后,所有受试者均于清晨采空腹静脉血测低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、空腹血糖(fasting plasma glucose,FPG)、总胆固醇(total cholesterol,TC)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、三酰甘油(tricylglycerol,TG)、空腹胰岛素(fasting insulin,FINS)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、高敏C反应蛋白(high sensitivity C reaction protein,hs-CRP)。并抽取静脉血5 mL室温放置2 h后以离心半径15 cm,3000 r/min离心15 min,收集上层血清3 mL,放置于-40 ℃冰箱低温保存,标本收集完成后由专人一次性采用酶联免疫吸附测定检测网膜素1(从北京爱迪博生物科技公司购进试剂盒)。采用西门子公司ADVIA2400全自动生化分析仪测定FPG、TC、TG、HDL-C、LDL-C;hs-CRP测定采用胶乳增强透射比浊法,试剂盒购自上海复星长征医学科学有限公司,批内变异<5%;血清FINS采用放射免疫法,选用中国原子能科学研究院药盒;HbA1c测定采用高压液相法,选用美国Bio-Rad药盒。稳态模式评估的胰岛素抵抗指数(homeostasis model of assessment for insulin resistence index,HOMA-IR)用FPG和FINS数值计算,HOMA-IR=FPG(mmol/L)×FINS(mIU/L)/22.5。

2结果
2.13组受试者各观察指标的比较3组受试者在性别、年龄、舒张压方面比较差异无统计学意义(P>0.05)。T2DM伴斑块组的BMI、腰臀比、收缩压、FPG、TG均高于对照组(t=2.118,2.179,2.303,2.426,P<0.05),LDL-C、FINS、TC、HbA1c、HOMA-IR、hs-CRP、IMT较对照组显著增高(t=2.982,3.411,3.289,3.602,3.701,3.802,3.716,P<0.01),HDL-C和网膜素1低于对照组(t=2.396,3.107,P<0.05)。T2DM无斑块组的BMI、腰臀比、FPG、HOMA-IR、TC、TG、LDL-C、HbA1c、hs-CRP、IMT均高于对照组(t=2.213,2.206,2.011,1.916,2.125,2.421,2.324,2.006,2.267,2.023,P<0.05),HDL-C和网膜素1低于对照组(t=2.162,3.428,P<0.05)。T2DM伴斑块组的FINS、HOMA-IR、TC、LDL-C、HbA1c、hs-CRP、IMT均高于T2DM无斑块组(t=2.415,2.689,2.581,2.462,2.634,2.502,2.891,P<0.05),HDL-C、网膜素1低于T2DM无斑块组(t=2.291,2.236,P<0.05)。见表1。

表1 3组受试者各项观察指标的比较 ±s)
T2DM:2型糖尿病;BMI:体质指数; FPG:空腹血糖;FINS:空腹胰岛素;TG:三酰甘油;TC:总胆固醇;HOMA-1R:稳态模式评估的胰岛素抵抗指数;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;HbA1c:糖化血红蛋白;hs-CRP:高敏C反应蛋白;IMT:颈动脉内膜-中膜厚度;1 mmHg=0.133 kPa;a与对照组比较,P<0.05;b与T2DM无斑块组比较,P<0.05;a为χ2值,余为F值2.2血清网膜素1与各项指标的相关性分析血清网膜素1水平与BMI、腰臀比、TG、TC、LDL-C、HbA1c、hs-CRP、HOMA-IR、FINS、FPG、IMT均呈负相关(P<0.05),而与HDL-C呈正相关(P<0.01),与年龄、性别、收缩压、舒张压无相关性(P>0.05)。见表2。
2.3多元线性逐步回归分析以空腹血清网膜素1水平为因变量,BMI、腰臀比、TG、TC、LDL-C、HDL-C、HbA1c、hs-CRP、HOMA-IR、FPG、FINS、IMT为自变量进行多元线性逐步回归分析,结果显示,BMI、腰臀比、HOMA-IR是影响血清网膜素1水平的影响因素,回归方程:Y网膜素1=368.032×腰臀比+88.220×BMI+75.684×HOMA-IR-438.928。见表3。

表2 网膜素1与各项指标的相关性分析
BMI:体质指数;TG:三酰甘油;TC:总胆固醇;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;HbA1c:糖化血红蛋白;hs-CRP:高敏C反应蛋白;HOMA-IR:稳态模式评估的胰岛素抵抗指数;FINS:空腹胰岛素;FPG:空腹血糖;IMT:颈动脉内膜-中膜厚度
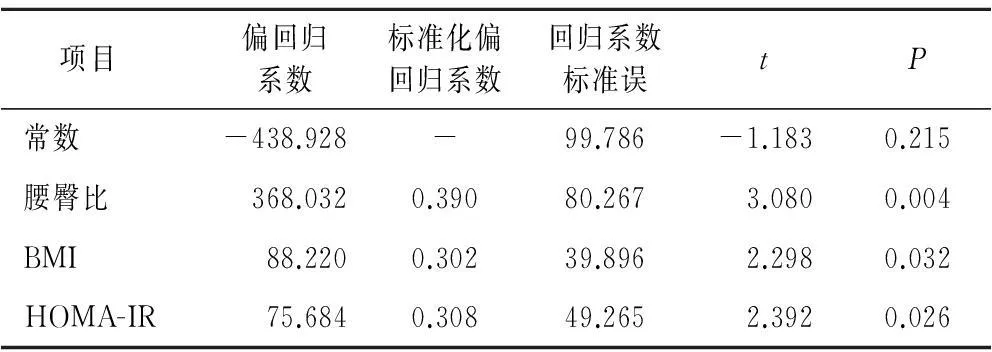
表3 网膜素1影响因素的多元逐步回归分析
BMI:体质指数;HOMA-IR:稳态模式评估的胰岛素抵抗指数
3讨论
2003年,美国马里兰大学Yang等[1]发现,网膜素1是特异性表达于网膜脂肪组织的细胞因子,具有促进蛋白激酶B磷酸化、加强胰岛素信号转导的作用,在胰岛素刺激下可增强人体内脏及皮下脂肪细胞对葡萄糖的摄取,即脂肪细胞胰岛素敏感性增加。研究发现,网膜素1的血清水平可以反映网膜素基因的表达水平[2],网膜素基因位于染色体1q22~23,而T2DM与该区域关系密切[3],所以血清网膜素1水平与胰岛素抵抗、腹型肥胖及脂代谢存在相关性,参与构成胰岛素抵抗的病理生理基础。
动脉粥样硬化发生、发展的危险因素包括糖脂代谢紊乱、肥胖、IR等。Pan等[4]用实验证明,血清网膜素的水平与IR的发生相关,它可能通过直接与间接的方式增加胰岛素的敏感性,从而改善IR。本研究发现T2DM患者网膜素1水平明显低于正常人,这与国内相关研究一致[5],且腰臀比、BMI是血清网膜素1的独立危险因素,说明网膜素1与IR的关键因素体质量、肥胖密切相关,这与张洁等[6]研究一致。Cai等[7]在mRNA水平发现,HOMA-IR与网膜素水平独立相关,并且肥胖伴T2DM的患者血清网膜素水平最低。本研究结果显示,网膜素1在对照组、T2DM无斑块组、T2DM伴斑块组中逐渐降低,提示网膜素1可能参与T2DM患者颈动脉粥样硬化发生的病理生理过程,这与Liu等[8]与Shibata等[9]的研究一致。且本研究显示,网膜素1与HOMA-IR呈负相关,与国内外研究一致[4,10-11]。多元线性逐步回归分析提示,对T2DM患者,HOMA-IR是影响网膜素1的独立危险因素。上述研究均提示,在T2DM患者中,网膜素1、HOMA-IR和IMT三者之间可能具有某种内在的联系,即血浆网膜素1减少可能通过增加IR从而导致IMT增高,但其确切的关系有待于更多的研究加以证实。
目前研究发现,动脉粥样硬化从发生、发展到转归,整个病理生理过程就是一个慢性炎症过程[12],炎症直接参与动脉粥样硬化及其并发症的发生、发展,且炎症也是发生胰岛素抵抗的重要因素[13]。网膜素1亦与炎症密切相关。研究表明,T2DM尤其是存在动脉粥样硬化性血管疾病的患者血清hs-CRP水平升高[14]。本研究结果显示,hs-CRP在T2DM患者中高于对照组,而T2DM伴斑块组hs-CRP又高于T2DM无斑块组;相关分析结果显示血清网膜素1水平与hs-CRP呈明显负相关;但多元线性逐步回归分析未显示hs-CRP是网膜素1的独立危险因素,其原因可能为网膜素1通过调控炎症进而增加IR,IR亦发过来增加炎性因子的表达,导致T2DM动脉粥样硬化的发生,因本研究样本量少,其具体机制有待进一步研究。
近年来研究认为,肥胖是一个缓慢发生的炎症过程。在肥胖个体中发现网膜素的血浆水平和基因表达明显降低[4,15]。另外,网膜素1还与白细胞介素6、肿瘤坏死因子α等炎性标志性因子呈负相关,其水平受炎症状态的影响[4]。这些研究均提示,网膜素1可能在动脉粥样硬化的炎症过程中发挥了保护作用,从而抑制其形成。
本研究结果显示,血清网膜素1水平与HDL-C呈正相关,与TG、TC、LDL-C呈负相关,提示网膜素1可能与脂代谢紊乱有关。HDL-C具有抗动脉粥样硬化作用,故内源性胆固醇(以胆固醇酯为主)可以被HDL-C从组织往肝脏逆向转运。血清网膜素1水平与HDL-C变化的高度一致性提示血清网膜素1水平也可能与脂代谢紊乱及动脉粥样硬化有关。国内有研究显示[16],糖尿病合并动脉粥样硬化患者血清网膜素1水平显著低于无动脉粥样硬化患者,提示网膜素1与血脂的关系可能是影响动脉粥样硬化性血管疾病发生、发展的重要环节,但其具体机制仍待进一步研究。
综上所述,网膜素1水平与肥胖、胰岛素抵抗及脂代谢紊乱有关,检测新诊断T2DM患者的网膜素1水平,研究其与亚临床动脉粥样硬化的关系,对于在未出现临床症状之前进行大血管病变的预防与治疗有积极意义。
这一研究结果可能还需要扩大样本量,改变研究人群,甚至长期的随访等进行更多更深的研究来进一步证实这一结果。
参考文献
[1]Yang RZ,Lee MJ,Hu H,etal.Identification of omentin as a novel depot-specific adipokine in human adipose tissue:possible role ill modulating insulin action[J].Am J Physiol Endocrinol Metab,2006,290(6):E1253-1261.
[2]de Souza Batista CM,Yang RZ,Lee MJ,etal.Omentin plasma levels and gene expression are decreased in obesity[J].Diabetes,2007,56(6):1655-1661.
[3]Schaffler A,Neumeier M,Herfarth H,etal.Genomic structure of human omentin,a new adipocytokine expressed in omental adipose tissue[J].Biochim Biophys Acta,2005,1732(1/3):96-102.
[4]Pan HY,Lin G,Li Q.Changes of serum omentin-1 levels in normal subjects and in patients with impaired glucose regulation and with newly diagnosed and untreated type 2 diabetes[J].Diabetes Res Clin Pract,2010,88(1):28-33.
[5]冯小萌,徐援.男性腹型肥胖者血浆网膜素水平的研究[J].天津医药,2011,14(7):2167-2171.
[6]张洁,邸阜生,王璐,等.血浆网膜素水平与代谢综合征的关系研究[J].天津医药,2010,38(12):1062-1064.
[7]蔡润策,魏丽,狄建忠,等.肥胖和乙型糖尿病患者脂肪组织网膜素的mRNA表达[J].中华医学杂志,2009,89(6):381-384.
[8]Liu R,Wang X,Bu P.Omentin-1 is associated with carotid atherosclerosis in patients with metabolic syndrome[J].Diabetes Res Clin Pract,2011,93(1):21-25.
[9]Shibata R,Takahashi R,Kataoka Y,etal.Association of a fat-derived plasma protein omentin with carotid artery intimamedia thickness in apparently healthy men[J].Hypertens Rea,2011,34(12):1309-1312.
[10]Moreno-Navarrete JM,Catalán V,Ortega F,etal.Circulating omentin-1 concentration increases after weight loss[J].Nutr Metab(Lond),2010,9(7):27.
[11]刘志文,周智广,唐炜立,等.新诊2型糖尿病亚临床动脉粥样硬化进展的影响因素[J].中华全科医师杂志,2006,5(8):470-474.
[12]Libby P.Inflammation in atheroselerosis[J].Nature,2002,420(6917):868-874.
[13]Pickup JC.Inflammation and activated innate immunity in the pathogenesis of type 2 diabetes[J].Diabetes Care,2004,27(3):813-823.
[14]任涛,李枚娟,王焱,等.动脉粥样硬化与炎症反应关系的研究进展[J].中国老年学杂志,2010,30(10):1464-1467.
[15]Tan BK,Adya R,Farhatullah S.Omentin-1,a novel adipokine,is decreased in overweight insulin-resistant woment with polycystic ovary syndrome:exvivo and in vivo regulation of omentin-1 by insulin and glucose [J].Diabetes,2008,57(4):801-808.
[16]矫磊,刘金波,凌明英,等.网膜素-1、内脂素与新诊断2型糖尿病患者动脉粥样硬化的相关性[J].山东大学学报,2010,48(1):8-16.
Study of the Relationship between Omentin-1 and Subclinical Atherosclerosis in Newly Diagnosed Type 2 Diabetes Patients
LIAOChun-mei1,MAWei2.
(1.DepartmentofGeneralMedicine,GuilinPeople′sHospital,Guilin541000,China; 2.DepartmentofPathology,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Abstract:ObjectiveTo investigate the relationship between the serum omentin-1 levels and subclinical atherosclerosis in newly diagnosed type 2 diabetes patients(T2DM).MethodsA total of 85 cases with newly diagnosed type 2 diabetic in Guilin People′s Hospital from Jan.2012 to May 2013 were included as the research objects,and were divided into T2DM without plaque group(42 cases) and T2DM with subclinical(43 cases) according to the carotid artery ultrasonography results,another 42 healthy people for health checkup during the same period were included as the control group.The serum omentin-1,fasting plasma glucose,fasting insulin,blood lipid,HbA1c,hs-CRP,IMT,BMI,waist to hip ratio,HOMA-IR were tested and calculated and the relationship between omentin-1 and subclinical atherosclerosis was analyzed.ResultsThe omentin-1 levels in the control group,T2DM without plaque group,T2DM with plaque group were going down gradually,and the pairwise differences were statistically significant(P<0.05).The omentin-1 levels were negatively correlated with BMI,waist to hip ratio,TG,TC,LDL-C,HbA1c,hs-CRP,fasting insulin,fasting plasma glucose,and HOMA-IR(P<0.05),but was positively correlated with HDL-C(P<0.01).Logistic regression analysis showed that BMI,waist to hip ratio,HOMA-IR were independent influencing factors for omentin-1.ConclusionSerum omentin-1 levels,associated with fat,insulin sensitivity,are likely to play an important role in insulin resistance and subclinical atherosclerosis occurrence and development.
Key words:Omentin-1; Subclinical atherosclerosis; Newly diagnosed type 2 diabetes mellitus; Insulin resistance
收稿日期:2013-10-28修回日期:2014-02-14编辑:伊姗
doi:10.3969/j.issn.1006-2084.2015.04.059
中图分类号:R589.9
文献标识码:A
文章编号:1006-2084(2015)04-0729-04

