植块法分离培养人脐带间充质干细胞
胡文龙 杜玉丹 王丽丽 汪建样 耿书国 殷嫦嫦
(1南昌大学研究生院医学部 江西南昌 330006;
2九江市妇幼保健院 江西九江 332000;
3九江学院基础医学院 江西九江 332000)
植块法分离培养人脐带间充质干细胞
胡文龙1杜玉丹2王丽丽3汪建样1耿书国1殷嫦嫦3
(1南昌大学研究生院医学部江西南昌330006;
2九江市妇幼保健院江西九江332000;
3九江学院基础医学院江西九江332000)
摘要:目的探讨体外植块法分离人脐带间充质干细胞的可行性,为体外获取纯度较高的人间充质干细胞提供理论基础。 方法采用植块法分离培养人脐带间充质干细胞,在倒置相差显微镜下观察细胞的黏附、增殖及形态学的变化,并采用CCK-8法绘制P3代细胞生长曲线。结果脐带组织贴壁培养6~10d即可从组织块边缘爬出的成纤维样细胞,传代后,细胞均呈长梭形,以栅栏样、漩涡样及鱼群样贴壁生长,细胞间紧密排列,细胞生长曲线呈近似S型。结论植块法能从人脐带组织中简便高效地分离出高纯度、高增殖活性的人脐带间充质干细胞。
关键词:人脐带间充质干细胞,植块法,分离培养
间充质干细胞(mesenchymal stem cells,MSCs)属于多能成体干细胞,具有高度增殖和多向分化潜能,能分化为间叶组织细胞(脂肪、骨、肌肉、软骨)[1]。自1966年Friedenstein等[2]首次从骨髓中分离出MSCs以来,研究者已从多种组织获得MSCs,包括脂肪、脐带血、脐带和胎盘[3-7]等。
MSCs作为组织工程最重要的种子细胞之一,具有广阔的应用前景,如何简单高效地获得高纯度的MSCs是研究的关键。骨髓来源的基质细胞最早被鉴定为MSCs,因而关于骨髓间充质干细胞的研究及临床应用也相对较成熟[8-10],但骨髓取材有创,增殖和分化潜会随供体年龄的增加而下降等问题限制了骨髓间充质干细胞的应用[11]。因此,寻求一条新的高效地获取MSCs的途径具有重要的科研及临床应用价值。近年来,人脐带间充质干细胞(human umbilical cord-derived mesenchymal stem cells, hUC-MSCs )以其取材方便、细胞含量丰富、免疫原性低、微生物感染率低、干性强、增殖能力高等诸优点近年来被广泛研究。本实验采用组织块贴壁法分离培养hUC-MSCs,并观察细胞形态及其贴壁、增殖能力,旨在建立一种高效的hUC-MSCs分离培养方法,为组织工程和细胞工程奠定坚实的基础。
1材料与方法
1.1材料
脐带标本由九江市妇幼保健院提供,取自健康剖宫产的新生儿,产妇及家属对实验均知情同意并签字,并已获得医院伦理委员会批准。
1.2主要试剂和仪器设备
胎牛血清、α-MEM培养基( Hyclone公司),0.25%胰蛋白酶-EDTA消化液( Gibco公司),培养皿、培养瓶、96孔板( Corning公司),细胞计数试剂盒8(cell counting kit 8,CCK-8;上海经科化学科技有限公司),倒置相差显微镜(Nikon公司),Model680 型酶标仪(BIO-RAD公司)。
1.3方法
1.3.1hUC-MSCs分离培养取得脐带后立即进行处理,如不能立即操作可4℃保存,但避免超过6h。于超净台内取出脐带组织,用含1%双抗的的PBS反复冲洗掉脐带表面及脐带动静脉内的血液,用含抗生素的PBS浸泡脐带组织10~15min。沿脐静脉内腔纵向剪开血管,剥离脐静脉内膜及羊膜,抽出两条脐动脉,将剩余脐带结缔组织(主要为华通氏胶)剪碎成体积约3~5mm3大小的组织块,接种于直径为3. 5cm 的塑料皿中,倒扣小皿约5min,而后加入1mL含1%双抗的α-MEM培养基(FBS的体积分数为10%),置于37℃、含5% CO2饱和的湿度孵箱中培养。第2d添加培养基至3mL,勿动组织块,以后每3d更换培养基并去除漂起的组织块。观察组织块周围细胞爬出情况,如贴块周围细胞密集,可于镜下标记,及时剔除。如果细胞爬出较多,生长密集,可提前消化传代。14d后去除有细胞爬出的培养皿内的全部贴壁组织块,待局部细胞密集时及时消化传代,接种于25cm2塑料培养瓶内。
1.3.2hUC-MSCs传代培养及纯化细胞融合达80%~90%时,PBS漂洗2遍,加入1.5mL 0.25% EDTA-胰酶消化细胞,待hUC-MSCs明显变圆且部分脱壁时加入等体积完全培养基终止消化,吹打后将培养基转移至离心管中,1 500r/min离心5min,加入完全培养基,制成单细胞悬液,按1∶3接种于培养瓶内,6h后换液,利用差速贴壁法进行纯化。注意观察各代细胞形态变化、贴壁及倍增时间,了解hUC-MSCs黏附能力及增殖活性。
1.3.3CCK-8法绘制P3代hUC-MSCs生长曲线取P3代hUC-MSCs常规消化、离心,细胞计数,调整细胞密度为5×103/mL,按200μL/孔加入96孔板,设置8个复孔及2个空白孔,分别于种板后第1d、3d、5d、7d、9d、11d共7个时间点各取一块96孔板,每孔加入CCK-8 试剂10 μL,孵育2 h后,于酶标仪处测定其450 nm 波长吸光度(A)值,绘制hUC-MSCs生长曲线。
2结果
2.1细胞形态观察结果
植块法培养6~10d可见部分组织块收缩、变圆,可见有细胞从其边缘爬出,形态呈长梭形、三角形、不规则形等,散在分布或形成小克隆呈放射状排列(图1A、1B);10~12dd后,组织块周边细胞迅速增加,达70%~80%融合,细胞呈平行或放射状排列(图1C)。细胞以组织块为中心呈放射状向周围生长,15d后细胞间排列紧密,局部融合几达100%,呈旋涡状细胞形态大致一致,呈典型的长梭形(图1D)。传代后细胞在30min内开始贴壁,均匀贴附于瓶底,逐渐展开变平,呈不规则的多边形,4h后贴壁基本完成,细胞基本呈长梭形。经约1d静止期后,出现细胞集落,呈对数增长,2~3d后铺满瓶底达90%左右,细胞基本呈单一的成纤维细胞形态,以漩涡样、栅栏样及鱼群样集落式生长,基本未见杂细胞生长(图1E)。细胞增殖迅速,第2代至第10代hUC-MSCs均能在传代72h内铺满瓶底达90%以上,且细胞基本维持原有形态,未出现明显老化现象(图1F、1G)。传至第11代后hUC-MSCs胞体开始逐渐变大,部分细胞内可见黑色颗粒状物质,折光性降低,细胞排列不规则,培养基漂浮少量碎片状物质,呈老化征象。细胞变形慢,贴壁时间延长,倍增时间明显延长(图1H、1I) 。
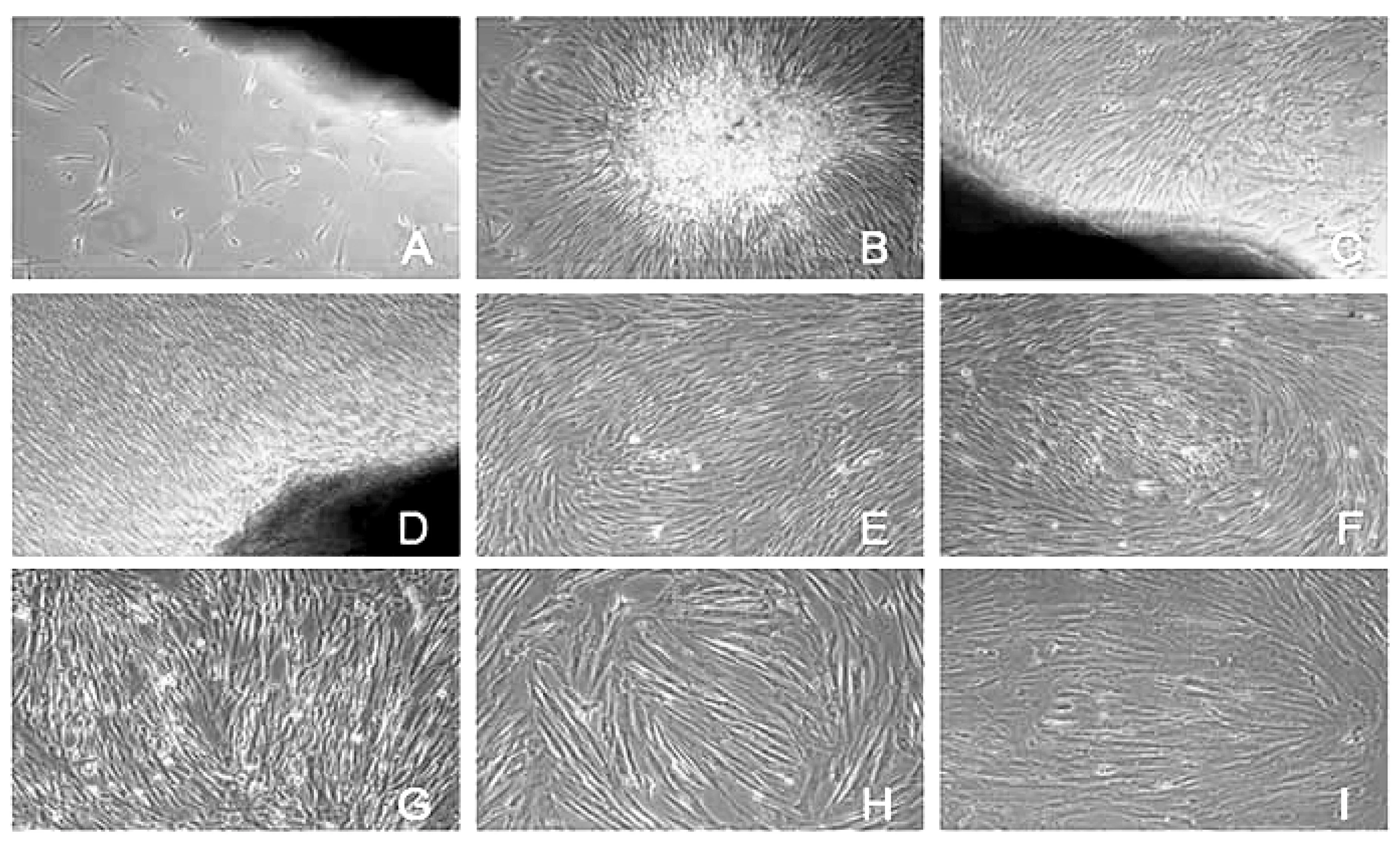
图1 hUC-MSCs形态学观察(倒置相差显微镜×100)
A.原代细胞培养第6dB.原代细胞培养第8dC.原代细胞培养第10dD.原代细胞培养第14dE.第1代细胞培养第3dF.第5代细胞培养第2dG.第10代细胞第2dH.第11代细胞培养第2dI.第14代细胞培养第4d
2.2hUC-MSCs生长曲线
hUC-MSCs生长曲线近似S形。细胞接种前3d增殖基本静止,处于潜伏期;3~9d细胞开始快速增殖,呈线性增长,第9d后细胞进入平台期,曲线逐渐变得平缓,详见图2。
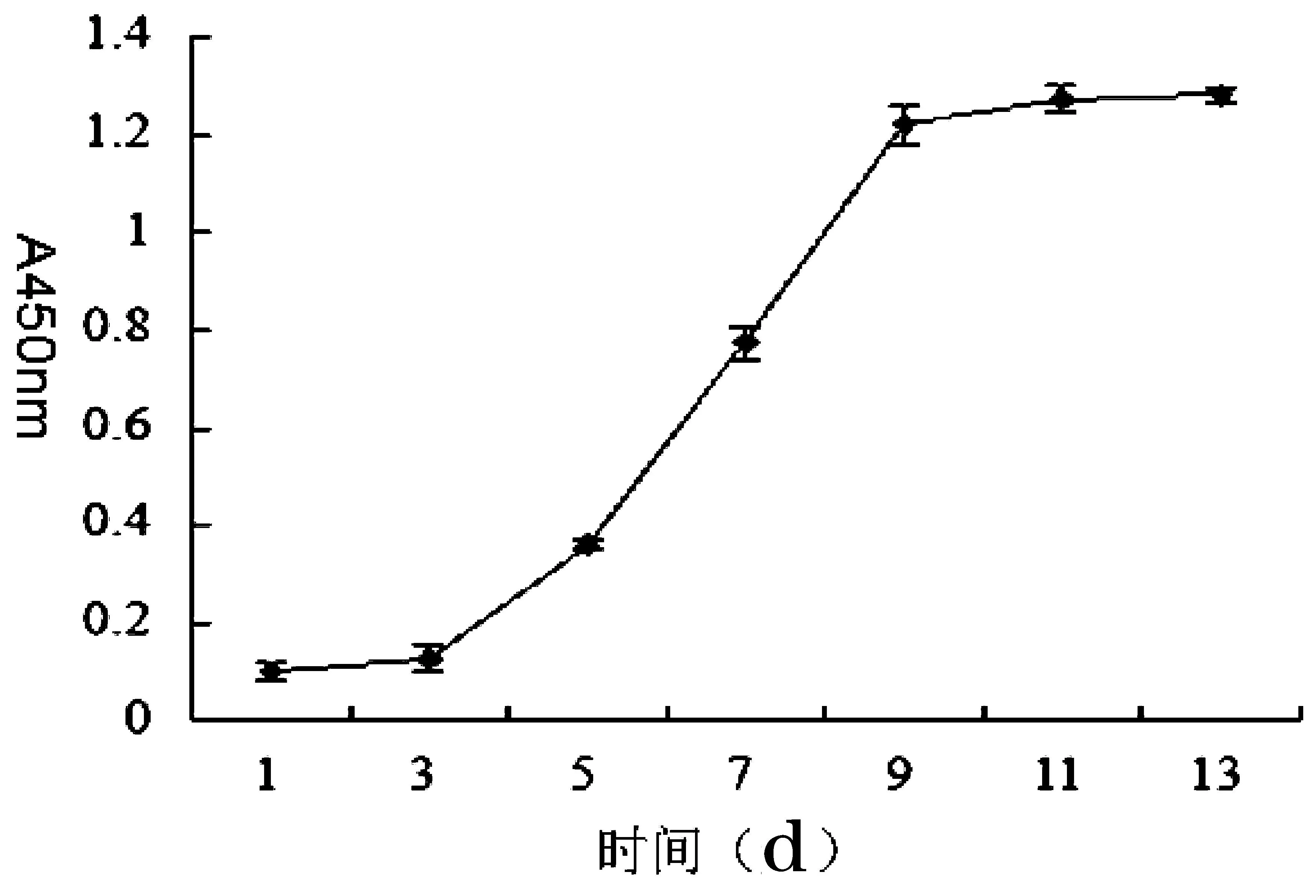
图2 hUC-MSCs生长曲线
3讨论
2003年Romanov[12]等首次从脐带组织中分离培养出了MSCs,进而建立了hUC-MSCs的分离培养方法。hUC-MSCs的分离培养方法包括植块法和酶消化法[13]。酶消化法主要是利用I型或II型胶原酶,也有使用胰蛋白酶降解脐带基质,从而分离出细胞。尽管酶消法可缩短原代培养时间,但容易损伤细胞,从而造成hUC-MSCs的增殖和多向分化潜能下降。hUC- MSCs具有很强的塑料黏附能力,而组织块中其他细胞(主要是内皮细胞、造血系细胞)等不具备或贴壁能力较差,可通过差速贴壁法及传代有效去除该类细胞,则可以利用植块法分离培养细胞。该方法操作简单,hUC-MSCs损伤少、纯度高,活力保持良好。徐燕等[14]比较了植块法、胶原酶法、胶原酶与胰酶联合消化法,发现无论是hUC-MSCs的产出率,或是细胞增殖能力均较后两种方法具有明显优势。
该实验通过植块法从健康足月产胎儿脐带结缔组织中成功分离培养出形态一致的纤维样细胞。来源于身体健康、营养状态良好的母婴的脐带结缔组织肥厚、胶质丰富,近胎盘段脐带易于分离出高质量的hUC-MSCs。取得脐带后需尽早处理,不宜存放过久。Wharton's jelly及脐静脉皮下层干细胞含量丰富[15-16],因此剪取血管周围胶冻状组织可以提高细胞分离效率。组织块保持在5mm3以内,利于组织贴壁及细胞爬出。培养皿内组织块分布不宜过密,否则不利于细胞爬出及向周围扩增。首次添加培养基以没过组织块一半为宜,可有效避免组织块漂浮;次日,待组织块贴壁牢固后增加培养基。注意观察细胞爬出及生长情况,及时剔除周围细胞密集的组织块,为细胞腾出有效生长空间。细胞局部密集时及时消化传代,可多个培养皿内细胞一起种入一个培养瓶或一个培养皿内细胞种于多个培养瓶内,以保证合适的细胞密度。本实验培养的hUC-MSCs传代后成漩涡状或鱼群样生长,P3代细胞生长曲线显示细胞增殖非常活跃,活性高,能稳定地保持其生长特性,与大多数文献报道一致[17-19]。
hUC-MSCs没有特异性的鉴定标志物[20],与其他来源的MSCs类似,CD29、CD73、CD90、CD105强阳性表达,不表达造血干细胞标记物CD34、CD45及人类白细胞抗原HLA-DR[1],hUC-MSCs还低表胚胎干细胞相关基因NANOG和OCT4[21]。Kobayashi等研究表明脐带Wharton's jelly与骨髓来源的的基质干细胞具有相似的生物学特性[22]。与BMSCs相比,UC-MSCs具有更强的增殖能力及更低的免疫源性[22]。
本实验采用植块法分离培养hUC-MSCs,原代培养即得到形态比较一致的纤维样细胞,经差速贴壁法换液及传代后,细胞均呈长梭形,并形成漩涡样、栅栏样或鱼群样克隆,根据其形态特征及塑料贴壁能力可初步断定该成纤维样细胞为hUC-MSCs。细胞生长曲线及长期传代观察发现该细胞不仅增殖能力强大,并且能长期自我维持和更新。这说明人脐带组织植块法不仅操作简便,短期即可获得高纯度的hUC-MSCs,而且不会造成细胞损伤,最大程度地保证了细胞生物学活性,为组织工程、再生医学等领域hUC-MSCs的研究和临床应用奠定了坚实的基础。
参考文献:
[1]Dominici M,Le Blanc K,Mueller I,et al. Minimal criteria for defining multipotent mesenchymal stromal cells[J]. The International Society for Cellular Therapy position statement. Cytotherapy,2006,8(4):315.
[2]Friedenstein AJ,Piatetzky-Shapiro II,Petrakova KV. Osteogenesis in transplants of bone marrow cells[J]. Journal of Embryology and Experimental Morphology,1966,16(3):381.
[3]Kucerova L,Skolekova S,Matuskova M,et al. Altered features and increased chemosensitivity of human breast cancer cells mediated by adipose tissue-derived mesenchymal stromal cells[J]. BMC cancer,2013,13(1):535.
[4]Kim SM,Lim JY, Park SI,et al. Gene therapy using TRAIL-secreting human umbilical cord blood-derived mesenchymal stem cells against intracranial glioma[J]. Cancer Research,2008,68(23):9614.
[5]Bieback K,Kluter H. Mesenchymal stromal cells from umbilical cord blood[J]. Current Stem Cell Research & Therapy,2007,2(4):310.
[6]Flynn A,Barry F,O'brien T. UC blood-derived mesenchymal stromal cells:an overview[J]. Cytotherapy,2007,9(8):717.
[7]Gucciardo L,Lories R,Ochsenbein‐Klble N,et al. Fetal mesenchymal stem cells: isolation, properties and potential use in perinatology and regenerative medicine[J]. BJOG: An International Journal of Obstetrics & Gynaecology,2009,116(2):166.
[8]Secchiero P,Zorzet S,Tripodo C, et al. Human bone marrow mesenchymal stem cells display anti-cancer activity in SCID mice bearing disseminated non-Hodgkin's lymphoma xenografts[J]. PloS one,2010,5(6):e11140.
[9]Sage EK,Kolluri KK,McNulty K,et al. Systemic but not topical TRAIL-expressing mesenchymal stem cells reduce tumour growth in malignant mesothelioma[J]. Thorax,2014,69(3):638.
[10]Bianchi G,Morandi F,Cilli M, et al. Close interactions between mesenchymal stem cells and neuroblastoma cell lines lead to tumor growth inhibition[J]. PloS one,2012,7(10):e48654.
[11]Rao MS,Mattson MP. Stem cells and aging:expanding the possibilities[J]. Mechanisms of ageing and development,2001,122(7):713.
[12]Romanov YA,Svintsitskaya VA,Smirnov VN. Searching for alternative sources of postnatal human mesenchymal stem cells:candidate MSC‐like cells from umbilical Cord[J]. Stem cells,2003,21(1):105.
[13]Tong CK,Vellasamy S,Tan BC,et al. Generation of mesenchymal stem cell from human umbilical cord t3 using a combination enzymatic and mechanical disassociation method [J] .Cell Biol Int,2011,35(3):221.
[14]徐燕,李长虹,孟恒星,等.人脐带间充质干细胞分离培养条件的优化及其生物学特性[J].中国组织工程研究与临床康复,2009,13(32):6289.
[15]Tmyer DL,Weiss ML.Wharton's jerlly-derived cells are a primitive stromal cell population[J] Stem Cells,2008,26(3):591.
[16]Kestendjieva S,Kyurkchiev D,Tsvetkova G,et al. Characterization of mesenchymal stem cells isolated from the human umbilical cord[J]. Cell Biology International,2008,32(7):724.
[17]Baksh D,Yao R,Tuan RS. Comparison of proliferative and multilineage differentiation potential of human mesenchymal stem cells derived from umbilical cord and bone marrow[J]. Stem Cells,2007,25(6):1384.
[18]Mori Y,Ohshimo J,Shimazu T,et al. Improved explant method to isolate umbilical cord-derived mesenchymal stem cells and their immunosuppressive properties[J]. Tissue Eng Part C Methods,2015,21(4):367.
[19]Roy S,Arora S,Kumari P,et al. A simple and serum-free protocol for cryopreservation of human umbilical cord as source of Wharton’s jelly mesenchymal stem cells[J]. Cryobiology, 2014,68(3):467.
[20]Si YL,Zhao YL,Hao HJ,et al. MSCs:Biological characteristics, clinical applications and their outstanding concerns[J]. Aging Res Rev,2011,10(1):93.
[21]Nagamura-Inoue T,He H. Umbilical cord-derived mesenchymal stem cells: Their advantages and potential clinical utility[J]. World J Stem Cells,2014,6(2):195.
(责任编辑胡安娜)
[22]Lu LL,Liu Y,Yang SG,et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J].Haematologica,2006,91(8):1017.
Isolating and Culturing Human Umbilical Cord-derived Mesenchymal Stem Cells by Explantation Technique HU Wenlong1, DU Yudan2, WANG Lili3, WANG Jianyang1,GENG Shuguo1, YIN Changchang3
(1MedicineGraduateSchool,NanchangUniversity,Nanchang330006,Jiangxi;2MaternalandchildhealthhospitalofJiujiang,Jiujiang332000,Jiangxi;3SchoolofBasicMedicalSciences,JiujiangUniversity,Jiujiang332000,Jiangxi,China)
ABSTRACTObjective To explore the feasibility of isolating and culturing human umbilical cord-derived mesenchymal stem cells(hUC-MSCs)by explantation technique in vitro, and provide a theoretical basis for obtaining highpurityhMSCs.Method Isolating and Culturing human umbilicalcord-derivedmesenchymalstem cells by explantation technique.The adhesion,proliferation and morphology changes were observed under inverted phase contrast microscope.Growth curve of hUC-MSCsat passage 3 was drawn using cell counting kit8(CCK-8).Result At 6~10 days after umbilical cord tissue was adherent cultured, the fibroblast-like cells climbed out from the edges of the tissues. The cells were all fusiform shape, and closely packed like palisade, whirlpool and fish after passage. The cell growth curve was similar to the“S”. Conclusion With explantation technique, hUC-MSCs with high purity and potent expansion capacity could be isolated easily and effectively.
KEY WORDShuman cord-derived mesenchymal stem cells,explantation technique,isolation and culture
中图分类号:TP 393.2
文献标识码:A
文章编号:1674-9545(2015)04-0096-(05)
通讯作者:殷嫦嫦,yinchangchang112@163.com。
收稿日期:2015-10-20

