长牡蛎(Crassostrea gigas)鲜样组织八种成分含量近红外(NIR)模型的建立*
王卫军 杨建敏① 董迎辉 臧恒昌 王中平 孙国华
(1. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 烟台 264006; 2. 浙江万里学院生物与环境学院 宁波315100; 3. 山东大学药学院 国家糖工程技术研究中心 济南 250012; 4. 崆峒岛实业有限公司 烟台 264000)
近红外(Near Infrared,NIR)技术是一种对有机物成分含量快速分析的新型分析技术,它可以同时检测出样品中的多种成分参数。与传统的化学检测方法相比,NIR技术具有高通量、省时、省力、低成本以及环保无污染的特点(Osborneet al,1993)。NIR技术是研究动物肉质性状成分指标的高效方法,在选择育种和成分含量快速检测方面应用广泛。Zamora-Rojas等(2011)将 NIR技术应用于西班牙伊比利亚猪肉质性状的选育(Iberian Pig Breeding,IPB),由于每年需要对大量候选个体的多项指标进行分析检测,NIR技术的使用使得检测时间和成本大大降低。Zomeño等(2012)通过建立 NIR模型,快速分析了选育系143个家兔的肌间脂肪酸的变化,大大提高了实验效率。Folkestad等(2008)建立了大西洋鲑肉质中脂肪和色素含量的分析模型,解决了鲑鱼肉质分析过程中两个指标的同时、快速和无损伤检测的难题。Fluckiger等(2011)建立了鲍活体、新鲜样组织和冷冻干燥腹足肌样品的糖原含量快速检测模型,并成功进行了预测分析。Wu等(2013)运用NIR技术检测鲑鱼肉质的保水能力,化学真实值与光谱预测值的相关系数到达0.941,准确度非常高。NIR技术的应用,大大提高了肉质性状成分的分析效率,并显著的降低了检测成本。
长牡蛎(Crassostrea gigas)又称太平洋牡蛎,具有环境适应性强、生长迅速、营养丰富等优点,是产量最高的世界广布性大宗经济贝类。2013年我国牡蛎总产量达 421.9万 t (农业部渔业渔政管理局,2014),为人们提供了丰富的蛋白源。牡蛎不同的风味和营养品质影响着消费者的消费倾向,进而决定着其商品价值。随着生活水平的不断提高,人们对于牡蛎的消费,更加注重肉质的风味和营养,而牡蛎的肉质性状是决定其口感和营养品质的重要经济性状,选育口感佳、营养好的新品种是牡蛎高端市场的迫切需求。目前,对于长牡蛎育种方面的研究主要集中在利用杂种优势进行种间杂交(张跃环等,2014),壳色新品系的选育(丛日浩等,2014)和群体选育快速生长新品系(王庆志等,2013)方面,有关牡蛎肉质性状新品系选育的工作在国内外均未见报道。究其原因,是因为对肉质性状进行新品种选育时需要对大量候选个体进行多个营养指标的分析,传统的化学检测方法具有耗时长、效率低、检测成本高的缺点。因而,建立快速高效的肉质性状分析模型是开展牡蛎肉质性状新品系选育的基础。本研究测定了长牡蛎8种成分含量,并运用NIR技术建立了分析预测模型; 研究结果对开展大规模长牡蛎多种成分含量,选育肉质性状长牡蛎新品系具有重要意义。
1 材料与方法
1.1 主要仪器设备
傅里叶变换 NIR光谱仪(Antaris MX,USA),配备 RESULTTM样本光谱采集的集成软件以及数据处理软件 TQ analyst (Thermo Fisher,USA),酶标仪(BIO-RAD,USA)、原子荧光光谱仪(PA-10)和微波消解系统(Mars Xpress,USA)、高效液相色谱仪(Waters Inc.,USA)、火焰原子吸收分光光度计(AA-800,USA)、自动凯氏定氮仪(FOSS kjeltecTM2300,Sweden)、索氏提取器、马福炉和大型真空冷冻干燥机(ZDGX5),匀浆机(IKA®T18 basic ULTRA-TURRAX®,Germany)。
1.2 样本采集
本实验在2012年11月—2013年8月期间,分别从山东乳山、芝罘岛、崆峒岛和刘公岛,辽宁东港和小山岛,江苏赣榆等长牡蛎主产区的7个地点,采集了54批野生和养殖的长牡蛎样品共计94份,样品鲜软体部肉重(不包含闭壳肌)为 0.51—44.69g,样品包含了0.5龄贝、1.5龄贝和2.5龄贝。在不能辨别雌雄的季节,将同批样品依据大个体和小个体分为两组,作为极大值样本组和极小值样本组; 在2013年 5—7月,根据雌雄不同,将同批样品分为雌雄样本组。
1.3 样品前处理
将长牡蛎进行解剖,取软体组织,每份样本20—60g,放置在50mL的冷冻离心管中。首先用剪刀将软组织剪碎,再用匀浆机在最大转速匀浆30—50s,匀浆过程中,将离心管置于冰盒中。将匀浆好的样本分为两部分: 一部分用于NIR光谱采集,另一部分用于8种成分含量的化学测定分析。
1.4 近红外光谱采集
光谱扫描前,应用RESULT集成软件编定样品光谱采集的工作流程,并使光谱仪开机预热至少0.5 h。在直径 1cm的石英杯中加入高度为 1.5cm匀浆好的样本。采用漫反射光谱,光谱扫描波数范围 10000—4000 cm–1,扫描次数为 32次,分辨率为 8 cm–1,用log(1/R)漫反射方法表示吸收光谱。测量时环境温度为20 °C,相对湿度为10 %。每次采集样品前采集背景光谱来消除背景的影响,测量时间小于1 min。
1.5 化学真实值测定
在山东省海洋资源与环境研究院中心实验室对94份样本的 8种成分含量的化学真实值的进行了测定。总蛋白质、总脂肪、锌和硒和灰分含量的测定,依据行业标准进行(中华人民共和国卫生部,2010a,b;中华人民共和国国家质量监督检验检疫局等,2008a,b,c); 牛磺酸含量的测定参考陈申如等(2013); 糖原含量测定使用 EnzyChromTM糖原试剂盒(BioAssay Systems,USA)。
1.6 模型建立和验证
利用TQ Analyst (version 9.1.17,USA)软件处理采集的光谱数据,选用偏最小二乘法(Partial Least Squares,PLC)作为建立定标模型的化学计量方法,选择软件自动推荐的光谱范围,并对模型进行优化和检验,筛选最佳的光谱预处理方法,以确保获得数理指标最理想的数学模型。
通过交叉验证的方法来对模型进行内部验证,即: 每次从校正样品集中取出1个样品作为临时验证样品,以其余的样品进行建模,然后对这1个样品进行预测,如此循坏,则会分别得到所有样品的交叉预测值。而外部验证则是重新收集一批标准样品用作验证样品。内部验证和外部验证的预测值对比分析从而得到模型的参考值。主要通过比较预测值与化学分析值的相关系数(R)、交互验证残差均方根(Root mean square error of cross-validation,RMSECV)、预测残差均方根(Root mean square error of external prediction,RMSEP)和 RPD(验证用样本真实值的标准差(SD)与RMSECV或者 RMSEP的比值,即 RPDCV=SD/RMSECV 或者 RPDEV=SD/RMSEP)等指标来衡量定标模型的准确性。由于光谱仪的系统误差、光谱信号的漂移等原因,所测得样品的NIR可能出现异常,使得模型预测精度下降(陈雪英等,2009),本实验采用TQTMAnalyst软件中马氏距离来判别异常点,进行样本异常值的剔除。本实验中94份样品的建模集和验证集的样本数见表1。
表1 长牡蛎鲜样组织建模集和验证集样本8种成分含量Tab.1 Composition of the calibration and validation set of flesh tissue samples as determined by chemical reference methods
2 结果
2.1 长牡蛎鲜样组织8种成分含量指标描述性统计
本实验在我国多个长牡蛎产地选取不同发育阶段、不同养殖方式和不同年龄的 94份样品,超过Windham等(1989)所提出的最低样本数为 50份的要求。表1为8种不同成分建模集和验证集样本的数目和化学真实值的分析结果。实验中分析的各种成分含量范围较大,含量最大值与最小值的比值分别为: 水分(1.23),糖原(80.63),总蛋白质(3.20),总脂肪(33.74),牛磺酸(3.28),锌(5.55),硒(4.97)和灰分(2.51),符合近红外分析模型建立过程中对样品含量分布范围广的要求。
2.2 光谱数据预处理
长牡蛎鲜样组织样本的 NIR漫反射原始光谱如图1所示。建模过程中对不同成分的光谱数据进行不同的平滑处理,最终选择适合各自成分模型的最佳参数组合(图 2)。根据筛选出的最佳参数组合,确定长牡蛎鲜样组织水分、糖原、总蛋白质、总脂肪、牛磺酸、锌、硒、灰分的预测模型。各成分含量模型所用的光谱范围、光谱处理方法以及建模用的主因子数等主要参数见表2。
2.3 模型建立及优化

图1 长牡蛎鲜样组织所有样本的NIR漫反射原始光谱Fig.1 Original NIR spectra of all flesh samples of Pacific oyster C. gigas
根据 TQ Analyst软件的异常值推荐,不同成分含量样本异常值的剔除数见表3。样本各成分含量建模的结果中,水分、糖原和总蛋白质含量的相关系数(RC)较高,均大于0.96,其RMSEC值均较小(图3a,b,c); 交叉验证相关系数(RCV)和外部验证的相关系数(REV)较高,均大于0.93,其RMSECV值和RMSEP值也较小; 模型验证的重要参数 RPD值变化范围为2.80—7.04 (表3),说明水分、糖原和总蛋白质含量的模型精确度高,可用于长牡蛎鲜样组织的成分预测。另一方面,总脂肪、牛磺酸、锌、硒、灰分含量5个成分,建模过程中的RC值和RMSEC值等参数均不理想(图 3d); 交叉验证和外部验证的相关系数(RCV和REV)均低于0.85,RPD值除Zn含量以外都低于2.5(表3)。综合考虑多个衡量指标,总脂肪、牛磺酸、锌、硒、灰分5个成分含量的NIR模型不适合于长牡蛎鲜肉组织的精确定量分析。
图2 长牡蛎鲜样组织糖原含量样本NIR光谱一阶求导处理Fig.2 Glycogen content of NIR treatment with first derivative of flesh tissue samples of Pacific oyster C. gigas

表2 长牡蛎成分含量建模集和验证集光谱数据处理参数Tab.2 Parameters of the calibration and validation sets for chemical composition in Pacific oyster C. gigas
3 讨论
3.1 鲜样本模型与干样本模型的比较
本实验在建立长牡蛎鲜样组织NIR模型的同时,建立了长牡蛎冷冻干燥样本的 NIR模型,鲜样组织(浆状)和干样(粉末)样品两种不同处理形态的建模效果存在差异。其中,粉末样品模型结果显示,糖原和总蛋白质含量模型可以精确的预测未知样本的含量,总脂肪、锌、硒、灰分含量可准确的预测未知样本的含量,只有牛磺酸含量模型的预测效果不好(未发表数据)。长牡蛎鲜样组织和干样样品两个实验结果中,糖原和总蛋白质含量建模效果一致,均可以精确的预测未知样品; 牛磺酸含量模型在两个实验中均不能准确的预测未知样品; 而鲜样组织的脂肪、锌、硒和灰分含量的模型却不能准确预测。Viljoen等(2005,2007)在对鸵鸟肉和羊肉鲜样组织和冷冻干燥样品研究过程中发现,冷冻干燥样品模型的预测效果更好。对冷冻干燥样品进行光谱分析时,样品温度变化不明显; 而且冷冻干燥样品可以避免在红外光谱区域的非常高的吸收峰(Murrayet al,1987),这些噪音可能降低模型预测的准确性(Pedersenet al,2003)。由于长牡蛎鲜样组织中水分含量高(约 80%),导致光谱采集过程中温度变化的不确定性,这可能是导致建模不成功的主要原因。
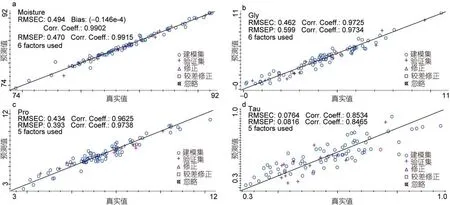
图3 建模过程中水分、糖原、总蛋白质和牛磺酸含量NIR主要参数Fig.3 NIR parameters of moisture,glycogen,protein and taurine content in the process of modelinga、b、c为精确度高的长牡蛎水分、糖原和总蛋白质含量NIR模型的参数指标; d为精确度低的NIR模型的参数指标(以牛磺酸含量为例)
3.2 模型建立过程中的主要参数标准
在构建的模型中,建模相关系数(RC)、交互验证相关系数(RCV)和外部验证相关系数(REV)值越接近 1模型的预测效果越好,在本实验中,各个相关系数都在0.93以上,最高值是0.99,说明模型的精确度非常高。同时模型的 RPD值是衡量模型是否准确的另一个重要指标,好的模型具有高的RPD值。当RPD值大于 2.5时模型可以进行准确预测(Guyet al,2011;Zhouet al,2012)。在本实验中虽然锌含量预测模型的RPD值超过 10,但不论是其RC值、RCV值还是REV值均小于0.52,综合考虑各个指标,锌含量的NIR模型不具备准确预测的能力。
牛磺酸是一种游离氨基酸,属于有机物,理论上通过建立 NIR模型,可以准确的预测未知样本的含量。但是本实验中牛磺酸含量模型预测效果差,分析原因可能是牛磺酸化学真实值的SD值小(Zhouet al,2012),变动范围窄(Prietoet al,2009)所致。
3.3 模型建立对肉质性状选育的意义
本实验结果将用于长牡蛎肉质性状选育、育种世代的鉴定及种质资源评价等研究。以上这些方面的研究需要对成千上万个个体、多个指标进行成分含量的分析,因此常规的化学分析方法难以快捷、高效批量的完成这些分析工作。课题组将运用本实验结果对构建的长牡蛎家系进行成分含量分析,进行遗传参数估计和育种值估计,将为开展肉质性状选育奠定基础。
4 结论
NIR技术可以快速精确地测定长牡蛎鲜肉组织(浆状)中的水分、糖原和总蛋白质 3种成分含量,但是对总脂肪、锌、硒、牛磺酸和灰分含量不能准确测量。本研究中建立的以上3种成分含量NIR模型,可快速、准确、无环境污染地对长牡蛎肉质进行分析,并对肉质性状选育及育种世代的鉴定和种质资源评价都有非常重要的意义。
王庆志,李 琪,孔令锋等,2013. 长牡蛎第三代选育群体生长性状的选择效应. 水产学报,37(10): 1487—1494
中华人民共和国卫生部,2010a. 食品安全国家标准——食品中硒的测定,GB 5009.93-2010,中华人民共和国国家标准.北京: 中国标准出版社
中华人民共和国卫生部,2010b. 食品安全国家标准——食品中蛋白质的测定,GB 5009.5-2010,中华人民共和国国家标准. 北京: 中国标准出版社
中华人民共和国国家质量监督检验检疫局,中国国家标准化管理委员会,2008a. 肉与肉制品——总灰分测定,GB/T 9695.18-2008,中华人民共和国国家标准. 北京: 中国标准出版社
中华人民共和国国家质量监督检验检疫局,中国国家标准化管理委员会,2008b. 肉与肉制品——锌的测定,GB/T 9695.20-2008,中华人民共和国国家标准. 北京: 中国标准出版社
中华人民共和国国家质量监督检验检疫局,中国国家标准化管理委员会,2008c. 食品中粗脂肪的测定,GB/T 14772-2008,中华人民共和国国家标准. 北京: 中国标准出版社
丛日浩,李 琪,葛建龙等,2014. 长牡蛎 4种壳色家系子代的表型性状比较. 中国水产科学,21(3): 494—502
农业部渔业局,2013. 中国渔业统计年鉴. 北京: 中国农业出版社
张跃环,王昭萍,喻子牛等,2014. 北方沿海香港牡蛎(♀)×长牡蛎(♂)杂种中期优势评估. 水产学报,38(9): 1310—1317
陈申如,胡 阳,倪 辉等,2013. 高效液相色谱法测定牡蛎中牛磺酸含量. 中国食品学报,13(2): 193—198
陈雪英,李页瑞,陈 勇等,2009. 近红外光谱分析技术在赤芍提取过程质量监控中的应用研究. 中国中药杂志,34(11): 1355—1358
Fluckiger M,Brown M R,Ward L Ret al,2011. Predicting glycogen concentration in the foot muscle of abalone using near infrared reflectance spectroscopy (NIRS). Food Chemistry,126(4): 1817—1820
Folkestad A,Wold J P,Rørvik K Aet al,2008. Rapid and non-invasive measurements of fat and pigment concentrations in live and slaughtered Atlantic salmon (Salmo salarL).Aquaculture,280(1—4): 129—135
Guy F,Prache S,Thomas Aet al,2011. Prediction of lamb meat fatty acid composition using near-infrared reflectance spectroscopy (NIRS). Food Chemistry,127(3): 1280—1286
Murray I,Williams P C,1987. Chemical principles of near-infrared technology. In: Williams P C,Norris K eds.Near Infrared Technology in the Agricultural and Food Industries. 2nd ed. St. Paul,Minnesota,USA: American Association of Cereal Chemists,Inc,17—34
Osborne B G,Fearn T,Hindle P H,1993. Near-Infrared Spectroscopy in Food Analysis. Harlow,Essex,UK:Longman Scientific and Technical
Pedersen D K,Morel S,Andersen H Jet al,2003. Early prediction of water-holding capacity in meat by multivariate vibrational spectroscopy. Meat Science,65(1): 581—592
Prieto N,Roehe R,Lavín Pet al,2009. Application of near infrared reflectance spectroscopy to predict meat and meat products quality: A review. Meat Science,83(2): 175—186
Viljoen M,Hoffman L C,Brand T S,2005. Prediction of the chemical composition of freeze dried ostrich meat with near infrared reflectance spectroscopy. Meat Science,69(2):255—261
Viljoen M,Hoffman L C,Brand T S,2007. Prediction of the chemical composition of mutton with near infrared reflectance spectroscopy. Small Ruminant Research,69(1—3): 88—94
Windham W R,Mertens D R,Barton F E,1989. Protocol for NIRS Calibration: Sample Selection and Equation Development and Validation. In: Marten G C,Shenk J S,Barton F E eds. Near Infrared Reflectance Spectroscopy(NIRS): Analysis of Forage Quality. USDA Agricultural Handbook 643. Washington,D C.: US Government Printing Office,96
Wu D,Sun D W,2013. Application of visible and near infrared hyperspectral imaging for non-invasively measuring distribution of water-holding capacity in salmon flesh.Talanta,116: 266—276
Zamora-Rojas E,Garrido-Varo A,De Pedro-Sanz Eet al,2011.Monitoring NIRS calibrations for use in routine meat analysis as part of Iberian pig-breeding programs. Food Chemistry,129(4): 1889—1897
Zhou L J,Wu H,Li J Tet al,2012. Determination of fatty acids in broiler breast meat by near-infrared reflectance spectroscopy. Meat Science,90(3): 658—664
Zomeño C,Juste V,Hernández P,2012. Application of NIRS for predicting fatty acids in intramuscular fat of rabbit. Meat Science,91(2): 155—159

