大花紫薇幼苗对盐胁迫的生理响应1)
滕维超 郑绍鑫 覃梅 尹婷 王艺锦 王凌晖
(广西大学,南宁,530004) (广西区六万林场) (广西大学)
责任编辑:程 红。
盐渍化是土地退化的主要类型之一,其影响绿洲生态系统稳定的同时也制约农林业的发展。土壤过度积累交换性钠,会造成土壤物理性状恶化、植物蛋白质合成受限等不良影响[1-2]。通过对植物耐盐机理的研究,选择培育优良的耐盐树种,可以为改良利用盐碱地提供技术支持[3]。
大花紫薇(Lagerstroemia speciosa),属桃金娘目(Myrtales)、千屈菜科(Lythraceae)、紫薇属(Lagerstroemia),原产于中国、印度及澳大利亚,极具观赏价值,是我国南方地区常见的乔木树种[4]。目前对大花紫薇的抗逆性研究较少,对抗盐性研究报道尚无。本试验研究其在盐分胁迫下部分生长和生理生化指标的变化规律,探索其抗盐能力及其机理,为其栽培管理和改良土壤盐渍化提供科学指导。
1 材料与方法
1.1 试验材料及培养
试验于2013年6月25日在广西大学林学院苗圃教学实习基地内进行,统一采用当年生、长势基本一致的大花紫薇播种苗植株作为试验材料。先将腐殖质土与苗圃熟土按照比例(3 ∶1)充分混合搅拌均匀,杀菌消毒烘干至恒质量,然后装入塑料花盆中(口径28 cm、底径25 cm、盆高32 cm),每盆装8 kg烘干土壤,土壤pH 值为5.21±0.34,有机质、全氮、速效磷、速效钾质量分数分别为(10.23±0.78)、(0.68±0.04)、(14.20±0.82)、(5.68±0.75)g·kg-1。然后将苗植株移入盆内,每盆1 株。对盆栽苗进行定期浇水、松土、除害等正常管理。
1.2 盐胁迫处理
缓苗后,于2013年8月1日开始进行盐分胁迫处理,设置6 个NaCl 盐分胁迫梯度:CK(不含NaCl)、0.2%、0.4%、0.6%、0.8%、1.0%,具体配制方法见表1。采用完全随机试验设计,每个处理10个重复,每盆为1 个重复。每个处理用土8 kg,其NaCl 质量分数为0.09%。计算出各处理需要加入的NaCl 质量,为缓解NaCl 的冲击效应,分4 次等量加入,每隔3 d 浇灌1 次,9 d 后达到胁迫质量分数,具体胁迫处理见表1。试验于温室内进行,以避免幼苗淋雨。每天称质量补充当天失去的水分,使各处理土壤含盐量恒定。盆底置有托盘,浇水时,用水冲洗塑料托盘倒入盆中保持盆内盐分含量的恒定。

表1 试验用土壤盐分梯度配置
1.3 指标测定
1.3.1 生理指标
在处理达到设计质量分数后当天、第10 天、第20天、第30 天,取健康功能叶片测定超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、脯氨酸(PRO)质量分数、叶绿素质量分数、丙二醛(MDA)摩尔质量分数以及电导率[5]。
1.3.2 生长指标
在处理达到设计质量分数后第30 天,测量苗高和地径相对增量、根长、根平均直径、地上和地下部分生物量、根茎比。生物量测定采用烘干法[6],总根平均直径、根总长度用Epson 根系扫描仪及配套WinRHIZO 分析软件测定。
相对增量=((苗木生长指标最终值-初始值)/初始值)×100%。
1.4 数据处理及分析
利用Microsoft Excel、SPSS、DPS 进行试验数据的统计处理和方差分析,多重比较采用LSD 方法。
2 结果与分析
2.1 盐胁迫对大花紫薇幼苗生长的影响
由表2可知,随胁迫质量分数增大,各生长指标均呈先升后降的趋势,苗高和地径相对增量、根平均直径、地上和地下部分生物量等指标均在0.4%NaCl 胁迫下达到最大值,根长在0.2%NaCl 胁迫下达到最大值,根茎比则随着胁迫质量分数的增大而逐渐上升。0.2%至0.4%的NaCl 胁迫促进幼苗生长,与对照差异显著(P<0.05),0.6%至1.0%的胁迫则严重抑制植株生长,生长指标迅速下降,与对照差异显著(P<0.05)。

表2 NaCl 胁迫对大花紫薇幼苗生长的影响
2.2 盐胁迫对大花紫薇幼苗叶片中保护酶活性影响
2.2.1 对SOD 活性的影响
由表3可知,无胁迫状态下,30 d 内幼苗叶片的SOD 活性保持稳定,平均为142.2 U·g-1·h-1。随着胁迫质量分数的增加,SOD 活性呈现先增后降的趋势。胁迫当天,各处理间SOD 活性差异不显著。胁迫10 d 时,0.2%至0.8%处理的SOD 活性分别比CK 增高7.03%、11.59%、25.59%和18.16%,1.0%处理比CK 下降5.92%。胁迫20 d 时,各处理相对10 d 前SOD 活性均有不同程度的下降。随胁迫时间延长,各处理SOD 活性继续下降,第30 天与第10天相比差异显著(P<0.05),NaCl 质量分数越大,下降越显著,0.8%和1.0%胁迫下SOD 活性分别下降48.82%和39.24%。
2.2.2 对POD 活性的影响
无胁迫状态下,30 d 内幼苗叶片的POD 活性保持稳定,平均为5.15 mmol·min-1·g-1。随时间的延长,各胁迫处理叶片的POD 活性呈现先升后降的趋势,均在第10 天时达到峰值,0.2%、0.4%、0.6%、0.8%和1.0%胁迫处理分别比CK 提高28.52%、33.13%、32.50%、42.57%和5.37%。随着胁迫时间延长,各处理POD 活性迅速下降,第30 天时,0.2%、0.4%、0.6%、0.8%和1.0%胁迫下的POD 活性分别为3.78、3.03、1.88、2.12、1.74 mmol·min-1·g-1,相比CK 下降比例为26.17%、39.52%、63.35%、58.67%、66.08%(表3)。

表3 NaCl 胁迫对大花紫薇幼苗叶片中保护酶活性影响
2.2.3 对CAT 活性的影响
随胁迫时间延长,0.2%、0.4%和0.6%处理下CAT 活性普遍呈现逐渐增大的趋势,0.8%处理下呈现先增后减的趋势,1.0%处理下呈现出逐渐减小的趋势。胁迫10 d 时,0.8%胁迫下CAT 活性最大,为193.80 U·g-1·min-1,比对照提升51.56%。胁迫20 d 时,0.6%胁迫下CAT 活性最大,为216.39 U·g-1·min-1,比对照提升88.64%。胁迫30 d 时,0.4%胁迫下CAT 活性最大,为254.35 U·g-1·min-1,比对照提升146.48%(表3)。
2.3 盐胁迫对大花紫薇幼苗叶片中MDA 摩尔质量分数的影响
处理当天至30 d 内,CK 的幼苗叶片MDA 摩尔质量分数在0.96 μmol·g-1左右,随着胁迫时间延长,0.2%和0.4%胁迫处理MDA 摩尔质量分数缓慢上升,差异不显著(P>0.05),0.6%、0.8%和1.0%胁迫处理MDA 摩尔质量分数迅速上升,差异显著(P<0.05)。第30 天时,0.6%、0.8%和1.0%胁迫处理的MDA 摩尔质量分数分别相对CK 提升了121.59%、170.11%和191.32%(表4)。
2.4 盐胁迫对大花紫薇幼苗叶片中脯氨酸质量分数的影响
处理当天至30 d 内,CK 的叶片脯氨酸质量分数变化不大,基本保持在0.74 mg·g-1。随胁迫时间延长,0.2%、0.4%和0.6%处理下脯氨酸质量分数呈升高趋势,在第30 天达到最大值,分别为1.09、1.08、1.45 mg·g-1;0.8%和1.0%处理下脯氨酸质量分数呈现先升后降趋势,分别在胁迫后第20 天和第10 天达到最大值,分别为1.71、1.48 mg·g-1(表5)。

表4 NaCl 胁迫对大花紫薇幼苗叶片中MDA 摩尔质量分数的影响
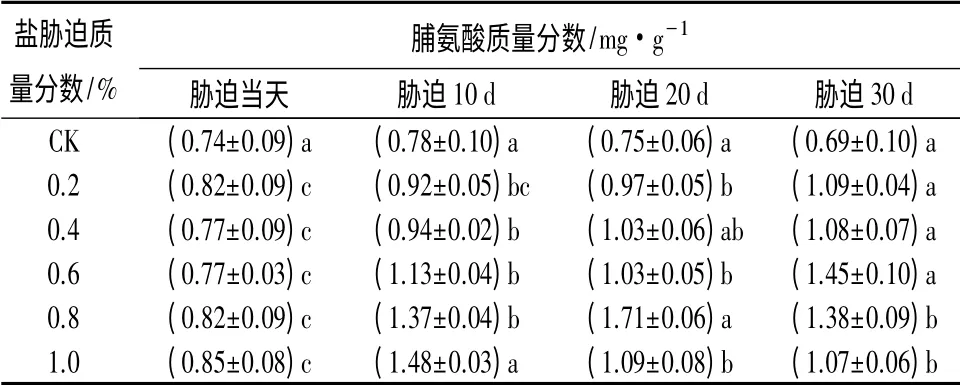
表5 NaCl 胁迫对大花紫薇幼苗叶片中脯氨酸质量分数的影响
2.5 盐胁迫对大花紫薇幼苗叶片细胞膜透性的影响
处理当天至30 d 内,CK 的叶片细胞膜透性差异不大,均值为7.68%。随着时间的延长,各胁迫处理下叶片电导率普遍呈现升高趋势,均在第30 天达到最大值,分别为15.80%、19.79%g、21.45%、24.08%和27.59%(表6)。

表6 NaCl 胁迫对大花紫薇幼苗叶片电导率的影响 %
2.6 盐胁迫对大花紫薇幼苗叶片叶绿素质量分数的影响
CK、0.2%、0.4%、0.6%、0.8%、1.0%盐分胁迫处理第20 天,大花紫薇幼苗叶片叶绿素质量分数分别为(0.49±0.35)、(0.53±0.54)、(0.60±0.09)、(0.55±0.03)、(0.47±0.09)、(0.44±0.08)mg·g-1。可见,随着盐胁迫质量分数的增加,大花紫薇幼苗叶片叶绿素质量分数呈现先升后降的趋势。0.4%处理的叶绿素质量分数最大,比对照提高22.45%,而后随着胁迫质量分数的增加,叶绿素质量分数下降,1.0%胁迫下叶绿素质量分数降到最低值,比对照值下降了10.61%。
3 结论与讨论
盐分胁迫通过对植物地下根系和地上部分组织产生作用,影响植物的生长发育和生理活动[7]。研究中常用植物在盐胁迫下的生长和生理、生物量等指标以及干物质在植物体内的分配规律来表示植物对盐胁迫的耐性和适应能力,其中,生物量指标对盐胁迫的反应最为直接[8]。本试验中,随着NaCl 质量分数的升高,地上和地下生长指标、生物量均出现先升后降的趋势,NaCl 质量分数在0.2%至0.4%之间的处理对大花紫薇幼苗的生长有一定的促进作用,但质量分数超过0.6%以上的处理明显抑制生长,而陈彦[9]的研究表明大于0.1% NaCl 的胁迫会对紫薇的生长产生抑制,这可能是不同植物的耐受性差异所致。根冠比随着胁迫质量分数的增大而呈现上升趋势,说明在不良生长环境下植物体自主调节生物量的分配,使根系获得较多的物质补充,进而提高根系吸收养分的能力,这体现了植物利用生物量最优化分配来抵御逆境[10]。
相对电导率反映叶片电解质的外渗情况,这在一定程度上可以反映植物细胞膜透性的变化[11]。过度胁迫会破坏植株细胞内自由基的产生与消除机制,致使植物体内的自由基大量积累,导致膜脂发生过氧化,伤害细胞膜系统[12]。本试验中,胁迫初期(第10 天)保护酶系统SOD、POD、CAT 等被激活,活性氧清除系统正在发挥保护作用,胁迫后期(第30 天)3 种酶活性均显著下降(P<0.05)。说明在大花紫薇可以忍受范围之内的低盐分胁迫下,保护酶的协同作用使MDA 摩尔质量分数维持在较低水平,随胁迫质量分数的提高和胁迫时间的延长,保护酶结构受到破坏,保护功能下降,导致MDA 大量生成[13]。
研究表明,盐胁迫激活植物体内脯氨酸等含氮化合物的生物合成,并通过维持渗透调节,稳定蛋白质,增强植物对逆境的适应能力[14]。也有研究人员用脯氨酸积累量来表征胁迫伤害程度[15]。试验中后期(20 d、30 d),脯氨酸质量分数随着胁迫的加重呈现先升后降的趋势。这是一种逆境适应机制,过高的胁迫质量分数使得大花紫薇产生了耐受性,导致脯氨酸质量分数降低[16]。
有研究表明盐胁迫破坏叶绿体结构,使叶绿素含量下降[17]。本试验中,在胁迫质量分数为0.8%和0.4%时,脯氨酸和总叶绿素质量分数分别达到最大值,而在0.4%至0.8%之间,脯氨酸质量分数上升而叶绿素质量分数下降,这与董晓霞的理论相异,有可能是不同树种的耐盐性不同所致,同时也说明了抗盐机理的复杂性[18-19]。
综上所述,轻度盐胁迫下(质量分数0.4%以下)的大花紫薇幼苗通过降低体内活性氧自由基的毒害、优化自身器官生物量分配来应对逆境,缓解伤害,但是这种缓解作用有一定限度,超出耐性范围之外的胁迫会对大花紫薇幼苗产生严重的伤害。
[1] 岳中辉,金建丽,孙国荣.不同改良方法对盐碱土壤磷素营养的影响[J].植物研究,2004,24(1):49-52.
[2] 李取生,李秀军,李晓军,等.松嫩平原苏打盐碱地治理与利用[J].资源科学,2003,25(1):15-20.
[3] 丁玉华.干旱区盐渍化土壤生物修复途径及模式:以克拉玛依人工减排林区为例[D].南京:南京信息工程大学,2012.
[4] 任翔翔,张启翔,潘会堂,等.大花紫薇开花及花粉特性研究[J].安徽农业科学,2009,37(28):13507-13509.
[5] 陈建勋,王晓峰.植物生理学实验指导[M].2 版.广州:华南理工大学出版社,2006:68-69,89-90.
[6] 黄涛,朱泓,王小敏,等.盆栽滨梅扦插苗对NaCl 胁迫的响应[J].东北林业大学学报,2014,42(9):102-105.
[7] 童辉,孙锦,郭世荣,等.等渗Ca(NO3)2和NaCl 胁迫对黄瓜幼苗根系形态及活力的影响[J].南京农业大学学报,2012,35(3):37-41.
[8] Dehghani H,Dvorak J,Sabaghnia N.Graphic analysis of biomass and seed yield of beard wheat in salt stress condition[J].Annals of Biological Research,2012,3(9):4246-4253.
[9] 陈彦.小盐芥总DNA 导入紫薇的研究[D].南京:南京林业大学,2006.
[10] Giri B,Kapoor R,Mukerji K G.Influence of arbuscular mycorrhizal fungi and salinity on growth,biomass,and mineral nutrition of Acacia auriculiformis[J].Biology & Fertility of Soils,2003,38(3):170-175.
[11] 代容春,林荣华,何文锦,等.NaCl 胁迫对萝卜幼苗叶片生理特征及根尖细胞核形态的影响[J].植物资源与环境学报,2012,21(3):63-68.
[12] 孙国荣,关旸,阎秀峰.盐胁迫对星星草幼苗保护酶系统的影响[J].草地学报,2001,9(1):34-38.
[13] 周兴元,曹福亮.土壤盐分胁迫对三种暖季型草坪草保护酶活性及脂质过氧化作用的影响[J].林业科学研究,2005,18(3):336-341.
[14] Ghoulam C,Fares K,Ahmed F.Effects of salt stress on growth,inorganic ions and proline accumulation in relation to osmotic adjustment in five sugar beet cultivars[J].Environmentals&sexperimental Botany,2002,47(1):39-50.
[15] Lutts S,Majerus V,Kinet J M.Nacl effects on proline metabolism in rice (Oryza sativa)seedlings[J].Physiologia Plantarum,2002,105(3):450-458.
[16] 陆海燕,刘志辉,吕光辉.镉污染下芦苇叶片丙二醛、脯氨酸及SOD 保护酶反应研究[J].干旱区资源与环境,2013,27(8):171-175.
[17] 汪贵斌,曹福亮.盐分和水分胁迫对落羽杉幼苗的生长量及营养元素含量的影响[J].林业科学,2004,40(6):56-62.
[18] 董晓霞,赵树慧,孔令安.苇状羊茅盐胁迫下生理效应的研究[J].草业科学,1998,15(5):10-13.
[19] 马建华,郑海雷,赵中秋,等.植物抗盐机理研究进展[J].生命科学研究,2001,5(3):175-179,226.

