上皮细胞转分化与IgA肾病临床病理的相关性分析
张 均,袁发焕,甘 华△
(1.重庆医科大学附属第一医院肾内科 400016;2.第三军医大学新桥医院肾内科,重庆400037)
肾病是一组具有相同肾小球免疫病理特征的临床症候群,即肾组织活检肾小球系膜区以IgA或IgA沉积为主要特征,也是引起终末期肾病的常见原因。患者血压、发病时血肌酐水平和尿蛋白定量作为判断IgA肾病预后的临床指标已得到公认[1]。近年随着对上皮细胞转分化(epithelial-mesenchymal transition,EMT)研究的逐渐深入,其在IgA肾病的发展过程中的作用越来越受到关注。有研究指出血管生成是影响IgA肾病预后的独立危险因素。本研究分析了168例IgA肾病患者肾组织转录因子(Snail)和平滑肌肌动蛋白-a(a-SMA)表达水平与常见临床指标的相关性,以期为IgA肾病患者临床病情进展寻找可靠的病理指标。
1 资料与方法
1.1 一般资料 选择2011年1月至2013年12月在新桥医院肾内科经肾活检诊断的原发性IgA肾病患者168例。其诊断标准依据1995年WHO制定的原发性肾小球疾病病理诊断分类标准,并排除过敏性紫癜、乙型肝炎病毒感染、系统性红斑狼疮、肝硬化、肿瘤等疾病引起的继发性IgA肾病;急性肾小管间质病变、动脉病变及坏死病变。根据免疫组织化学染色分为Snail、a-SMA 高表达组(A 组,117例),Snail、a-SMA 低表达组(B组,51例),并对两组患者年龄、性别、病程、体质量指数(BMI)、生化指标(肌酐、尿素氮、三酰甘油、24h尿蛋白定量、总胆固醇、血清清蛋白、血清总蛋白、血糖)及病理情况(Lee氏分级)进行统计学分析。
1.2 方法
1.2.1 病理组织取样 采用Tru Cut活检针在B超引导下经皮快速肾穿刺,每例标本在显微镜下随机选择10个高倍镜视野,均行光镜及免疫荧光检查,病理科医生专人负责阅片并遵循盲法。
1.2.2 主要试剂 免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司;Snail兔抗人多克隆抗体(1∶200)及a-SMA兔抗人多克隆抗体(稀释浓度1∶100)购自美国Abcam公司;羊抗兔IgG二抗(稀释浓度1∶200)购自美国Rockland公司;
1.2.3 组织病理分级 按照Lee氏分级标准分级。Ⅰ级:肾小管间质基本正常,肾小管表现为轻度变形扩张;Ⅱ级:肾小管萎缩程度、间质纤维化的范围小于20%,可见散在炎性细胞的浸润;Ⅲ级:肾小管萎缩程度、间质纤维化的范围为30%~40%,散在和(或)弥漫性炎性细胞浸润;Ⅳ级:肾小管萎缩程度、间质纤维化的范围大于50%,散在和(或)弥漫炎性细胞浸润[2]。
1.2.4 免疫组织化学 采用二步法检测肾脏组织Snail、a-SMA的表达,取肾脏组织石蜡切片进行梯度脱蜡水化后,抗原采用微波修复、山羊血清室温封闭20min,依次加入兔抗Snail(1∶200),兔抗a-SMA多克隆抗体(1∶100)4℃孵育过夜,次日加入相应二抗37℃孵育30min,用链霉亲和素-生物素复合物(SABC)法37℃水浴箱孵育20min,随后加入二氨基联苯胺(DAB)避光显色1~5min,经苏木素复染胞核、乙醇梯度脱水、二甲苯透明,最后中性树胶封片。同时以PBS代替一抗作为阴性对照。光学显微镜观察、拍照计数,细胞胞质内呈棕褐色或棕黄色染色者为Snail、a-SMA阳性,不着色者为阴性。免疫组织化学染色结果判断标准为,低表达:无着色或局灶节段弱阳性;高表达:局灶阶段强阳性或弥漫性强阳性。
1.3 统计学处理 所有数据采用SPSS13.0统计软件分析,其中计量资料采用±s表示,两组间比较采用t检验和方差分析,计数资料用百分数表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料的比较 由表1可见,A组和B组在年龄和性别构成比方面差异无统计学意义。A组病程、BMI比例与B组差异均有统计学意义(P<0.05)。
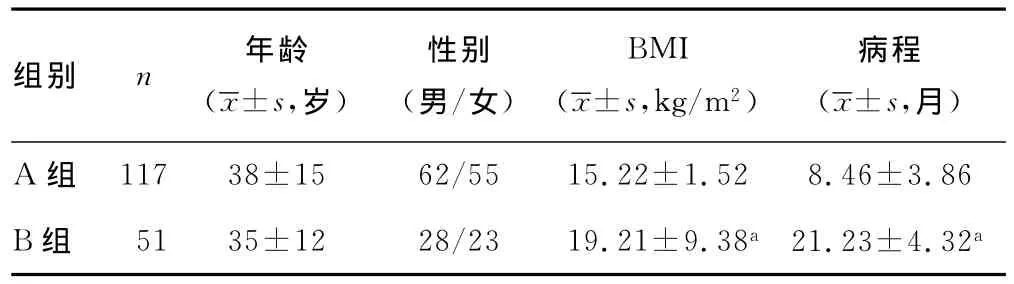
表1 两组IgA肾病患者一般资料的比较
2.2 两组间其他临床指标的比较 A组肌酐、尿素氮、三酰甘油、24h尿蛋白定量与B组差异均有统计学意义(P<0.05),而总胆固醇、血清清蛋白、血清总蛋白、血糖等指标与B组差异均无统计学意义(P>0.05),见表2。
表2 168例IgA肾病患者生化指标的比较(±s)

表2 168例IgA肾病患者生化指标的比较(±s)
a:P<0.05,与B组比较。
项目 A组(n=117) B组(n=51)72.32±38.21尿素氮(mmol/L) 9.23±4.33a 4.52±2.21三酰甘油(mmol/L) 2.36±1.10a 1.22±0.92总胆固醇(mmol/L) 5.41±1.10 5.29±1.12血清总蛋白(g/L) 55.68±11.68 58.26±10.21血清清蛋白(g/L) 34.21±6.21 37.21±6.78血糖(mmol/L) 4.92±0.71 4.96±0.60 24h尿蛋白定量(mg/24h)3 207.56±607.32a肌酐(μmol/L) 162.78±120.23a 1 535.12±519.25
2.3 Lee氏分级与Snail、a-SMA表达的关系 168例IgA肾病患者中Lee氏分级以Ⅲ级最多,占51.8%,其中A组Ⅲ级有59例(50.4%),B组Ⅲ级有28例(54.9%);B组病理分级多为Ⅰ、Ⅱ、Ⅲ级,共有41例,其中Ⅰ+Ⅱ级占25.5%,Ⅳ+Ⅴ级占19.6%,而A组病理分级多在Ⅳ、Ⅴ级,共有47例,病理分级Ⅳ和Ⅴ级IgA肾病患者Snail、a-SMA高表达的比例明显高于Ⅰ、Ⅱ级(40.2%vs.9.4%),两组间比较差异有统计学意义(P<0.05)。Lee氏分级及Snail、a-SMA免疫组织化学表达见图1。
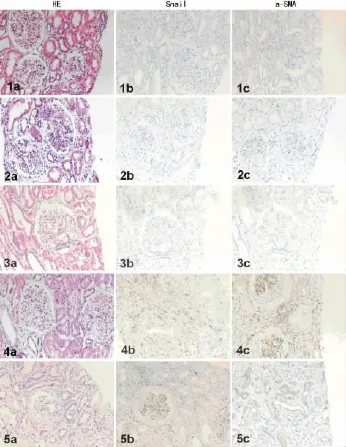
图1 两组IgA肾病患者Lee氏分级及Snail、a-SMA免疫组织化学表达比较(×200)
3 讨 论
IgA肾病是我国常见的原发性肾小球疾病之一,也是引起终末期肾病的主要原因之一,近些年发病率呈明显上升趋势[3]。EMT是指成熟的上皮细胞失去其上皮样表型,并获得未成熟的间充质表型的过程。发育生物学研究表明,哺乳动物的多种脏器在形成过程中都存在EMT的改变过程[4-5]。本研究发现,IgA肾病患者Snail、a-SMA的表达存在明显异常,提示EMT与IgA肾病的病理类型密切相关。Strutz首先提出成年动物的肾小管上皮细胞能转变成间充质样的成纤维细胞,由此推测成年动物的肾脏也存在EMT的过程,之后也被称为EMT[6]。EMT过程的本质上是细胞重塑的一种,EMT中细胞的标记蛋白、表型及功能上都将发生改变,例如丧失上皮细胞的表面标志、上皮钙黏附素(E-caherin)、桥黏斑蛋白及β-钙环黏素等;获得间充质细胞标志:成纤维细胞特异性蛋白-1、波形蛋白、平滑肌肌动蛋白等[6]。在肾脏,上皮系固有细胞包括肾小球脏层上皮细胞、肾小球壁层上皮细胞、肾小管上皮细胞。这3种上皮系细胞均可以发生EMT。随着对肾小管上皮细胞在慢性肾脏疾病发生进展作用认识的不断深入,目前已发现肾小管上皮细胞发生上皮细胞转分化对肾脏纤维化至关重要。而肾小管上皮细胞发生EMT后可能存在如下结局:如果是短暂的损伤性刺激,细胞可恢复为正常肾小管上皮细胞;细胞增生并转化为成纤维样细胞;细胞发生凋亡;如果受到再生性信号刺激,细胞即可再分化为崭新的上皮样细胞[7]。研究表明,肌成纤维细胞是间充质的主要组成细胞之一,而a-SMA是肌成纤维细胞表型的标志蛋白[8]。慢性肾小球疾病的发展中,肾间质内表达a-SMA的肌成纤维细胞明显增多,肌成纤维细胞是肾间质纤维化中细胞外基质的主要来源,因此其数量是判断预后的重要指标。在对由单侧输尿管阻塞引起的阻塞性肾病时发现,在早期阶段(1~3d),a-SMA表达呈升高趋势,并且a-SMA阳性的细胞主要位于肾脏间质,同时发现,a-SMA的高表达并不同时伴随有上皮细胞表型的转化;在7d后,肾小管上皮细胞大量高表达a-SMA,并伴随E-cadherin表达的减少。而在14d后,E-cadherin表达明显降低,肾小管上皮细胞转化为高表达a-SMA的成纤维样细胞。Bai等[9]研究发现,在5/6肾切除大鼠,a-SMA阳性细胞数目与肾小管间质纤维化严重程度之间存在显著正相关。研究表明,Snail作为一个重要的转录抑制子,其对EMT的调控作用已被证实,Snail被激活后转移到细胞核,对许多靶基因起作用,其中最重要的是下调上皮细胞标记物E-cadherin[10]。Snail进入胞核后能与E-cadherin启动子中特异性的DNA序列5′-CAC CTG-3′(又称E-box元件)结合,抑制E-cadherin的转录,使其蛋白表达减少,上皮细胞间的黏附性丧失,从而触发EMT[11]。本研究结果表明,Snail、a-SMA在IgA肾病患者肾组织中的高表达与肾脏病理Lee氏分级密切相关,提示EMT参与IgA肾病的发生、发展。有文献表明,EMT的调节因素包括生长因子、细胞因子、激素及细胞外信号。其中最为熟知的当属转化生长因子-β1(TGF-β1),它在多种慢性肾脏疾病模型中的表达增强,而肾小管上皮细胞TGF-β1受体表达同时上调。除此之外还包括,表皮生长因子与成纤维生长因子-2能协同增强TGF-β1引起EMT的能力;基质金属蛋白酶(MMP-2)也可通过激活TGF-β1而引起EMT[12]。因此,TGF-β1直接需与转化生长因子-β受体 TGF-βRⅡ结合成复合物,发生二聚化,随后便与转化生长因子-β受体TGF-βRⅠ再形成四聚体,此时的构象发生了改变。在TGF-β1诱导上皮样细胞发生EMT信号传导主要是通过Smad分子依赖信号传导途径而起作用的。众所周知,Smad蛋白是TGF-β1下游细胞内信号的重要转导蛋白,也是TGF-β1超家族胞内信号通路中经典的信号分子。Smad受体是通过激活锚定蛋白调节Smad2和/或Smad3复合物形成;激活的Ⅰ型受体使Smad2和/或Smad3蛋白发生丝氨酸残基磷酸化,随后与Smad4蛋白结合后即可转运到细胞核,在核内调控TGF-β1反应基因的转录。因此,TGF-β1引起的EMT主要是依赖Smad信号通路的。
综上所述,本课题选用公认和具有良好重复性的Lee氏分级作为评价标准,发现Snail、a-SMA在IgA肾病患者肾组织中的表达与肾脏病理lee氏分级密切相关,Snail、a-SMA高表达组患者中lee氏分级Ⅰ+Ⅱ级占9.4%、Ⅲ级占50.4%、Ⅳ+Ⅴ级占40.2%,而Snail、a-SMA低表达组患者中lee氏分级Ⅰ+Ⅱ级占25.5%、Ⅲ级占54.9%、Ⅳ+Ⅴ级占19.6%,提示Snail、a-SMA的高表达可作为IgA肾病预后不良的重要因素。但究竟是何种因素导致肾组织Snail、a-SMA的高表达,目前尚不清楚。在IgA肾病的发生发展中,Snail、a-SMA的表达次序及刺激因素,值得进一步深入探讨。
[1] Ochi A,Moriyama T,Takei T,et al.Comparison between steroid pulse therapy alone and in combination with tonsillectomy for IgA nephropathy[J].Int Urol Nephrol,2013,45(2):469-476.
[2] Jabur WL.Necrotic crescentic glomerulonephritis and IGA nephropathy:Lee-Haas classification revisited[J].Saudi J Kidney Dis Transpl,2011,22(4):784-787.
[3] Hogan J,Mohan P,Appel GB.Diagnostic tests and treatment options in glomerular disease:2014update[J].Am J Kidney Dis,2014,63(4):656-666.
[4] Du R,Zhao L,Xia L,et al.Association of URG11and Twist with clinical pathological characteristics and prognosis in patients with IgA nephropathy[J].Nephrol Dial Transplant,2013,28(9):2268-2276.
[5] Benali SL,Lees GE,Nabity MB,et al.De novo expression of human leukocyte antigen-DR (HLA-DR)and loss of beta-catenin expression in tubular epithelial cells:apossible event in epithelial-mesenchymal transition in canine renal diseases[J].Vet J,2013,198(1):229-234.
[6] Burns WC,Thomas MC.The molecular mediators of type 2epithelial to mesenchymal transition(EMT)and their role in renal pathophysiology[J].Expert Rev Mol Med,2010,12:e17.
[7] Quaggin SE,Kapus A.Scar wars:mapping the fate of epithelial-mesenchymal-myofibroblast transition[J].Kidney Int,2011,80(1):41-50.
[8] Han WQ,Zhu Q,Hu J,et al.Hypoxia-inducible factor prolyl-hydroxylase-2mediates transforming growth factor beta 1-induced epithelial-mesenchymal transition in renal tubular cells[J].Biochim Biophys Acta,2013,1833(6):1454-1462.
[9] Bai S,Zeng R,Zhou Q,et al.Cdc42-interacting protein-4 promotes TGF-Β1-induced epithelial-mesenchymal transition and extracellular matrix deposition in renal proximal tubular epithelial cells[J].Int J Biol Sci,2012,8(6):859-869.
[10] Carew RM,Wang B,Kantharidis P.The role of EMT in renal fibrosis[J].Cell Tissue Res,2012,347(1):103-116.
[11] Itoh Y,Moriyama Y,Hasegawa T,et al.Scratch regulates neuronal migration onset via an epithelial-mesenchymal transition-like mechanism[J].Nat Neurosci,2013,16(4):416-425.
[12] Cheng S,Lovett DH.Gelatinase A (MMP-2)is necessary and sufficient for renal tubular cell epithelial-mesenchymal transformation[J].Am J Pathol,2003,162(6):1937-1949.

