一株NSP2蛋白连续缺失48个氨基酸的高致病性猪繁殖与呼吸综合征病毒株的分离及其主要生物学特征的研究
白 云,刘益民,陈家锃,张洪亮,张秋月,王 倩,张武超,叶 超,彭金美,安同庆,童光志,田志军*
(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150001;2.中国农业科学院 上海兽医研究所,上海 200241)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由PRRS 病毒(PRRSV)引起的,能够感染处于不同生长期的猪,主要导致妊娠母猪后期流产、仔猪或保育猪呼吸困难,易继发细菌感染或与其它病毒共同感染,造成猪消瘦甚至死亡。该病在世界范围内广泛流行,是威胁生猪养殖业的重大传染病之一。该病毒可分为两个基因型即欧洲型和美洲型,分别以LV 和VR2332 株为代表[1-2],我国以美洲型PRRSV 的流行为主[3-5]。PRRSV具有变异较快的特征,其Nsp2 基因是高度可变的,主要体现在氨基酸的插入和缺失,这也成为区分不同病毒株的重要标志。尤其是2006 年我国发生了高致病性PRRS(HP-PRRS),经鉴定其病原HP-PRRSV的代表株与CH-1a 的同源性仅为95 %,与VR2332株的同源性为89 %,其显著特征为在其NSP2 区存在30 个氨基酸的不连续缺失[6-7]。
本研究中,我们从某疑似PRRS 发病的仔猪体内分离到一株PRRSV,该分离株 为HP-PRRSV,其NSP2 区在1 aa+29 aa 缺失的基础上,突变为49 aa+29 aa 的缺失株,将其命名为Henan-A14。本研究对该分离株的分子及生物学特性进行了分析,并利用反向遗传技术着重研究了其NSP2 区48 aa 缺失对病毒复制的影响。
1 材料和方法
1.1 主要实验材料及临床样品 HP-PRRSV 疫苗株HuN4-F112 及免疫HP-PRRSV 活疫 苗(HuN4-F112 株)仔猪制备的具有中和活性的血清由本实验室制备并保存;PRRSV HuN4-F112 株的感染性克隆质粒由张善瑞博士惠赠;抗PRRSV M 蛋白单克隆抗体(MAb)由本实验室制备;FITC 标记羊抗鼠IgG(IgG-FITC)购自北京中杉金桥生物技术有限公司。病料样品来自于河南某规模化猪场,该猪场有部分仔猪疑似PRRS 发病。
1.2 病毒的分离鉴定及测序 病料样品研磨后以PBS 稀释,过滤除菌,取上清液接种于肺泡巨噬细胞(PAM)中,培养48 h,取上清液接种下一代PAM细胞中,盲传5 代。提取最后一代接毒的PAM 细胞的总RNA,反转录制备cDNA,利用9 对引物对病毒全基因组分段PCR 扩增(如读者需要相关引物信息,作者可以提供)。将这些基因片段进行测序、拼接、比对分析。
1.3 NSP2编码区48 aa缺失病毒株的感染性克隆的构建 利用重叠延伸PCR(SOE-PCR)进行靶序列的缺失,具体过程如下:在靶序列缺失区两端设计4 条引物(Primer1-4),下游引物Primer 2 和上游引物Primer 3 存在彼此互补的部分(设计引物时互补的部分不包含目的缺失区),进行两轮PCR 反应,第一次PCR 时扩增出两条片段,以其为模板,以Primer 1 和4 为引物,扩增全长片段。目的基因逐步克隆至感染性克隆pHuN4-F112 中(图1),测序鉴定。
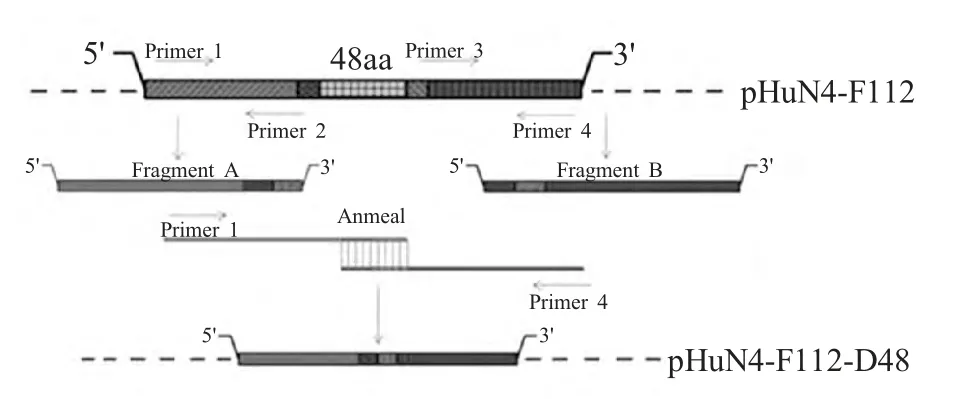
图1 感染性克隆质粒pHuN4-F112-D48 的构建Fig.1 Construction of the infectious clone pHuN4-F112-D48
1.4 缺失病毒的拯救 病毒拯救的步骤按照本实验室建立的方法进行[8]。使用限制性内切酶SwaⅠ将感染性克隆质粒线性化,以其为模板转录为RNA。将纯化后的RNA 转染到BHK-21 中,培养24 h 后,取200 μL 上清液感染MARC-145 细胞,至出现细胞病变(CPE)后,通过间接免疫荧光(IFA)、RT-PCR 和测序的方法鉴定重组病毒。
1.5 缺失病毒特性的鉴定
1.5.1 缺失病毒的IFA 鉴定 在病毒接种后的48 h,以预冷的丙酮将部分接种病毒的细胞固定于8 孔载玻片上,以抗PRRSV M 蛋白MAb 为一抗,羊抗鼠IgG-FITC 为二抗进行IFA 鉴定。
1.5.2 病毒生长曲线测定 将100 TCID50的病毒感染培养于24 cm2的细胞瓶中MARC-145 细胞。感染后以12 h 为起点,每隔12 h 取300 μL 细胞上清液,接种培养于96 孔培养板中的MARC-145 细胞单层中,采用Reed-Muench 法计算病毒的TCID50,依据不同时间点病毒的滴度变化绘制出病毒的生长曲线。
1.5.3 血清交叉中和试验鉴定 采用终点法中和试验,固定病毒稀释血清法检测HP-PRRSV 阳性抗血清对分离株的中和效价[9],同时以疫苗株HuN4-F112 作为对照。
2 结果
2.1 病毒分离鉴定 将病料样品研磨后提取总RNA,反转录制备cDNA,利用针对PRRSV NSP2和GP5 区的特异性引物进行RT-PCR 检测,结果均为阳性。将病料样品接种于PAM 细胞中连续传代5次进行纯化,经IFA 鉴定所分离纯化的病毒为一株PRRSV。
2.2 全基因组测序分析 对分离株的全基因组序列分段扩增测序,拼接为全长15 194 nt 的序列。通过DNAStar 软件分析显示,与经典毒株CH-1a 相比,该分离株在HP-PRRSV NSP2 区1 aa+29 aa 缺失的基础上,进一步缺失为49 aa+29 aa 的缺失株(图2),将其命名为Henan-A14。通过与其它病毒株进行氨基酸比对分析显示,在HP-PRRSV 09HUB2 和YN9株中也存在类似的缺失,但该分离株缺失范围更大(表1)。进化树分析显示,该分离株与HP-PRRSV JXA1、HuN4 等均位于共同的分支,属于HP-PRRSV。但相比较而言,该分离株位于基因进化树最末端,与JXA1 和HuN4 的基因距离均较远,表明其基因组发生了较大的变异(图3)。

图2 不同病毒株间NSP2 蛋白序列比对Fig.2 Amino acid sequence alignment of NSP2 from different PRRSV strains

表1 不同PRRSV 病毒株间NSP2 蛋白缺失的大小与位置Table 1 Deletions in the NSP2 proteins of several PRRSV strains

图3 Henan-A14 与13 株美洲型PRRSV 全基因序列进化树分析Fig.3 Phylogenetic analysis of the whole genome among North American PRRSV
同源性分析表明,分离株与经典代表株VR2332、CH-1a、BJ-4 和SHB 的同源性为87.3 %~92.5 %,与高致病性代表株同源性相对较高,但也仅约为96 %,即使是具有相似缺失位置的09HUB2和YN9 株,同源性也仅为96.3 %和96.7 %,表明其与09HUB2、YN9 的关联性可能不高,3 者可能是独自变异形成的。通过对基因组各个开放阅读框(ORF)比对,其ORF2a 和ORF3 是分离株中变异最大的ORF。
2.3 PRRSV NSP2基因区49 aa+29 aa缺失感染性克隆的构建及病毒拯救 为研究NSP2 区48 aa 缺失的影响,以感染性克隆质粒pHuN4-F112 为骨架,利用SOE-PCR 的方法,将其相应的区域缺失,筛选得到相应位点核酸缺失的重组感染性质粒。经病毒拯救,缺失病毒在MARC-145 中传代,出现明显的CPE;IFA 鉴定,观察到特异性荧光(图4)。RTRCR 扩增病毒的NSP2 区,NSP2 基因测序证明缺失病毒拯救成功,将其命名为rHuN4-F112-D48。

图4 IFA 鉴定结果Fig.4 Identification of the rescued virus with MAb against PRRSV M protein by IFA
2.4 连续48 aa缺失对病毒复制的影响 在MARC-145 细胞单层中分别检测HuN4-F112、Henan-A14 及rHuN4-F112-D48 3 株病毒动态病毒滴度的变化,并绘制其生长曲线,结果显示,Henan-A14 在MARC-145 细胞中生长相对缓慢,明显低于HuN4-F112 的3~4 个滴度,缺失了48 aa 的嵌合病毒rHuN4-F112-D48 的生长曲线与HuN4-F112 无显著差异,表明该区域未影响病毒的复制(图5)。
2.5 Henan-A14株的中和抗原特性及连续48 aa缺失对病毒中和表位的影响 利用疫苗株HuN4-F112免疫仔猪制备的血清对Henan-A14 株进行交叉中和试验检测,检测结果这5 份血清几乎均不能够中和Henan-A14(表2),表明Henan-A14 的中和抗原与疫苗株存在较大的差别。而5 份血清对rHuN4-F112-D48 的中和效价与HuN4-F112 没有显著差异,表明Henan-A14 的NSP2 区48 aa 的缺失同样也不影响病毒的中和表位区。
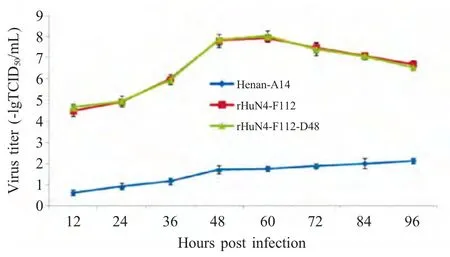
图5 不同病毒株在MARC-145 细胞中的生长曲线Fig.5 Viral growth property of different PRRSVs in MARC-145 cells
表2 5 份血清针对不同毒株的交叉中和效价Table 2 Virus neutralization titers of 5 anti-sera against the PRRSVs
3 讨论
PRRSV 属于RNA 病毒,由于其RNA 酶的保真性较差,所以其基因组较容易发生变异[10]。本研究对新分离的PRRSV Henan-A14 株序列分析表明,虽然其分子特征上仍属于HP-PRRSV,但其基因组与代表株JXA1、HuN4 和TJ 相比发生了大约540 个碱基的置换或突变,导致其与HP-PRRSV 代表株相比同源性仅约为96.5 %。由于PRRSV 经典株CH-1a与HP-PRRSV 之间的同源性仅约为95%,存在3.5%的差异,反映了该分离株可能存在较大的异质性,并导致其生物学特性的改变。
本研究中对分离株细胞嗜性的分析发现其在MARC-145 细胞中的复制能力降低。在病毒分离中我们也发现越来越多的HP-PRRSV 分离株不适宜在MARC-145 细胞中进行分离和增殖,由于PRRSV 活疫苗株的致弱和疫苗的制备过程中,均需要在MARC-145 细胞中进行传代,因此这种现象需要引起足够的重视。此外,实验还显示由疫苗株诱导的中和抗体对分离株交叉中和效价低,表明其中和抗原与HP-PRRSV HuN4 株差别较大。分离株的细胞嗜性和抗原异质性可能是由多基因突变造成的,这也对PRRSV 的研究提出了更多的挑战。
由于分离株的NSP2 区存在更大的连续缺失,而NSP2 与病毒的复制有关[11-13],研究证明NSP2 可以存在于病毒粒子的表面,表明其也是结构蛋白的一部分[14]。为研究该缺失的功能,本研究构建NSP2相应区域的氨基酸缺失的突变体病毒,分析其生长曲线发现,缺失其48 aa 后并未影响病毒的复制,表明该缺失区域是PRRSV 的生长非必需区。
总之,拯救的缺失病毒在MARC-145 细胞中的复制及血清中和试验生长曲线结果表明,NSP2 基因区48 aa 缺失即不影响PRRSV 的复制效率,也不影响病毒对HP-PRRSV 制备的阳性血清中和效率。本研究的结果证明Henan-A14 分离株在MARC-145细胞中复制能力的降低,以及病毒抗原中和表位与NSP2 中相关的氨基酸缺失无直接关系。因此,Henan-A14 分离株这两种重要的生物学特性的变异主要是由其他基因的变异所引起,并需要进一步的研究进行验证。本研究分离到一株基因组发生较大变异的PRRSV,其生物学特性发生了较大改变,尤其是其细胞嗜性的改变需要加强重视,本研究对PRRSV 的变异研究具有一定的价值。
[1]Nelsen C J,Murtaμgh M P,Faaberg K S.Porcine reproductive and respiratory syndrome virus comparison:divergent evolution on two continents[J].J Virol,1999,73(1):270-280.
[2]Hanada K,Suzuki Y,Nakane T,et al.The origin and evolution of porcine reproductive and respiratory syndrome viruses[J].Mol Biol Evol,2005,22(4):1024-1031.
[3]郭宝清,陈章水,刘文兴,等.从疑似PRRS 流产胎儿分离PRRSV 的研究[J].中国预防兽医学报,1996,2:1-5.
[4]仇华吉,童光志.猪繁殖与呼吸道综合征病毒(PRRSV)CH-1a 株基因型鉴定[J].中国兽医学报,1998,18(2):118-121.
[5]杨汉春,黄芳芳,郭鑫,等.猪繁殖与呼吸综合征病毒(PRRSV)BJ-4 株全基因组序列测定与分析[J].农业生物技术学报,2001,9(3):212-218.
[6]童光志,周艳君,郝晓芳,等.高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,29(5):323-326.
[7]Tong Guang-zhi,Zhou Yan-jun,Hao Xiao-fang,et al.Highly pathogenic porcine reproductive and respiratory syndrome,China[J].Emerg Infect Dis,2007,13(9):1434-1436.
[8]Zhang Shan-rui,Zhou Yan-jun,Jiang Yi-feng,et al.Generation of an infectious clone of HuN4-F112,an attenuated live vaccine strain of porcine reproductive and respiratory syndrome virus[J].Virol J,2011,8:410.
[9]孟甄祥,安同庆,陈家锃,等.高致病性PRRS 活疫苗(HuN4-F112 株)抗体对Ⅱ型不同亚群PRRSV 的中和效果[J].中国预防兽医学报,2012,34(5):401-404.
[10]Prieto C,Vázquez A,Núnez J I,et al.Influence of timeon the genetic heterogeneity of Spanish porcine reproductive and respiratory syndrome virus isolates[J].Vet J,2009,180:363-370.
[11]Sun Zhi,Chen Zhen-hai,Lawson S R,et al.The cysteine protease domain of porcine reproductive and respiratory syndrome virus nonstructural protein 2 possesses deubiquitinating and interferon antagonism functions[J].J Virol,2010,84(15):7832-7846.
[12]Chen Zhen-hai,Zhou Xiao-xin,Lunney J K,et al.Immunodominant epitopes in nsp2 of porcine reproductive and respiratory syndrome virus are dispensable for replication,but play an important role in modulation of the host immune response[J].J Gen Virol,2010,91(4):1047-1057.
[13]Snijder E J,Wassenaar A L,Spaan W J,et al.The arterivirus Nsp2 protease.An unusual cysteine protease with primary structure similarities to both papain-like and chymotrypsin-like proteases[J].J Biol Chem,1995,270(28):16671-16676
[14]Kappes M A,Miller C L,Faaberg K S.Highly divergent strains of porcine reproductive and respiratory syndrome virus incorporate multiple isoforms of nonstructural protein 2 into virions[J].J Virol,2013,87(24):13456-13465.

