白芍粗提物及芍药苷对变异链球菌作用的体外实验
陈 昶, 卢友光, 潘在兴, 邵旭媛, 苏柏华, 冯 岩
白芍粗提物及芍药苷对变异链球菌作用的体外实验
陈 昶1, 卢友光2, 潘在兴1, 邵旭媛1, 苏柏华2, 冯 岩2
目的 研究白芍粗提物及其主要成分芍药苷对变异链球菌的作用。方法采用醇提法制取白芍粗提物,通过高效液相色谱法测定白芍粗提物的主要活性成分,分别观察白芍粗提物及其主要成分芍药苷在不同药物浓度下对变异链球菌的粘附、产酸、合成水不溶性胞外多糖以及葡聚糖转移酶(GTF)比活力等方面的影响。结果白芍粗提物及芍药苷对变异链球菌的体外生长最小抑菌浓度(MIC)分别为3.130和1.770 mg/mL,当两者的浓度分别为≥1.565和≥0.885 mg/mL时,有明显的抑制变异链球菌粘附、合成水不溶性胞外多糖和GTF比活力的作用(P<0.05);当白芍粗提物浓度为3.130 mg/mL时,有明显的抑制变异链球菌产酸的作用(P<0.05),而不同浓度的芍药苷对变异链球菌产酸均无影响(P>0.05)。不同浓度白芍粗提物组和芍药苷组的水不溶性胞外多糖含量和GTF比活力之间均呈正向直线相关。结论白芍粗提物可抑制变异链球菌的粘附、产酸、合成水不溶性胞外多糖和GTF活性,其主要活性成分芍药苷可抑制变异链球菌的粘附、合成水不溶性胞外多糖和GTF活性,但不影响变异链球菌的产酸活动。
白芍; 芍药苷; 链球菌属; 链球菌,变异; 多糖类; 转移酶类
龋病是多种因素综合作用导致牙齿硬组织的慢性进行性病损,表现为无机物的脱矿和有机物的分解,是人类的常见病和多发病。世界卫生组织已将龋病、癌症和心血管疾病并列为人类三大重点防治疾病。自从20世纪50年代明确了变异链球菌是人类龋病的主要致病菌以来,诸多学者从抑制或杀灭变异链球菌的药物着手进行了大量研究,其中研究和应用最多的是化学合成药物和植物提取物[1]。白芍为常用中药材,源于毛茛科植物芍药的干燥根[2]。本实验通过观察白芍粗提物及其主要活性成分芍药苷对变异链球菌的粘附、产酸、合成胞外多糖以及抑制细菌酶等方面的影响,探讨其防龋机制,为白芍及其主要活性成分芍药苷成为防龋药物提供实验室依据。
1 材料与方法
1.1 材料 实验菌株:变异链球菌ATCC 25175(福州乐华生物技术有限公司)。试剂:白芍(安徽德昌药业饮片有限公司);芍药苷对照品(批号110736-201337,中国食品药品检定研究院);蒽酮[生工生物工程(上海)股份有限公司];考马斯亮蓝(Biosharp生物技术公司);蛋白浓度测定试剂盒、蔗糖、0.5 mol/L磷酸盐缓冲液、TPY培养基、固体硫酸铵、乙醇(分析纯)、乙腈(色谱纯)、甲醇(色谱纯)、超纯水(福州乐华生物技术有限公司)。仪器:高效液相色谱仪(LC-20AT,日本岛津公司);CO2水套培养箱(HEPACLASS100型,热电公司);超纯水机(5L/H50w型,艾科浦公司);电子分析天平(AL204型,上海梅特勒-托利多仪器有限公司);数显恒温水浴锅(HH-2,江苏金坛市江南仪器厂);旋转蒸发仪(RE-2000B,上海亚荣生化仪器厂);pH计(美国奥立龙868酸度计);酶标仪(LD400,美国贝克曼库尔特公司)。
1.2 方法
1.2.1 白芍粗提物的制备 将白芍药材低温烘干后粉碎,精密称取100 g过50目筛的粉末,置于干燥圆底烧瓶中,加入500 mL 60%乙醇溶液,加热回流提取,滤过,收集滤液。重复提取2次,合并滤液。滤液减压干燥,负压旋转蒸发至浸膏状。
1.2.2 高效液相色谱法测定白芍粗提物的主要活性成分芍药苷
1.2.2.1 色谱条件 色谱柱:Inertsil ODS-SPC18(250 mm×46 mm,5 μm);流动相:乙腈-0.1%磷酸(25∶75);流速:0.8 mL/min;柱温:25 ℃;进样量:10 μL;检测波长:230 nm。
1.2.2.2 标准溶液的制备 取真空干燥至恒定质量的芍药苷对照品适量,用甲醇稀释至1 mL含0.980 mg芍药苷的对照品溶液Ⅰ。精密量取对照品溶液Ⅰ1 mL,分别稀释成浓度为0.490,0.245,0.049,0.019 mg/mL的对照品溶液Ⅱ~Ⅴ,混匀待进样。在1.2.2.1的色谱条件下,测得对照品溶液Ⅰ~Ⅴ的峰面积值。以对照品溶液的浓度为横坐标,以测得的峰面积值为纵坐标,绘制标准曲线,并做回归曲线。
1.2.2.3 白芍粗提物的药物成分分析 取白芍粉末6份,各0.1 g,精密称取,分别加入60%乙醇60 mL,回流提取1 h,滤过,收集滤液。滤渣加入60%乙醇60 mL,加热回流提取1 h,过滤,收集滤液。合并滤液,滤液减压干燥,用95%乙醇定容在50 mL容量瓶,得到样品溶液Ⅰ~Ⅵ。按上述色谱条件进行测定,将测得的峰面积值代入所得标准品的线性方程,得出粗提物样品中含有芍药苷的浓度。
1.2.3 变异链球菌菌液调整 将变异链球菌ATCC 25175接种于TPY液体培养基中,在80% N2、20% CO2和37 ℃的条件下,于厌氧箱中培养24 h,然后以3 500 r/min离心15 min,收集细菌,无菌生理盐水洗菌2次,用无菌生理盐水将菌悬液调在波长630 nm处吸光度(A630 nm)为1.0,备用。
1.2.4 白芍粗提物和芍药苷对变异链球菌黏附作用的影响 取10 mL的玻璃试管24个,每组4个平行管,分别将白芍粗提物和芍药苷以倍比稀释配制成5个浓度的实验组药液和1个为TPY液体培养基(不含药液)的对照组溶液后,分别加入以上备好的菌液0.05 mL、TPY液体培养基2 mL和50%蔗糖-0.5 mol/L磷酸缓冲液0.45 mL,混匀。各试管与地平面呈30°,在80% N2、20% CO2和37 ℃的厌氧箱中培养18 h。然后将试管中溶液轻轻移去,将粘附到试管壁的细菌用蒸馏水洗脱,每次3 mL,共计3次,以3 500 r/min离心15 min,收集细菌,置于3 mL蒸馏水中,混匀。用酶标仪测定A630 nm,计算粘附抑制率。
粘附抑制率=(对照组A630 nm-实验组A630 nm)/对照组A630 nm×100%
1.2.5 白芍粗提物和芍药苷对变异链球菌产酸作用的影响 实验分组同上。采用酸度计将已配制好的药物溶液和对照组溶液调定初始pH值为7.4,按菌液与药液1∶10(v/v)比例接种变异链球菌,在80% N2、20% CO2和37 ℃的厌氧箱中培养18 h,测定上清液的pH值,每管测定3次,结果取平均值,并计算培养前后pH值的变化值(ΔpH)。
ΔpH=初始pH值(7.4)-终末pH值
1.2.6 白芍粗提物和芍药苷对变异链球菌合成胞外多糖的影响 实验分组同上。按菌液与TPY液体培养基1∶10(v/v)的比例接种变异链球菌,在80% N2、20% CO2和37 ℃的厌氧箱中培养24 h,培养液以6 000 r/min离心25 min,沉淀物用5 mL蒸馏水洗涤、离心2次,水洗后的沉淀物加入0.4 mol/L的NaOH 5 mL洗涤、离心3次,合并上清液作为样品。取适量上清液,以蒽酮法测定水不溶性多糖的含量,每管测定3次,结果取平均值。
1.2.7 白芍粗提物和芍药苷对变异链球菌葡聚糖转移酶(glucan transferase,GTF)的影响 实验分组同上。将已配制好的3 mL各浓度药液按菌液与药液1∶10(v/v)比例接种于已调定A值为1.0的菌液0.3 mL,在80% N2、20% CO2和37 ℃的厌氧箱中培养24 h。将细菌培养物离心,收集上清液,加入固体硫酸铵,达60%饱和度,置于4 ℃冰箱过夜后离心,将沉淀溶于磷酸盐缓冲液中透析48 h,得GTF粗酶。取GTF粗酶0.1 mL,加入蒸馏水4 mL,采用考马斯亮蓝法测定总蛋白含量,采用Somogyi法测定酶-底物反应液中的还原糖量,每管测定3次,结果取平均值。GTF活力单位(IU)定义为标准条件下(37 ℃反应1 h)每分钟从蔗糖释放1 μmol还原糖所需的酶量,并计算酶的比活力。
比活力=酶活力(mIU)/总蛋白量(μg)
2 结 果
2.1 白芍粗提物中的活性成分芍药苷的含量
2.1.1 白芍供试品与芍药苷对照品色谱图 芍药苷对照品和白芍供试品色谱图显示,在1.2.2.1的条件下,芍药苷和其他峰能达到基线分离(图1),对照品芍药苷的出峰时间为9.25 min。根据对照品芍药苷的保留时间判断,样品中保留时间为9.25 min的峰1鉴定为芍药苷。
2.1.2 标准曲线的制备 以对照品溶液的浓度为横坐标,以峰面积值为纵坐标,绘制的标准曲线见图2。回归方程:Y=1E+0.7X+20 800,测得r2为0.999 9,表示线性良好。
2.1.3 白芍中芍药苷含量测定 按照供试品溶液制备方法制备样品,按上述色谱条件测定峰面积,计算含量,结果见表1,可见白芍中芍药苷的含量为2.629%。
2.2 白芍粗提物、芍药苷对变异链球菌粘附作用的影响 不同浓度白芍粗提物、芍药苷对变异链球菌粘附作用的影响见表2。可见随着白芍粗提物浓度的升高,粘附抑制率也随之增高。经ANOVA检验,白芍各药物浓度组粘附的A值总体均数不全相等(F=82.833,P=0.000)。经Dunnett-t检验,当白芍浓度为3.130,1.565 mg/mL时,可以降低变异链球菌的黏附性(P<0.05);当白芍浓度为0.783,0.391,0.196 mg/mL时,随着浓度的升高,粘附抑制率也随之增高(P>0.05)。经ANOVA检验,芍药苷各药物浓度组粘附的A值总体均数不全相等(F=2316.416,P=0.000)。经Dunnett-t检验,当芍药苷浓度为1.770,0.885 mg/mL时,可以降低变异链球菌的粘附性(P<0.05);当芍药苷浓度为0.443,0.221,0.111 mg/mL时,对变异链球菌的粘附性无明显影响(P>0.05)。

A:白芍供试品;B:芍药苷对照品.1:芍药苷色谱峰.图1 白芍供试品及芍药苷对照品色谱图Fig 1 Chromatogram of radix paeoniae alba experimental article and chromatogram of paeoniflorin reference substance

图2 芍药苷标准曲线Fig 2 Paeoniflorin standard curve
2.3 白芍粗提物、芍药苷对变异链球菌产酸作用的影响 不同浓度白芍粗提物、芍药苷对变异链球菌产酸作用的影响见表2,可见随着白芍粗提物浓度的升高,ΔpH越来越小。经ANOVA检验,白芍各药物浓度组ΔpH值总体均数不全相等(F=16.887,P=0.000)。经Dunnett-t检验,当白芍浓度为3.130 mg/mL时,可抑制变异链球菌产酸(P=0.000);当白芍浓度为1.565,0.783,0.391 mg/mL时,对变异链球菌产酸无影响(P>0.05);当白芍浓度为0.196 mg/mL时,可促进变异链球菌产酸(P=0.014)。芍药苷各药物浓度组的ΔpH值经ANOVA检验显示,芍药苷对变异链球菌产酸无影响(F=1.614,P=0.189)。
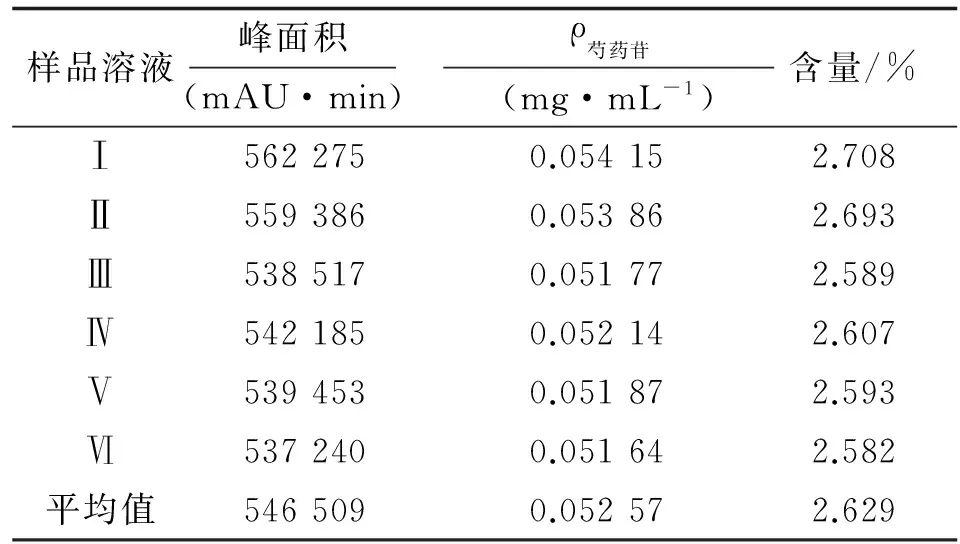
表1 白芍中芍药苷含量Tab 1 The content of paeoniflorin in radix paeoniae alba
n=6.
2.4 白芍粗提物、芍药苷对变异链球菌合成胞外多糖的影响 不同浓度白芍粗提物、芍药苷对变异链球菌合成胞外多糖的影响见表2,可见随着白芍粗提物浓度的升高,水不溶性胞外多糖含量越来越小。经ANOVA检验,白芍各药物浓度组合成胞外多糖含量总体均数不全相等(F=12.272,P=0.000)。经Dunnett-t检验,当白芍浓度为3.130,1.565 mg/mL时,可抑制变异链球菌产生胞外多糖(P<0.05);当白芍浓度为0.783,0.391,0.196 mg/mL时,对变异链球菌产生胞外多糖无影响(P>0.05)。随着芍药苷浓度的升高,水不溶性胞外多糖含量越来越小,经ANOVA检验,芍药苷各药物浓度组合成胞外多糖含量总体均数不全相等(F=132.888,P=0.000),经Dunnett-t检验,当芍药苷浓度为1.770,0.885 mg/mL时,可抑制变异链球菌产生胞外多糖(P=0.000);当芍药苷浓度为0.443,0.221,0.111 mg/mL时,对变异链球菌产生胞外多糖无影响(P>0.05)。
2.5 白芍粗提物、芍药苷对GTF的影响 不同浓度白芍粗提物、芍药苷对GTF的影响见表3,可见随着白芍粗提物浓度的升高,酶比活力越来越小。经ANOVA检验,白芍各药物浓度组对变异链球菌酶比活力值总体均数不全相等(F=9.657,P=0.000)。经Dunnett-t检验,当白芍浓度为3.130,1.565 mg/mL时,变异链球菌酶比活力降低(P<0.05);当白芍浓度为0.783,0.391,0.196 mg/mL时,对变异链球菌酶比活力无影响(P>0.05)。不同浓度白芍粗提物组的胞外多糖含量和酶比活力之间呈正向直线相关(r=0.950,P=0.013)。随着芍药苷浓度的升高,酶比活力越来越小。经ANOVA检验,芍药苷各药物浓度组对变异链球菌酶比活力值总体均数不全相等(F=12.331,P=0.000)。经Dunnett-t检验,当芍药苷浓度为1.770,0.885 mg/mL时,变异链球菌酶比活力降低(P<0.05);当芍药苷浓度为0.443,0.221,0.111 mg/mL时,对变异链球菌酶比活力无影响(P>0.05)。不同浓度芍药苷组的胞外多糖含量和酶比活力之间呈正向直线相关(r=0.990,P=0.001)。
表2 不同浓度白芍粗提物、芍药苷对变异链球菌粘附、产酸、合成胞外多糖的影响
Tab 2 The influence of different concentrations of radix paeoniae alba crude extracts and paeoniflorin on the adhesion ability, acid generation and exopolysaccharide production of streptococcus mutaus
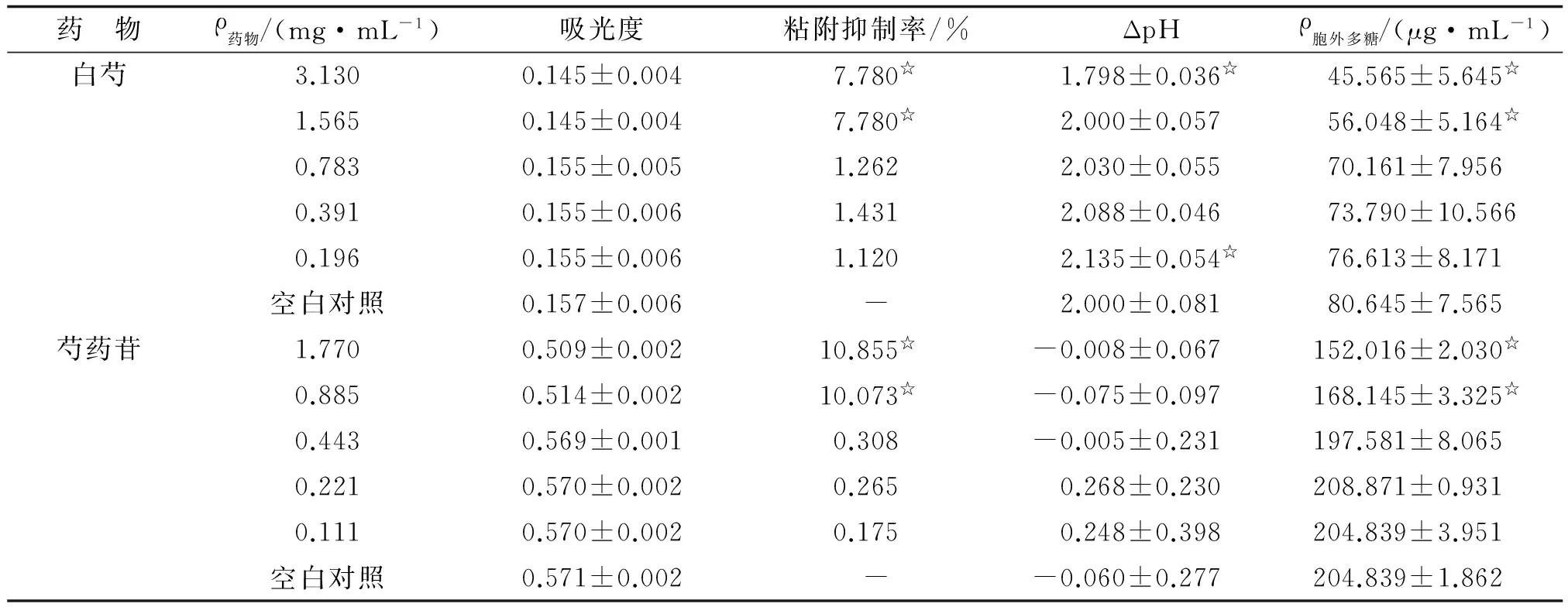
药 物ρ药物/(mg·mL-1)吸光度粘附抑制率/%ΔpHρ胞外多糖/(μg·mL-1)白芍3.1300.145±0.0047.780☆1.798±0.036☆45.565±5.645☆1.5650.145±0.0047.780☆2.000±0.05756.048±5.164☆0.7830.155±0.0051.2622.030±0.05570.161±7.9560.3910.155±0.0061.4312.088±0.04673.790±10.5660.1960.155±0.0061.1202.135±0.054☆76.613±8.171空白对照0.157±0.006-2.000±0.08180.645±7.565芍药苷1.7700.509±0.00210.855☆-0.008±0.067152.016±2.030☆0.8850.514±0.00210.073☆-0.075±0.097168.145±3.325☆0.4430.569±0.0010.308-0.005±0.231197.581±8.0650.2210.570±0.0020.2650.268±0.230208.871±0.9310.1110.570±0.0020.1750.248±0.398204.839±3.951空白对照0.571±0.002--0.060±0.277204.839±1.862
与空白对照组比较,☆:P<0.05.
表3 不同浓度白芍粗提物、芍药苷对变异链球菌葡聚糖转移酶的影响
Tab 3 The influence of different concentrations of radix paeoniae alba crude extracts and paeoniflorin on glucan transferase of streptococcus mutaus

与空白对照组比较,☆:P<0.05.
3 讨 论
现代药理学研究认为,白芍可用于月经不调、盗汗、自汗、四肢痉挛、头痛眩晕等症[2]。白芍化学成分复杂,主要有效成分为芍药苷、芍药内酯苷、氧芍药苷、苯甲酰芍药苷等成分,其主要活性成分芍药苷是一种双环单萜类糖苷化合物,具有镇静、镇痛、抗炎、扩张血管、改善微循环、免疫调节等活性[3-8]。有文献报道,白芍对志贺氏菌、金黄色葡萄球菌等具有较强的抗菌作用[9]。文洪林等认为,白芍对口腔厌氧菌有抑制作用[10]。张倩等的研究表明,芍药苷能明显减少炎症因子的释放,可改善细菌及其有效成分引起的炎症反应[11]。
变异链球菌的致龋因子包括对牙面的粘附、产酸、生成水不溶性胞外多糖和GTF。变异链球菌胞壁中的脂磷壁酸、葡聚糖连接蛋白等表面黏附物质,以黏附素形式选择性与膜表面有机受体结合,定植于牙表面,促使菌斑形成。变异链球菌菌体表面粘附有GTF,能利用口腔内的碳水化合物,特别是蔗糖,合成水不溶性胞外多糖,并介导该菌的蔗糖依赖性粘附。水不溶性胞外多糖具有很强的粘附性和抗水解性,是构成菌斑的基本骨架结构[12]。在菌斑中生存的变异链球菌能迅速发酵多种碳水化合物产生大量的酸,使局部pH下降至5.5以下,避开唾液的缓冲作用,从而造成局部硬组织脱矿,龋病病变过程开始。
本研究通过白芍粗提物及其主要活性成分芍药苷对变异链球菌的粘附、产酸、合成水不溶性胞外多糖以及抑制GTF等方面的影响来研究白芍粗提物及其主要活性成分对变异链球菌是否有抑制作用,从而探讨白芍及其主要活性成分芍药苷作为防龋药物的可能性。研究发现,白芍粗提物可抑制变异链球菌的粘附、产酸、合成水不溶性胞外多糖和GTF活性,其主要活性成分芍药苷可抑制变异链球菌的粘附、合成水不溶性胞外多糖和GTF活性,但不影响变异链球菌的产酸活动。因此,笔者认为,白芍粗提物及其主要活性成分芍药苷可以通过对变异链球菌的致龋因子粘附、产酸、合成水不溶性胞外多糖以及GTF等的抑制作用,达到防龋的目的。
芍药苷抑制变异链球菌粘附能力的可能机制:(1)与变异链球菌细胞表面蛋白发生化学反应,引起表面蛋白化学结构的变化和数量的减少,从而降低变异链球菌细胞表面的疏水性,并导致粘附减少[13];(2)水不溶性胞外多糖具有黏性,在细菌粘附、菌斑形成中起着重要的作用,而芍药苷可抑制GTF的活性和水不溶性胞外多糖的合成,从而影响变异链球菌的粘附作用。白芍化学成分复杂,除主要成分芍药苷外,还含有没食子鞣酸等,可抑制变异链球菌的粘附、产酸、合成水不溶性胞外多糖和GTF活性[5,14]。
综上所述,白芍粗提物可抑制变异链球菌的粘附、产酸、合成水不溶性胞外多糖和GTF活性。芍药苷可抑制变异链球菌的粘附、合成水不溶性胞外多糖和GTF活性,但不影响变异链球菌的产酸活动。白芍及其主要活性成分芍药苷有望开发为一种有效的防龋药物。
[1] 刘开云, 孙红武, 张卫军, 等.变异链球菌防治药物的研究现状[J].国际口腔医学杂志, 2012,39(5):683-685.
[2] 中国药典委员会编著.中国药典[S].北京:中国医药科技出版社, 2010:97.
[3] 王 巧, 刘荣霞, 毕开顺, 等.HPLC法测定白芍总苷胶囊中芍药内酯苷、芍药苷和苯甲酰芍药苷[J].中草药, 2005,36(11):1630-1632.
[4] 周秋香, 李友宾, 蒋建勤, 等.白芍的化学成分研究[J].海峡药学, 2009,21(6):92-94.
[5] 孙丽荣, 曹 雄, 侯凤青, 等.芍药苷研究进展[J].中国中药杂志, 2008,33(18):2028.
[6] 方申存, 戴 伟, 吴 昊, 等.芍药苷对人胃癌SGC7901/VCR细胞增殖抑制作用及其机制研究[J].南京医科大学学报:自然科学版, 2010,30(5):636.
[7] 郑世存, 李晓宇, 欧阳兵, 等.芍药苷药理作用研究新进展[J].中国药物警戒, 2012,9(2):100-103.
[8] 王印国.常见单萜类化合物及其在植物中的分布[J].现代农业科技, 2012,16:186.
[9] 李仲兴, 王秀华, 赵建宏, 等.用M-H琼脂进行五味子、白芍对252株临床菌株的体外抗菌效果观察[J].中医药研究, 2000,16(4):44-46.
[10] 文洪林, 桂 红, 贺 红, 等.丹皮、白芍对牙龈卟啉单胞菌、具核梭杆菌的体外抑菌活性研究[J].临床和实验医学杂志, 2012,11(18):1469-1471.
[11] 张 倩, 周苏明.芍药苷对TLR2介导的炎症反应信号转导途径的影响[D].南京:南京医科大学, 2011:34.
[12] Katsura H, Tsukiyama R I, Suzuki A,etal.Invitroantimicrobial activities of bakuchiol against oral microorganisms [J].AntimicrobialAgentsandChemotherapy, 2001,45(11):3009-3013.
[13] 杨隆强, 周 乔.变异链球菌粘附机制的研究进展[J].国际口腔医学杂志, 2011,38(2):229-233.
[14] 黄正蔚, 周学东, 李继遥, 等.中药五倍子对口腔致龋菌影响的体外实验研究[J].华西药学杂志, 2002,17(2):104-106.
(编辑:何佳凤)
Effect of Radix Paeoniae Alba Crude Extracts and its Main Ingredients on Streptococcus Mutaus(invitroExperimental Study)
CHEN Chang1, LU Youguang2, PAN Zaixing1, SHAO Xuyuan1, SU Bohua2, FENG Yan2
1.Department of Stomatology,Fujian Provincial Government Hospital,Fuzhou 350001, China;2.Department of Preventive Dentistry, The Affiliated Stomatology Hospital of Fujian Medical University, Fuzhou 350002, China
Objective To inverstigate the effect of radix paeoniae alba crude extracts and its main ingredients on streptococcus mutaus. Methods Radix paeoniae alba crude extracts was made by alcohol extraction process. The main active ingredients of radix paeoniae alba crude extracts was determined by high performance liquid chromatography (HPLC). The effect of radix paeoniae alba crude extracts and paeoniflorin,which is the main components of radix paeoniae alba,at the various concentration on adhesion ability, acid generation, insoluble exopolysaccharide production and glucan transferase activity were measured on streptococcus mutaus. Results The minimum inhibition concentration (MIC)of radix paeoniae alba crude extracts and paeoniflorin on streptococcus mutausinvitrowas 3.13 mg/mL and 1.770 mg/mL respectively. The adhesion ability , insoluble exopolysaccharide production and glucan transferase activity of streptococcus mutaus could be inhibited by radix paeoniae alba crude extracts and paeoniflorin at the concentration of greater than and equal to 1.565 mg/mL and 0.885 mg/mL (P<0.05). Acid generation of streptococcus mutaus could be inhibited by radix paeoniae alba crude extracts at the concentration of 3.13 mg/mL (P<0.05). But paeoniflorin at the various concentration had no effect on acid generation of streptococcus mutaus (P>0.05). Insoluble exopolysaccharide production and glucan transferase activity of radix paeoniae alba crude extracts and paeoniflorin at the various concentration were positively correlated. Conclusion Radix paeoniae alba crude extracts can inhibit the adhesion ability, acid generation, insoluble exopolysaccharide production and glucan transferase activity of streptococcus mutaus. Paeoniflorin can inhibit the adhesion ability, insoluble exopolysaccharide production and glucan transferase activity of streptococcus mutaus. Howere, Paeoniflorin has no effect on acid generation of streptococcus mutaus.
radix paeoniae alba; paeoniflorin; streptococcus; streptococcus mutans; polysaccharides; transferases
2015-07-07
福建省自然科学基金(2013J01270)
1.福建省级机关医院 口腔科,福州 350001; 2.福建医科大学 附属口腔医院口腔预防科,福州 350002
陈 昶(1971-),男,副主任医师
卢友光.Email: fjlyg63@163.com
R284.1; R318; R378; R378.12
A < class="emphasis_bold">文章编号:1672-4194(2015)06-0349-06
1672-4194(2015)06-0349-06

