蒙古栎叶中乙烯与松栎柱锈菌春孢子器成熟的关系
薛煜 瓮岳太 季秀 张琳 刘洋 丛赢
(东北林业大学,哈尔滨,150040) (森林植物生态学教育部重点实验室(东北林业大学))
责任编辑:程 红。
樟子松瘤锈病是一种由松栎柱锈菌(Cronartium guercuum)引起的枝干病害,在东北不同地区都有大面积发生[1]。松栎柱锈菌是一种转主寄生菌,性孢子、春孢子阶段生长在樟子松(Pinus sylvestris var.mongolica)上,夏孢子、冬孢子阶段生长在蒙古栎(Quercus mongolica)叶片上。以往的病害调查中发现同一地区不同林分樟子松瘤锈病的春孢子器成熟期不同,春孢子器的成熟期是否与转主寄主的存在与否及转主寄主叶中某些挥发性物质有关?这是本课题组关注的重点。
乙烯是一种调节植物生长、发育和衰老的内源性激素,它既促进营养器官的生长,又能影响开花结实。从1864年发现路灯旁边的树木提前落叶的现象开始,人们就关注了乙烯的作用。1901年,俄国植物生理学家Neljubow 认为照明气中的乙烯会引起黑暗中生长的豌豆苗产生“三重反应”,认为乙烯是一种生长调节剂[2]。此后科学家们一直在探索植物体内的乙烯合成与调节机制。Gane 在试验中发现面包酵母可以释放出一种使豌豆苗的生长受到抑制的气体,这是最早发现真菌合成乙烯现象[3],此后陆续有研究者发现微生物也具有合成乙烯的能力,如异养细菌Escherichia colli,菌根真菌Cenococcum geophilum、Hebeloma crustuliniforme,植物病原真菌Botrytis cinerea、Fusarium oxysporum[4-7]。Kitajima et al.[8]认为当植物在受到各种不良环境胁迫(寒冷、高温、干旱、淹水、盐渍等)时会大量产生乙烯,这是为了减轻或抵御胁迫而做出的反应。乙烯作为启动植物防卫反应的信号,可以诱导植物体内一些病原相关蛋白的产生[8]。为此,本研究测定不同发育时期蒙古栎叶中的乙烯质量摩尔浓度,并进行了松栎柱锈菌春孢子萌发试验,以探究松瘤锈病春孢子器成熟与蒙古栎叶子挥发的乙烯质量摩尔浓度间的关系,为今后深入研究乙烯在寄主与病原菌互作中所扮演的角色及其机制奠定基础,并为掌握该病害的发生发展规律、最佳防治时期提供科学依据。
1 材料与方法
1.1 材料
锈孢子器成熟度的分级及样品的采集:2014年5月上旬,在大兴安岭塔河林业局立地条件相同的樟子松林内,分别在抚育伐和未抚育伐的林分,各调查30 株罹患樟子松瘤锈病病株,检查春孢子器成熟程度。摘取刚展叶5、10、15、30、45、60 d 的蒙古栎叶片放入冰盒中封口的容器内,带回室内待测。
春孢子器成熟标准:Ⅰ级,未形成春孢子器原基;Ⅱ级,春孢子器包被已形成;Ⅲ级,露出黄色成熟的粉状物——春孢子。
试剂:HgCl2-HClO4混合液的配制,200 mL HClO4和27.15 g HgCl2加水定容至1 L。2 mol·L-1的HCl 溶液,37% HCl 稀释6 倍。饱和NaCl 溶液,将NaCl 溶于100 mL 水中至不再溶解为止。
1.2 方法
1.2.1 春孢子萌发试验
分别称取20 g 蒙古栎10 天生、5 天生叶片,捣碎,混合到2%琼脂培养基中,制成10 天生、5 天生叶汁培养基。将培养基切成2 cm×2 cm 的小块置于载玻片上。将载玻片搁置在灭菌的培养皿中的玻棒上。培养皿中分别铺好一层用蒸馏水润湿的脱脂棉,用无菌毛刷粘取新鲜春孢子轻轻弹落在载玻片上,置室温下培养12 h,以后每隔3 h 观察1 次,每次选取3 个视野,统计萌发率。不加叶汁的2%琼脂培养基为对照。每个处理3 个重复。
1.2.2 蒙古栎叶片乙烯质量摩尔浓度的测定
标准乙烯气样的采集:取300 mL HgCl2-HClO4混合液于标定容积的输液瓶中(590 mL),加橡皮瓶塞密封。取1 mL 乙烯(99.9%)注入输液瓶中,振荡2 h,室温放置24 h。从输液瓶中抽取1 mL 气样,测定未被吸收的乙烯量。1 mL 乙烯减去未被吸收的乙烯,即为乙烯吸收量。稀释已吸收乙烯的HgCl2-HClO4混合液1、10、100、500、1 000 倍,用于测定乙烯释放量。
标准乙烯和蒙古栎叶中乙烯的测定:取1 mL 已吸收标准乙烯的HgCl2-HClO4混合液于标定容积的Waters 液谱样品瓶内,加2 mol·L-1HCl 1 mL,迅速拧紧瓶盖,在混合器上振动5 s,置样品于不同的反应条件,取出样品瓶,用注射器从橡胶盖处向样品瓶中注入2 mL 饱和NaCl 溶液,同时另一注射器抽取2 mL 气样,待测。
取蒙古栎叶5 g,迅速投入装有12 mL HgCl2-HClO4混合液的试管中,使蒙古栎叶完全浸没于反应液中,20 h 后转入研钵中研磨,于12 000 r·min-1离心10 min。取上清液2 mL 于Waters 液谱样品瓶中。加2 mol·L-1HCl 1 mL,迅速拧紧瓶盖,在混合器上振动5 s,放入30 ℃水浴保温5 h。取出样品瓶,用注射器从橡胶盖处向样品瓶中注入2 mL 饱和Nacl 溶液,同时另一注射器抽取2 mL 气样,待测。
待测样品的乙烯质量摩尔浓度用岛津-mini 3型气相色谱仪测定,色谱柱4 mm×2 000 mm,G.D.X.502,载气为氮气,氢火焰离子检测器,柱温70 ℃。每个测定3 个重复。
2 结果与分析
2.1 不同林分中松栎柱锈菌春孢子器形成情况
从表1可以看出,5月中旬,在经过抚育伐的樟子松林内,其病株上的春孢子器均未成熟,绝大多数刚刚形成春孢子器原包被。而在未经过抚育伐的樟子松林内,林下蒙古栎已开始展叶,除2 株没有形成春孢子器外,其他28 株病株均已形成春孢子器,揭开树皮,可见黄色的春孢子粉。

表1 不同林分松栎柱锈菌春孢子成熟度调查(n=30 株)
2.2 蒙古栎叶汁对春孢子萌发的影响
春孢子在加蒙古栎叶汁的2%琼脂培养基中萌发率明显高于未加蒙古栎叶汁的;而在较老(10 天生)的蒙古栎叶汁(乙烯质量摩尔浓度193.596 nmol·g-1)的培养基上的萌发率又高于较嫩(5 天生)的蒙古栎叶汁(乙烯质量摩尔浓度993.168 nmol·g-1)的培养基,其萌发率最高可达84.07%;在未加蒙古栎叶汁的培养基上萌发率最低,最高只达56.06%(表2,图1)。
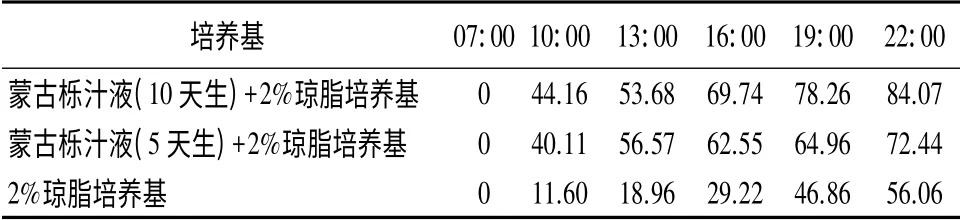
表2 松栎柱锈菌春孢子在不同培养基上的萌发率 %
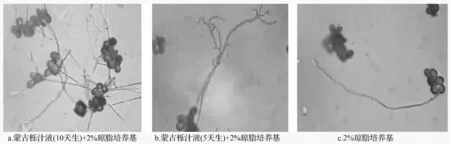
图1 春孢子在不同培养基上的萌发状
2.3 蒙古栎不同发育期乙烯质量摩尔浓度
乙烯标准品和蒙古栎叶样品的气相色谱图见图2。通过数据处理求得在第4 分钟时的峰值为乙烯峰值,展叶5 d 和展叶10 d 的样品乙烯质量摩尔浓度分别为993.168、193.596 nmol·g-1,其他组的峰值逐渐变小,以至趋于恒定(图3)。由此可以说明,蒙古栎叶从萌芽开始,随着叶子的生长发育,乙烯的质量摩尔浓度不断降低,并趋于一个稳定的值。结合松栎柱锈菌春孢子萌发情况,可证实蒙古栎叶汁明显促进了松栎柱锈菌春孢子的萌发,且10 天生叶比5 天生叶促进萌发的效果更佳。这也意味着松栎柱锈菌在10 天生的栎叶上侵染机会最多,这时栎叶的被动抗性结构还未健全,乙烯质量摩尔浓度又恰好适于春孢子萌发定植。
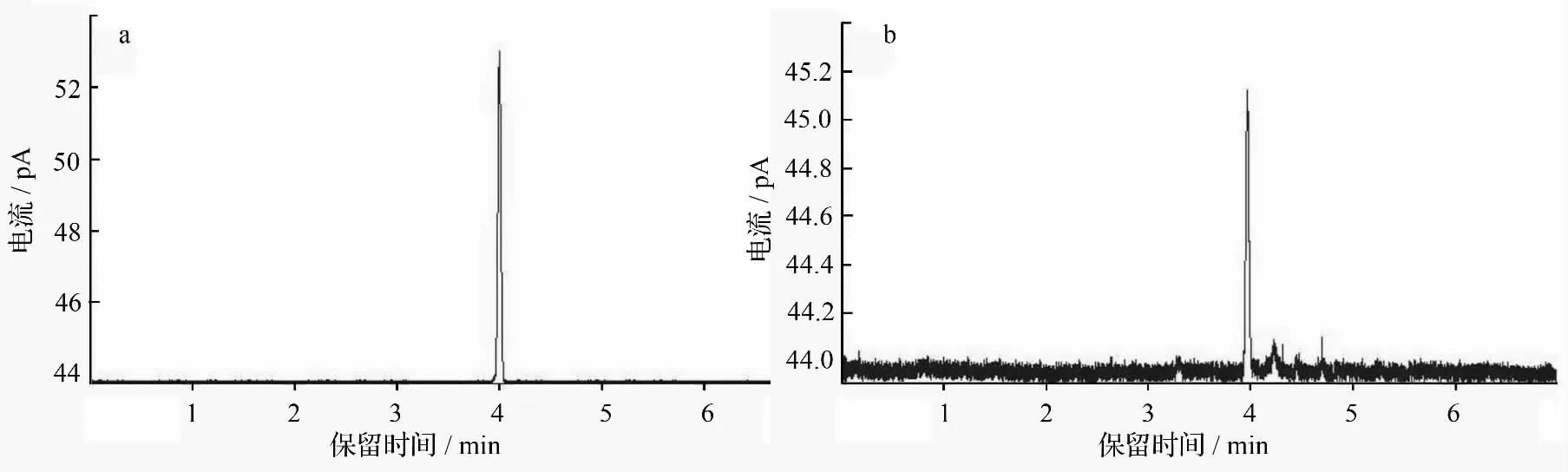
图2 乙烯标准品(a)和蒙古栎叶样品(b)的气相色谱图

图3 不同展叶天数的蒙古栎叶样品的气相色谱图
3 结论与讨论
Cronartium guercuum 是一种比较古老的锈菌,在病原菌与寄主长期的协同进化中,已有了某种默契。蒙古栎在展叶时,正是松栎柱锈菌成熟时,它为了保护自身的安全,增强防御病原菌和其他生物的侵袭,而生产大量乙烯,但也可能正是其发散出的大量乙烯,又给Cronartium guercuum 传导了有了新“猎物”的信息,从而促进了春孢子器的成熟。Cristeseu et al.[6]等已证实植物受到病原微生物侵染后会在体内积累大量的乙烯,这说明寄主和病原菌之间是有感应的。Baldwin 和Schultz[9]在研究中也发现植物在受到外界伤害后往往会释放大量的植物挥发性有机化合物,而其周围的健康植物能够感受到这种信息,并积极地表达抗性基因和产生防御物质,邻近健康植物的乙烯信号途径在植物-植物交流过程中是不可或缺的,茉莉酸信号起到了辅助和信号放大的作用。于延文等[10]也认为在植物的抗病反应中,乙烯是植物防卫反应的报警信号物质并参与防卫反应。张晟瑜[11]在研究中发现,乙烯对灰霉菌的孢子萌发无显著影响,但是对灰霉菌的菌丝生长有显著促进作用。1~1 000 mg·kg-1的外源乙烯都不同程度地促进了灰霉菌菌丝的伸长,其中1 mg·kg-1处理8 h 后,Bot 0023 和Bot 0024 菌株的发芽管伸长速度分别是对照组的11.451、15.098 倍。寄主葡萄的营养可诱导灰霉菌合成乙烯,1~50 mg·kg-1的乙烯可显著(p<0.05)促进灰霉菌菌丝的生长、增强其对果实的致病性[10]。
经过抚育伐的樟子松林,林下无蒙古栎,松栎柱锈菌的春孢子器形成的时间要比未经过抚育伐的樟子松林晚一周左右。在未经抚育伐的樟子松林中,蒙古栎丛生,也许是蒙古栎为保护自已而散发的乙烯反而催熟了松栎柱锈菌的春孢子器,使其提早成熟。调查中发现,春孢子器并不是每年全部发生,在抚育伐的樟子松林中,都发现有未形成春孢子器的病株。这是否和性孢子器当年的受精情况和春孢子器在发育过程中受到某种外界干扰而停止发育有关,还是春孢子器形成也有某些年份间歇的特性,这些尚未被人们所认识,其原因还有待今后继续长期定点定株观察和深入研究。
松栎柱锈菌在加入蒙古栎叶汁的2%琼脂培养基上萌发好,而较老叶(10 天生)比较嫩叶(5 天生)更好,在未加蒙古栎叶汁的2%琼脂培养基上萌发率最低,比较老叶低33.3%,比较嫩叶低22.6%。乙烯对春孢子萌发有明显地促进作用,而且还和乙烯的质量摩尔浓度有关。乙烯质量摩尔浓度在193.596 nmol·g-1(展叶10 d)好于993.168 nmol·g-1(展叶5 d),这充分证实乙烯在春孢子萌发中具有催熟的重要的生理和生态学意义。乙烯还可促进许多植物种子,如谷物、油料(花生、油菜)等以及某些杂草的萌发,还能促进块茎、鳞茎、球茎以及休眠芽萌发[12]。
蒙古栎叶中乙烯质量摩尔浓度的峰值在嫩叶(5 天生)时最高,是较老叶(10 天生)的5 倍,随着叶龄的增加,乙烯质量摩尔浓度迅速下降,并趋于恒定。这可能和寄主防御能力的逐渐增强,细胞壁和角质层已逐渐增厚,乙烯防御作用相对减弱,这也是寄主的一种自我调解能力。
致谢:参加本项工作的还有骆荻、刘豪果、王旭彤、马丽娜同志,在此表示感谢。
[1] 薛煜.东北林区锈菌与锈病[M].哈尔滨:东北林业大学出版社,1995.
[2] Neljubow D N.Uberdie horizontale nutation der stengel von pisum salivun und einiger Anderen pflanzen[J].Beilh Bol Centralbl,1901,10:128-139.
[3] Gane R.Production of ethylene by some ripening fruits[J].Nature,1934,134:1008.
[4] Ince J E,Knowles C J.Ethylene formation by cell-free extracts of Escherichia coli[J].Arch Microbiol,1986,146(2):151-158.
[5] Weingart H,VOlksch B,Ullrich M.Comparison of ethylene production by Pseudomonas syringae and Ralstonia solanacearum[J].Phyto Pathology,1999,89(5):360-365.
[6] Cristeseu S M,De Martinis D,Hekkert S L,et al.Ethylene production by Botrytis cinerea in vitro and in tomatoes[J].Appl Environ Microbiol,2002,68(11):5342-5350.
[7] Graham J H,Linderman R G.Ethylene production by ectomycorrhizal fungi,Fusarium oxysporum f.sp.pini,and by aseptically synthesized ectomycorrhizae and Fusarium-infected Douglas-fir roots[J].Can J Microbiol,1980,26:1340-1347.
[8] Kitajima S,Sato F.Plant pathogenesis-related proteins:molecular mechanisms of gene expression and protein function[J].J Biochem,1999,125(1):1-8.
[9] Baldwin I T,Schultz J C.Rapid changes in tree leaf chemistry induced by damage:evidence for communication between plants[J].Science,1983,221:277-279.
[10] 于延文,黄荣峰.乙烯与植物抗逆性[J].中国农业科技导报,2013,15(2):70-75.
[11] 张晟瑜.乙烯对灰霉菌(Botrytis cinerea)生长发育及致病性的影响[D].上海:华东师范大学生命科学学院,2007:30-37.
[12] 刘愚,焦新之.植物体内乙烯的生物学作用及其调节控制[J].植物生理学报,1978,4(2):205-209.

