抗松材线虫病黑松胚性愈伤组织诱导1)
孙婷玉
(南京林业大学,南京,210037)
叶建仁 吴小芹 朱丽华 吴静 梁芬
(南方现代林业协同创新中心) (江苏省有害生物入侵预防与控制重点实验室(南京林业大学)) (南京林业大学)
责任编辑:程 红。
黑松(Pinus thunbergii)原产日本,为海岸绿化树种之一,在我国辽东半岛、山东、江苏、浙江和台湾均有栽培,但由于其高度感染松材线虫病(Bursaphelenchus xylophilus)使得受害十分严重[1]。因此,培育出具有抗松材线虫病的黑松苗木对解决该问题具有重要意义。组织培养技术可以不受季节和地域的限制,快速高效地繁殖基因优良的树种。组织培养技术可分为器官发生和体细胞胚胎发生。目前国际上普遍认为体细胞胚胎发生是针叶树良种基因型规模化扩繁的最佳途径[2]。体细胞胚胎发生具有繁殖速度快、数量多、结构完整、植株再生率高等特点[3],对优良基因型具有无限扩繁的潜力。体细胞胚胎发生体系中需要经过胚性愈伤组织的诱导、胚性愈伤组织的增殖、体细胞胚的成熟和萌发等阶段,其中胚性愈伤组织的诱导是其关键环节[4]。自Hakman et al.[5]首次报道由欧洲云杉(Picea abies)未成熟合子胚培养物中获得体细胞胚并再生出植株以来,针叶树的体细胞胚胎发生研究已不断取得令人瞩目的进展。我国针叶树体细胞胚胎发生研究开展虽然相对较晚,但是也取得了很大的进展。黄健秋等[6-7]利用马尾松(Pinus massoniana)、云南松(P.yunnanensis)成熟合子胚诱导体细胞胚胎发生获得体细胞胚;唐巍等[8-9]分别利用火炬松(P.taeda)、湿地松(P.elliottii)成熟合子胚通过体细胞胚胎发生途径实现植株再生;申晓辉等[10]用红松(P.koraiensis)未成熟合子胚首次建立了红松体细胞胚胎培养体系;李清清[11]等用黑松未成熟合子胚建立了黑松体细胞胚胎培养体系;吴静等[12]首次在国内诱导出了抗松材线虫病赤松(P.densiflora)的胚性愈伤组织。而目前,国内尚无有关抗松材线虫病黑松体细胞胚胎发生的相关报道。本研究以抗松材线虫病黑松未成熟合子胚为外植体,对抗性黑松胚性愈伤组织诱导进行了研究,以期提高抗性黑松胚性愈伤组织的诱导率;为抗性黑松体细胞胚胎发生提供研究材料,以获得抗性黑松苗木;这对解决我国松材线虫病具有重要的意义。
1 材料与方法
1.1 外植体材料的获取
2004年本课题组从日本引进了抗松材线虫病黑松种子[13],并在句容林场建立了基因库种子园。抗性黑松未成熟球果采自基因库种子园,选取抗性较强的30、31、34、35、36、37、39 号家系生长健壮的树木为母树,于2012—2013年6月底到8月初每周采集1 次,采集后于冰箱中4 ℃保存备用。
1.2 外植体的处理方法
将抗性黑松未成熟球果(图1a)的珠鳞剥离后取出种子(图1b),放入广口瓶中用无菌水洗涤干净,转入灭菌的小三角瓶中,在超净工作台上用无菌纱布包好,75%乙醇进行表面消毒30 s,再用0.1%HgCl2灭菌30 s~3 min,无菌水冲洗3 次后再用无菌滤纸吸去种子表面多余的水分,最后用镊子剥去种壳和内种皮,取雌配子体水平放置于诱导培养基上,每诱导培养基接种3~5 个雌配子体,用封口膜封住培养皿。对于那些还不能剥掉内种皮的幼嫩种子,则连同内种皮一起接种。
1.3 球果采集时期对胚性愈伤组织诱导的影响
将各采集时期的雌配子体放入设计好的诱导培养基中,每个培养基接种3~5 个雌配子体,3 个月后统计胚性、非胚性愈伤组织诱导率。
1.4 球果冷藏时间对胚性愈伤组织诱导的影响
采集的抗性黑松球果,分别在冰箱中4 ℃冷藏7、14、21 d,分3 批次接种于诱导培养基上,3 个月后统计胚性愈伤组织诱导率以及种子的褐化情况。
1.5 碳源对愈伤组织诱导的影响
将采集的黑松36#家系种子灭菌后接种于分别添加30 g·L-1麦芽糖、蔗糖、葡萄糖的诱导培养基上。每个处理接种雌配子体3~4 个,重复3 次。暗培养,3 个月左右统计胚性和非胚性愈伤组织诱导率。
1.6 不同激素对胚性愈伤组织的诱导的影响
抗性黑松诱导培养基以DCR 为基本培养基[14],添加2,4-二氯苯氧乙酸(2,4-D)1.0~4.0 mg·L-1,6-苄氨基嘌呤(6-BA)0~5.0 mg·L-1,6-呋喃甲基腺嘌呤(KT)0~1.0 mg·L-1。每个处理接种雌配子体3~4 个,重复3 次。暗培养,3 个月左右统计胚性和非胚性愈伤组织诱导率。
1.7 培养条件和数据处理
培养温度(23±1)℃,暗培养。胚性愈伤组织诱导率=(产生胚性愈伤组织雌配子体数/接种雌配子体数)×100%;非胚性愈伤组织诱导率=(产生非胚性愈伤组织雌配子体数/接种雌配子体数)×100%,若无特殊说明,上述所有胚性愈伤组织诱导培养基中均添加30.0 g·L-1麦芽糖,1.0 g·L-1肌醇,450.0 mg·L-1谷氨酰胺(Gln),500.0 mg·L-1水解酪蛋白(CH),250.0 mg·L-12-(N-吗啡啉)乙磺酸(MES),5.2 g·L-1琼脂粉,高压灭菌(121 ℃,0.4 MPa)20 min,灭菌前pH 调至5.8。
2 结果与分析
2.1 抗性黑松球果采集期对胚性愈伤组织诱导的影响
合子胚的发育阶段对成功诱导胚性愈伤组织至关重要,而球果采集期与合子胚发育阶段关系密切。研究发现:6月20日至7月11日采集的抗性黑松未成熟球果种鳞幼嫩无木质化现象;雌配子体呈光亮浅白色(图1c),合子胚从雌配子体中抽出多呈透明的丝状物。6月20日采集的抗性黑松未成熟球果,胚性愈伤组织的诱导率最高(7.8%)。7月11日采集的抗性黑松未成熟球果,胚性愈伤组织的平均诱导率较高(1.5%)。7月18日采集的抗性黑松球果开始出现木质化现象,球果颜色逐渐变淡,从深绿转变成黄绿,雌配子颜色呈乳白色,外种皮薄、黄褐色,至此阶段平均诱导率(0.4%)开始下降;8月2日胚性愈伤组织的诱导率为0。胚性愈伤组织的诱导率与球果采集期呈现一定的相关性,即随着合子胚发育逐渐成熟,胚性愈伤组织的诱导率逐渐下降。
2.2 抗性黑松球果冷藏时间对胚性愈伤组织诱导的影响
抗性黑松未成熟球果冷藏时间直接影响雌配子体的质量。由表1可见:未成熟球果冷藏7~14 d,胚性愈伤组织的诱导率呈上升趋势。冷藏时间超过14 d,胚性和非愈伤组织的诱导率下降,并且雌配子体的褐化程度显著上升。抗性黑松球果冷藏7~14 d 诱导出的胚性愈伤组织半透明具黏性(图1d,e,g),在诱导培养基上生长速度较快。冷藏14~21 d,雌配子体逐渐变软颜色发黄,表面无光泽,胚性愈伤组织的诱导率为0。
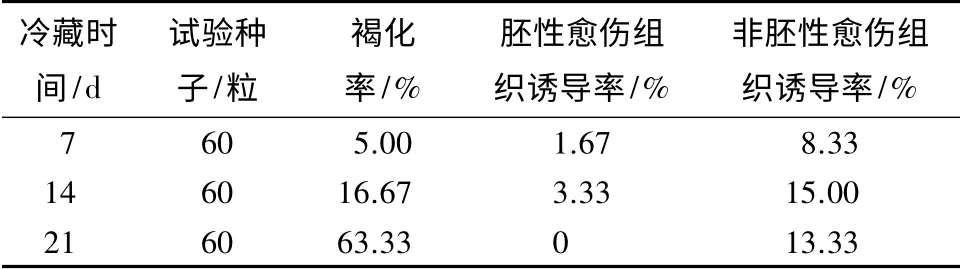
表1 冷藏时间对抗性黑松胚性愈伤组织诱导的影响
2.3 碳源对抗性黑松胚性愈伤组织诱导的影响
糖类作为抗性黑松胚性愈伤组织诱导的碳源,其种类对胚性愈伤组织的发生会产生不同的影响(表2),在麦芽糖和蔗糖为碳源的诱导培养基上都能产生非胚性愈伤组织,但只有在麦芽糖的诱导培养基上获得抗性黑松胚性愈伤组织。而以葡萄糖为碳源的培养基上不能诱导胚性和非胚性愈伤组织的发生,可见麦芽糖更适合作为抗性黑松体胚发生的碳源。
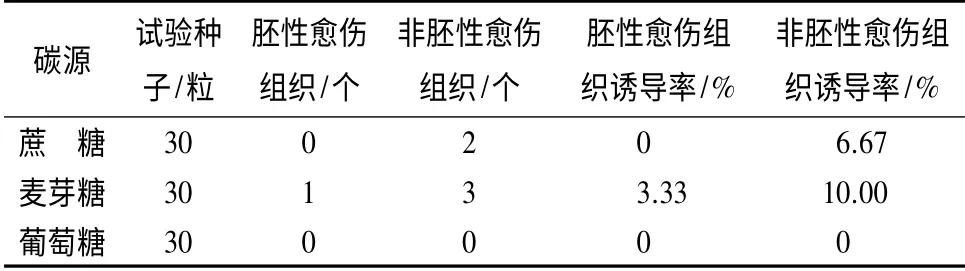
表2 不同碳源对抗性黑松愈伤组织诱导的影响
2.4 植物激素对抗性黑松胚性愈伤组织诱导的影响
植物激素在诱导胚性愈伤组织的过程中至关重要,不同的激素配比与组合对胚性愈伤组织的发生产生不同的作用(表3)。2,4-D 质量浓度1 mg·L-1,当2,4-D 与KT 质量浓度比为2 ∶1 时,抗性黑松胚性愈伤组织的诱导率要明显高于5 ∶1 配比;2,4-D 质量浓度4 mg·L-1,当2,4-D 与KT 质量浓度比为4 ∶1 和2,4-D 与6-BA 质量浓度2 ∶1 时,分别获得诱导率的最高值(7.5%);保持KT 质量浓度0.5 mg·L-1,增加2,4-D 质量浓度,抗性黑松胚性愈伤组织的诱导率降低,说明低质量浓度的2,4-D更适合抗性黑松胚性愈伤组织的诱导;保持2,4-D质量浓度4 mg·L-1,KT 质量浓度变化对抗性黑松胚性愈伤组织诱导影响显著,而6-BA 质量浓度变化对抗性黑松胚性愈伤组织诱导影响不显著,需和2,4-D 配合使用才能更好地发挥作用。诱导抗性黑松胚性愈伤组织最佳激素组合与配比:2,4-D 4 mg·L-1+6-BA 2 mg·L-1或2,4-D 4 mg·L-1+KT 1 mg·L-1。
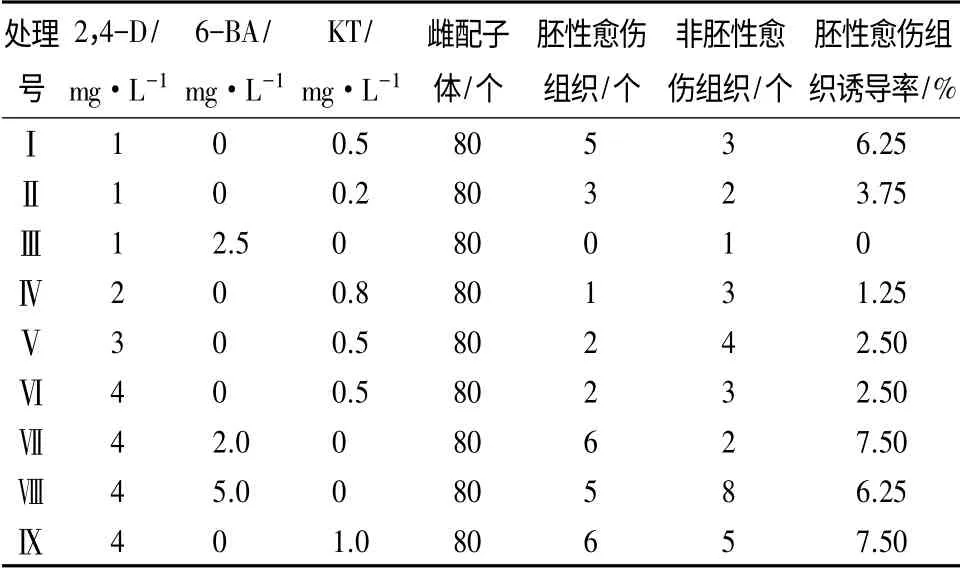
表3 不同激素配比对抗性黑松愈伤组织诱导的影响
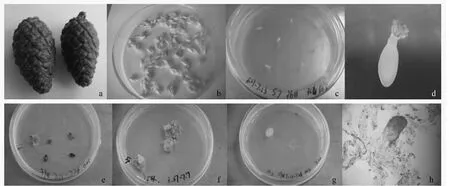
图1 抗性黑松未成熟合子胚胚性愈伤组织诱导
3 结论与讨论
植物胚性愈伤组织的诱导是一个复杂的过程,一般来说,合子胚比植物幼嫩组织容易诱导胚性愈伤组织,且未成熟合子胚比成熟合子胚容易诱导胚性愈伤组织。针叶树胚性愈伤组织的诱导一般以未成熟合子胚为外植体[15]。影响胚性愈伤组织诱导的因素包括:外植体的年龄和生理状态、基因型、基本培养基、碳源、温度、植物激素的种类和浓度等[16]。本研究发现,抗性黑松未成熟球果采集期、球果冷藏时间、植物激素配比与组合以及所选择的碳源都对胚性愈伤组织的诱导具有重要的影响。
在松属树种中,只有处于某一个发育阶段(窗口期)的幼胚才对胚性愈伤组织的诱导反应敏感[17]。比较北美乔松(P.strobus)[18]、海岸松(P.pinaster)、欧洲赤松(P.sylvestris)[2]等幼胚诱导胚性愈伤组织的球果采种期,发现处于6月下旬至7月上旬的幼胚为以上松属树种诱导胚性愈伤组织的敏感期。本研究发现,在南京地区,6月20日至7月11日为诱导抗性黑松胚性愈伤组织的较佳时期,这一结论与以上松属树种诱导胚性愈伤组织的最佳采种期基本一致。
Pullman et al.[19]研究发现外植体接种前进行冷处理(2~4 ℃)1 周以上,能够有效提高胚性愈伤组织诱导率。吴丽君[20]研究认为球果放在冰箱4 ℃冷藏20 d 内有利于湿地松胚性愈伤组织诱导,Haggman et al.[21]在研究红松体胚发生中有相似的报道。本研究发现,抗性黑松球果冷藏7~14 d 能有效提高胚性愈伤组织的诱导率,冷藏超过14 d 胚性愈伤组织的诱导率下降,这与以上结论基本相符。
目前,针叶树诱导胚性愈伤组织发生常用的碳源有蔗糖和麦芽糖。杨模华等[22]利用蔗糖诱导出了马尾松胚性愈伤组织;马丽源等[23]利用蔗糖诱导出了油松(P.tabuliformis)胚性愈伤组织;Maruyama et al.[24]利用蔗糖、李清清等[11]利用麦芽糖诱导出黑松未成熟合子胚胚性愈伤组织并能发育成完整的体胚苗。本研究选用麦芽糖、蔗糖和葡萄糖为碳源,但只有在以麦芽糖为碳源的培养基上诱导出了胚性愈伤组织,说明麦芽糖更适合抗性黑松胚性愈伤组织的诱导。
体胚诱导过程中适当的激素配比对诱导的影响也很关键[25]。韩登媛等[26]在研究华北落叶松(P.larix)胚性愈伤组织诱导中发现2,4-D 是主要影响因子,其次是KT,最后是6-BA,并且2,4-D 不能单独使用,需要与KT,6-BA 合理配合才能使胚性愈伤组织的诱导率提高。本研究表明,不同的激素配比与组合对抗性黑松胚性愈伤组织的诱导作用不同。低质量浓度的2,4-D 更适合抗性黑松胚性愈伤组织的诱导,KT 质量浓度变化对抗性黑松胚性愈伤组织诱导影响比6-BA 明显,本试验得出诱导抗性黑松胚性愈伤组织最佳激素组合为2,4-D 4 mg·L-1+6-BA 2 mg·L-1或2,4-D 4 mg·L-1+KT 1 mg·L-1。
黑松体细胞胚胎发生在国内外有少量报道,而且胚性愈伤组织诱导率均较低。Maruyama et al.[24]以日本黑松未成熟合子胚为外植体建立了体细胞胚胎发生体系,胚性愈伤组织诱导率为2%,国内李清清等[11]以黑松未成熟合子胚为外植体,胚性愈伤组织诱导率为1.67%。本研究以日本抗松材线虫病黑松未成熟合子胚为材料,胚性愈伤组织的诱导率最高为7.8%,可为抗性黑松体胚发生提供基础材料。
[1] 杨宝君,潘宏阳,汤坚,等.松材线虫病[M].北京,中国林业出版社,2003.
[2] Park Y S,Lelu Walter M A,Harvengt L,et al.Initiation of somatic embryogenesis in Pinus banksiana,P.strobus,P.pinaster,and P.sylvestris at three laboratories in Canada and France[J].Plant Cell Tiss Org Cult,2006,86(1):87-101.
[3] 金晓玲,何平.乔木树种体细胞胚发生的研究与应用[J].林业科学研究,2003,16(3):343-350.
[4] 兰彦平,顾万春.林木无性繁殖进展[J].世界林业研究,2002,15(6),7-14.
[5] Hakman I,Fowkc I C,Arnold Von S,et al.The development of somatic embryos in tissue cultures initiated from immature embryos of Picea abies (Norway spruce)[J].Plant Sci,1985,38(1):53-59.
[6] 黄健秋,卫志明,许智宏.马尾松成熟合子胚的体细胞胚胎发生和植株再生[J].植物学报,1995,37(4):289-294.
[7] 黄健秋,卫志明,许智宏.云南松成熟胚的体细胞胚胎发生研究[J].实验生物学报,1995,28(4):371-379.
[8] 唐巍,欧阳藩,郭仲琛.火炬松细胞悬浮培养体细胞胚胎发生的研究[J].西北植物学报,1996,16(4):399-402.
[9] 唐巍,郭仲琛.湿地松体细胞胚胎发生和植株再生[J].植物资源与环境,1997,6(2):8-11.
[10] 申晓辉,蒋湘宁.红松体细胞胚胎培养技术体系的建立[J].成都大学学报:自然科学版,2005,24(1):11-14.
[11] 李清清,叶建仁,朱丽华,等.黑松未成熟胚的体细胞胚胎发生和植株再生[J].林业科学,2012,48(12):39-44.
[12] 吴静,朱丽华,许建秀,等.抗松材线虫病赤松胚性愈伤组织的诱导及增殖[J].南京林业大学学报:自然科学版,2015,39(1):17-21.
[13] 吴小芹,张艺,陈蔚诗,等.黑松13 个抗病家系对松材线虫的抗性反应及组织病理学观察[J].植物病理学报,2008,38(1):44-50.
[14] Gupta P K,Durzan D J.Shoot multiplication from mature trees of Douglas-fir (Pseudotsuga menziesii)and sugar pine (Pinus lambertiana)[J].Plant Cell Rep,1985,4(4):177-179.
[15] Liao Y K,Amerson H V.Slash pine(Pinus elliottii Engelm.)somatic embryogenesis Ⅰ.Initiation of embryogenic cultures from immature zygotic embryos[J].New Forests,1995,10(2):145-163.
[16] 郑仁华.杉木优良无性系组培快繁及体胚发生试验研究[D].厦门:厦门大学,2008.
[17] MacKay J J,Becwar M R,Park Y S,et al.Genetic control of somatic embryogenesis initiation in loblolly pine and implications for breeding[J].Tree Genet Genomes,2006,2(1):1-9.
[18] Klimaszewska K,Park Y S,Overton C,et al.Optimized somatic embryogenesis in Pinus strobus L.[J].In Vitro Cell Dev-PL,2001,37(3):392-399.
[19] Pullman G S,Bucalo K,John M W.Pine somatic embryogenesis using zygotic embryos as explants[M]//Thorpe T A,Yeung E C.Plant embryos culture:methods and protocols.Now York:Humana Press,2011:267-285.
[20] 吴丽君.湿地松合子胚发育与体胚诱导的研究[J].福建林学院学报,2009,29(3):243-246.
[21] Haggman H,Jokela A,Krajnakova J.Somatic embryogenesis of Scots pine:Cold treatment and characteristics of explants affecting induction[J].Journal of Experimental Botany,1999,50:1769-1778.
[22] 杨模华,张冬林,李志辉,等.马尾松幼胚体细胞胚胎发生研究[J].植物生理学报,2011,47(9):904-912.
[23] 马丽源,张瑛,尚福强,等.油松未成熟合子胚离体培养诱导胚性愈伤组织[J].北方园艺,2012(7):126-129.
[24] Maruyama E,Hosoi Y,Ishii K.Somatic embryo production and plant regeneration of Japanese black pine (Pinus thunbergii)[J].J For Res,2005,10(5):403-407.
[25] 袁澍,贾勇炯,林宏辉.诱导植物体细胞胚发生的几个生理因素[J].植物生理学通讯,2003,39(5):508-512.
[26] 韩登媛,李旦,赵健,等.华北落叶松胚性愈伤组织诱导影响因子的研究[J].林业科学研究,2013,26(4):454-458.

