人带3蛋白对红细胞携氧过程调控的研究进展
人带3蛋白对红细胞携氧过程调控的研究进展
作者单位:400038 重庆,第三军医大学高原军事医学系高原生理学与高原生物学教研室
官立彬,杨诚忠,李晓栩,黄瑊
[关键词]带3蛋白;血红蛋白;气体运输
带3蛋白(band 3 protein,Band3)是一种红细胞膜蛋白,因其在聚丙烯酰胺凝胶电泳时分布于第3条带而得名。Band3在红细胞膜中含量约为膜蛋白的25%,其属于糖蛋白的一种,在质膜中穿越12~14次,是多次跨膜蛋白。它是由两个相同的亚基组成的二聚体,每条亚基含有929个氨基酸,分子量约 95~100 kDa,由53 kDa的疏水性跨膜段及43 kDa的亲水性胞质段组成[1]。疏水性跨膜域的生理功能是介导Cl-/HCO3-交换,因此Band3又称为“阴离子交换蛋白(anion exchanger protein, AEP)”。Band3胞浆段有膜骨架蛋白、糖酵解3个关键酶酶(醛缩酶、磷酸果糖激酶、磷酸甘油醛脱氢酶)、血红蛋白(hemoglobin,Hb)及其降解物的结合位点以及磷酸化位点,因而 Band3不仅是膜骨架的主要附着点,而且参与多种物质和信息的跨膜传递和功能调节[2]。
Hb是红细胞运氧的载体,占红细胞干重的97%、总重的35%。平均每克Hb可结合1.34 ml的氧,是血浆溶氧量的70倍左右。健康成人Hb主要是血红蛋白A(HbA),约占总量的98%。其分子量约67 kDa,由4个亚基(α2β2)组成,且α和β亚基彼此相向形成一个空腔。在脱氧后(如静脉血)Hb亚基处于钳制状态(T-状态),使氧不能与血红素结合,这时称为脱氧血红蛋白(deoxy-Hb);在氧合后(如肺部),亚基结合氧气后呈松弛状态(R-状态),称为氧合血红蛋白(oxy-Hb)。Hb在R-状态和T-状态互变过程中,4个亚基间出现协同作用,产生了S形的氧平衡曲线(oxygen equilibrium curve,OEC),其形状由血红蛋白的氧亲和力(P50表示)和亚基间的协同效应(希尔系数,n表示)共同决定。而协同效应存在于氧离氧合互换之间,在S曲线的陡部最高,范围从1(不协同)到3(最大),不存在于R-状态和T-状态(曲线的两端)[3]。OEC形状从直线变为陡峭的S形曲线,这也是红细胞能快速释放结合氧气的基础。
Band3与Hb如何连接,如何相互作用影响红细胞氧气的运输,一直是很多学者关注的问题。本文将围绕这个方面讨论。
1Band3通过Cl-/HCO3-交换调控红细胞O2的结合和释放与CO2的运输

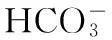
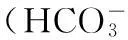
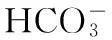
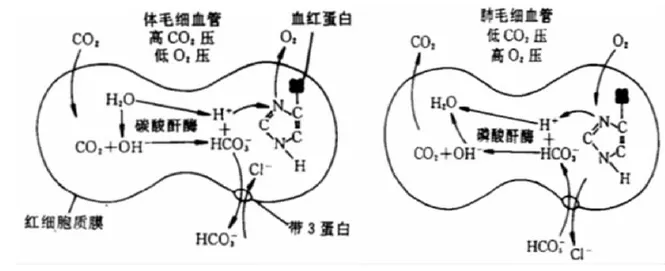
图1 带3蛋白反向转运Cl-/HCO3-示意图

2Band3与deoxy-Hb连接调控红细胞O2的结合和释放
Walder[6]研究发现,Band3胞质段N端11个氨基酸主要和deoxy-Hb结合,结合点位于脱氧Hb两条β链构成的“小穴”中,按1∶1结合。这种结合仅发生于deoxy-Hb与Band3之间,将Hb氧合,不与Band3结合[7]。Band3与2,3-二磷酸甘油酸(diphosphoglyceric acid,2,3-DPG)结合Hb的方式相似,具有竞争性,且受到pH的影响。酸性环境时血红蛋白与Band3紧密结合, pH值在6~7时,二者开始分开[8]。有研究发现[3],Band3胞质段N端11个氨基酸、2,3-DPG、Cl-与deoxy-Hb结合后P50、Hill系数出现一致的变化规律,即低比例与结合deoxy-Hb时,T-状态Hb出现两种群体(一部分结合效应因子,一部分未结合),相互作用后,可降低Hb亚基间的协同效应,且在0.5∶1结合时降低最明显,Hb协同效应n值降为1.5;当1∶1与deoxy-Hb结合时,T-状态血红蛋白只有一种状态(全部结合效应因子),协同效应n值恢复到正常(2.7左右);且Hb的氧亲和力随着上述因子浓度的增加而降低,降低幅度2,3-DPG大于Band3胞质段N端11个氨基酸。
Band3与deoxy-Hb这种结合特性在红细胞释放结合O2的过程中发挥着重要作用。当红细胞由肺毛细血管到达氧分压低的外周组织毛细血管后,由于氧分压压力差的驱动和CO2弥散进入红细胞经Band3离子交换的作用,将使一部分oxy-Hb释放O2变为deoxy-Hb。Band3胞质段N端11个氨基酸可与deoxy-Hb结合,由于是低比例结合,这时近膜侧的Hb协同效应降低。而红胞质内的Hb可自由结合2,3-DPG、Cl-,协同效应不受影响,且胞质内Hb的氧亲和力(P50)较近膜侧的Hb低。因此,可促使红细胞胞内氧合血红蛋白率先解离释放氧气,形成胞内向胞膜侧氧分压逐降趋势,产生O2向胞外定向弥散的驱动力,也形成了逆血氧饱和度的供氧机制。
当红细胞由外周到达肺时,由于deoxy-Hb与Band3胞质段N端11个氨基酸结合后Hb氧亲和力高于与2,3-DPG或Cl-结合,因此与Band3胞质段N端11个氨基酸结合的deoxy-Hb在到达肺泡时优先与氧气结合,这有利于低氧时红细胞的氧合[8]。
3Band3通过调控胞内能量代谢保护红细胞运氧特性
磷酸戊糖途径(pentose phosphate pathway,PPP)可产生NADPH,而NADPH可促使红细胞内氧化形成的高铁血红蛋白还原回具有运氧功能的亚铁血红蛋白。糖酵解途径(glycolytic pathway,GP)是红细胞内ATP的生成途径,其途径中3个关键酶能与Band3胞质段可逆结合。红细胞处于高氧合状态时,3个关键酶与Band3胞质段结合失去活性,而PPP的酶游离于胞质中生成NADPH,还原氧化的Hb[2,9]。红细胞处于脱氧状态时,由于deoxy-Hb与3个关键酶结合位置重叠,deoxy-Hb可与3个关键酶竞争性结合Band3。因而导致3个关键酶脱下到胞浆[10-11]。因GP与PPP竞争共同底物葡萄糖,反应向GP进行,增加生成ATP。有研究发现[12-13],红细胞在外周毛细血管由于升高的温度、降低pH值、高碳酸血症、高剪切应力和增强的机械变形等增加,可经pannexin-1向血浆“抛出”ATP,促进内皮细胞产生NO,促使毛细血管扩张,便于其快速通过外周毛细血管[14]。氧分压与pH值的改变可促使deoxy-Hb与Band3的解离,同时可使3个关键酶与Band3重新结合失去活性,胞内糖代谢途转化为磷酸戊糖途径,发挥抗氧化作用。Band3间接地控制红细胞内的能量代谢,在一定程度上维护了糖酵解酶的活性,维持了Hb的携氧特性。
4Band3通过调控红细胞的变形性增强红细胞在毛细血管的穿梭
红细胞平均直径为7.5 μm,毛细血管管径平均为6~9 μm,红细胞通过毛细血管除扩张毛细血管外,还有另外一条途径,增强自身的变形性。
红细胞膜骨架蛋白(血影蛋白、肌动蛋白)之间的桥梁锚蛋白与Band3的胞质域相结合,保持了红细胞双凹圆盘状。由于Band3与锚蛋白接触的残基同Band3与deoxy-Hb结合位点相毗邻,当Band3与deoxy-Hb结合后,直接影响Band3与锚蛋白之间的连接,使锚蛋白与Band3解离呈游离状态,增加红细胞膜的变形性[15],这种改变有利于红细胞在脱氧状态时快速通过外周毛细血管。
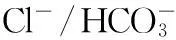
【参考文献】
[1]Reithmeier AF.The erythrocyte anion transporter (band 3)[J].Curr Opin Struct Biol, 1993, 3: 515-523.
[2]Lewis IA, Campanella ME,Markley JL,et al.Role of band 3 in regulating metabolic flux of red blood cells[J]. Proc Natl Acad Sci USA, 2009, 106(44): 18515-18520.
[3]Zhang Y, Manning LR, Falcone J,et al.Human erythrocyte membrane band 3 protein influences hemoglobin cooperativity. Possible effect on oxygen transport[J]. J Biol Chem, 2003, 278(41): 39565-39571.
[4]Dash RK.Erratum to: blood HbO2and HbCO2dissociation curves at varied O2, CO2, pH, 2,3-DPG and temperature levels[J]. Ann Biomed Eng, 2010,38(4): 1683-1701.
[5]陈静, 赵守城.带3蛋白反向转运Cl-/HCO3-的意义[J]. 生物学通报, 2001, 36(10): 14-15.
[6]Walder JA. The interaction of hemoglobin with the cytoplasmic domain of band 3 of the human erythrocyte membrane[J]. J Biol Chem, 1984, 259(16): 10238-10246.
[7]Salhany JM.Cassoly R.Kinetics of P-mereufibefizoate binding to sulfhydrylgroups on the isolated cytoplasmic fragment of band 3 protein,Effect of hemoglobin binding on the conformation[J]. J Biol Chem, 1989, 264: 1399-1404.
[8]Salhany JM,Cordes KA,Sloan RL.Characterization of the pH dependence of hemoglobin binding to band 3. Evidence for a pH-dependent conformational change within the hemoglobin-band 3 complex[J]. Biochim Biophys Acta, 1998, 1371(1): 107-113.
[9]Messana I,Orlando M, Cassiano L,et al. Human erythrocyte metabolism is modulated by the O2-linked transition of hemoglobin[J]. FEBS Lett, 1996, 390(1): 25-28.
[10]De Rosa MC ,Carelli Alinovi C,Galtieri A, et al.Allosteric properties of hemoglobin and the plasma membrane of the erythrocyte: new insights in gas transport and metabolic modulation[J]. IUBMB Life, 2008, 60(2): 87-93.
[11]Campanella ME,Chu H,Wandersee NJ, et al .Characterization of glycolytic enzyme interactions with murine erythrocyte membranes in wild-type and membrane protein knockout mice[J]. Blood, 2008, 112(9):3900-3906.
[12]Gonzalez-Alonso J.ATP as a mediator of erythrocyte-dependent regulation of skeletal muscle blood flow and oxygen delivery in humans[J]. J Physiol, 2012, 590(20): 5001-5013.
[13]Wan J, Forsyth AM, Stone HA.Red blood cell dynamics: from cell deformation to ATP release[J]. Integr Biol (Camb), 2011, 3(10): 972-981.
[14] Sprague RS, Ellsworth ML. Erythrocyte-derived ATP and perfusion distribution: role of intracellular and intercellular communication[J]. Microcirculation, 2012, 19(5): 430-439.
[15]Stefanovic M, Puchulu-Campanella E, Kodippili G, et al.Oxygen regulates the band 3-ankyrin bridge in the human erythrocyte membrane[J]. Biochem J, 2013, 449(1): 143-150.
(收稿日期:2015-01-22)
文章编号1004-0188(2015)04-0449-03
doi:10.3969/j.issn.1004-0188.2015.04.044
中图分类号R 331.141
文献标识码A
通讯作者:黄瑊,电话:023-68772383;E-mail: hj3red@gmail.com
基金项目:国家973计划项目(2012CB518201);国家自然科学基金(81370150,30973446)

