新型mTORC1/mTORC2双重抑制剂OSI-027对人结肠癌细胞株HT-29的体外抑制作用
陈国平 曹大春 刘海林
(上海交通大学医学院附属第九人民医院消化科,上海 200011)
·论著·
新型mTORC1/mTORC2双重抑制剂OSI-027对人结肠癌细胞株HT-29的体外抑制作用
陈国平曹大春刘海林
(上海交通大学医学院附属第九人民医院消化科,上海200011)
摘要目的:探讨新型mTORC1/mTORC2双重抑制剂OSI-027对人结肠癌细胞株HT-29的体外抑制作用。方法:体外培养的人结肠癌HT-29细胞株,给予不同浓度(0.1、1、10、25、50 nmol/L)的OSI-027处理,或以25 nmol/L OSI-027 处理0、24、48、72、96 h后,采用四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)法、细胞集落形成实验观察HT-29细胞的生长增殖情况;应用流式细胞仪(FACS)及台盼蓝染色法检测OSI-027处理后HT-29细胞的凋亡和死亡情况;采用蛋白质印迹(Western blotting)法检测HT-29细胞凋亡相关蛋白cleaved-caspase-3和细胞色素C(cytochrome C)的表达。结果:OSI-027可抑制HT-29细胞的存活,且呈浓度和时间依赖性;还可抑制HT-29细胞的增殖,呈浓度依赖性;此外,OSI-027还能诱导HT-29细胞的凋亡和死亡,并呈浓度依赖性。OSI-027处理后,HT-29细胞中凋亡相关蛋白cleaved-caspase-3和cytochrome C的表达水平上调。结论:新型mTORC1/mTORC2双重抑制剂OSI-027可抑制人结肠癌细胞HT-29的增殖并诱导细胞凋亡。
关键词结肠癌;OSI-027;哺乳动物雷帕霉素靶蛋白;凋亡;信号转导
结肠癌的发病率在我国恶性肿瘤中居第3位,且呈逐年上升趋势[1]。以往常用于结肠癌治疗的奥沙利铂、5-氟尿嘧啶等药物的不良反应较严重,且易产生耐药性[2]。
研究[3-5]证实,PI3K-Akt-mTOR信号通路在结肠癌等多种实体恶性肿瘤中过度表达及活化。PI3K-Akt-mTOR信号通路可以通过多种机制诱导结肠癌的发生与发展,促进肿瘤细胞的存活、增殖、转移,并抑制细胞凋亡等[3]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是磷脂酰肌醇3-激酶(phosphatidyl inositol-3-kinase,PI3K)信号通路中位于蛋白激酶B(protein kinase B,Akt)下游的重要分子,有2种复合物mTORC1和mTORC2,参与调节蛋白质合成、细胞周期和细胞增殖。
近年来筛选出的新型mTOR特异性激酶抑制剂OSI-027能阻断mTORC1和mTORC2的活性[6]。本研究旨在观察OSI-027对人结肠癌细胞株HT-29的体外抑制作用。
1资料与方法
1.1材料人结肠癌细胞株HT-29及OSI-027均购自德国Calbiochem公司;二甲基亚砜(DMSO)、四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)检测试剂盒、DMEM、胎牛血清(fetal bovine serum,FBS)、碘化丙啶(propidium iodine,PI)凋亡试剂盒均购自美国Sigma公司。实验所需的抗体购自美国Cell Signaling Technology公司。
1.2方法
1.2.1细胞培养人结肠癌细胞株HT-29用含10% FBS的DMEM培养液于37 ℃、CO2体积分数为5%的培养箱中培养,48 h更换一次培养液,3~4 d传代1次。取对数生长期细胞进行细胞实验。OSI-027以DMSO溶解,后续实验中以等体积的0.1%DMSO作为对照。
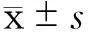
1.2.3细胞集落形成实验检测细胞增殖将HT-29细胞接种于6孔板,每组设5个复孔,置于37 ℃、CO2体积分数为5%的培养箱中孵育过夜。给予不同浓度的OSI-027(0.1、1、10、25 nmol/L)或等体积DMSO处理8 d后,观察直径>50 μm集落的数目,并与对照组进行比较,实验至少重复3次。细胞增殖率=实验组直径>50 μm集落的数目/对照组直径>50 μm集落的数目×100%。
1.2.4流式细胞仪(FACS)检测细胞凋亡将HT-29细胞接种于6孔板,每组3~4个复孔,置于37 ℃、CO2体积分数为5%的培养箱中培养。给予不同浓度的OSI-027(1、10、25和50 nmol/L)或等体积DMSO处理72 h后,采用Annexin-V-FITC/PI凋亡检测试剂盒鉴别细胞凋亡类型,其中,Annexin-V-FITC阳性/PI阴性的细胞为早期凋亡细胞,Annexin-V-FITC阳性/PI阳性的细胞为晚期凋亡细胞,而Annexin-V-FITC阴性/PI阳性的细胞为非凋亡细胞。每个样本至少检测20 000个细胞,实验至少重复3次。计算Annexin-V-FITC阳性细胞的比率,即为凋亡率。
1.2.5台盼蓝染色检测细胞死亡将HT-29细胞接种于6孔板,每组3个复孔,置于37 ℃、CO2体积分数为5%的培养箱培养。给予不同浓度的OSI-027(1、10、25和50 nmol/L)或等体积DMSO处理,72 h后对细胞进行台盼蓝染色,死亡细胞为台盼蓝染色阳性。实验至少重复3次。细胞死亡率=实验组台盼蓝阳性细胞数/对照组总细胞数×100%。
1.2.6蛋白质印迹(Western blotting)法检测HT-29细胞凋亡相关蛋白的表达取培养的HT-29细胞,给予OSI-027(25 nmol/L)或等体积DMSO处理,24、48 h后,用RIPA裂解液提取HT-29细胞总蛋白并用考马斯亮蓝法(Bradford法)测定蛋白浓度。每孔上样30 μg蛋白,用6%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离,电转移至硝酸纤维素膜。加入1∶300的cleaved-caspase-3一抗和细胞色素C(cytochrome C)一抗后4 ℃孵育过夜。加入辣根过氧化物酶标记的二抗(1∶1000)后室温孵育2 h。显色拍照。
1.3统计学处理采用SPSS 18.0软件进行统计学处理,计量资料采用单因素方差分析进行比较。P<0.05 为差异有统计学意义。
2结果
2.1MTT法检测结果OSI-027可抑制HT-29细胞的存活,且呈浓度和时间依赖性,见图1~2。
与对照组比较,*P<0.05
图1不同浓度OSI-027(处理72 h)对HT-29细胞
存活率的影响

与对照组比较,*P<0.05
图2OSI-027处理不同时间对HT-29细胞存活率的影响
2.2细胞集落形成实验结果OSI-027可抑制HT-29细胞的增殖,且呈浓度依赖性,见图3。
2.3台盼蓝染色检测结果OSI-027可诱导HT-29细胞的死亡,且呈浓度依赖性,见图4。
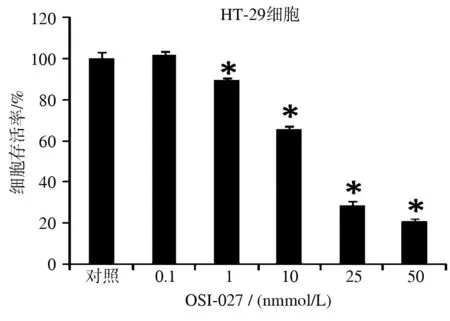
2.4流式细胞仪检测结果OSI-027可诱导HT-29细胞的凋亡,且呈浓度依赖性,见图5。
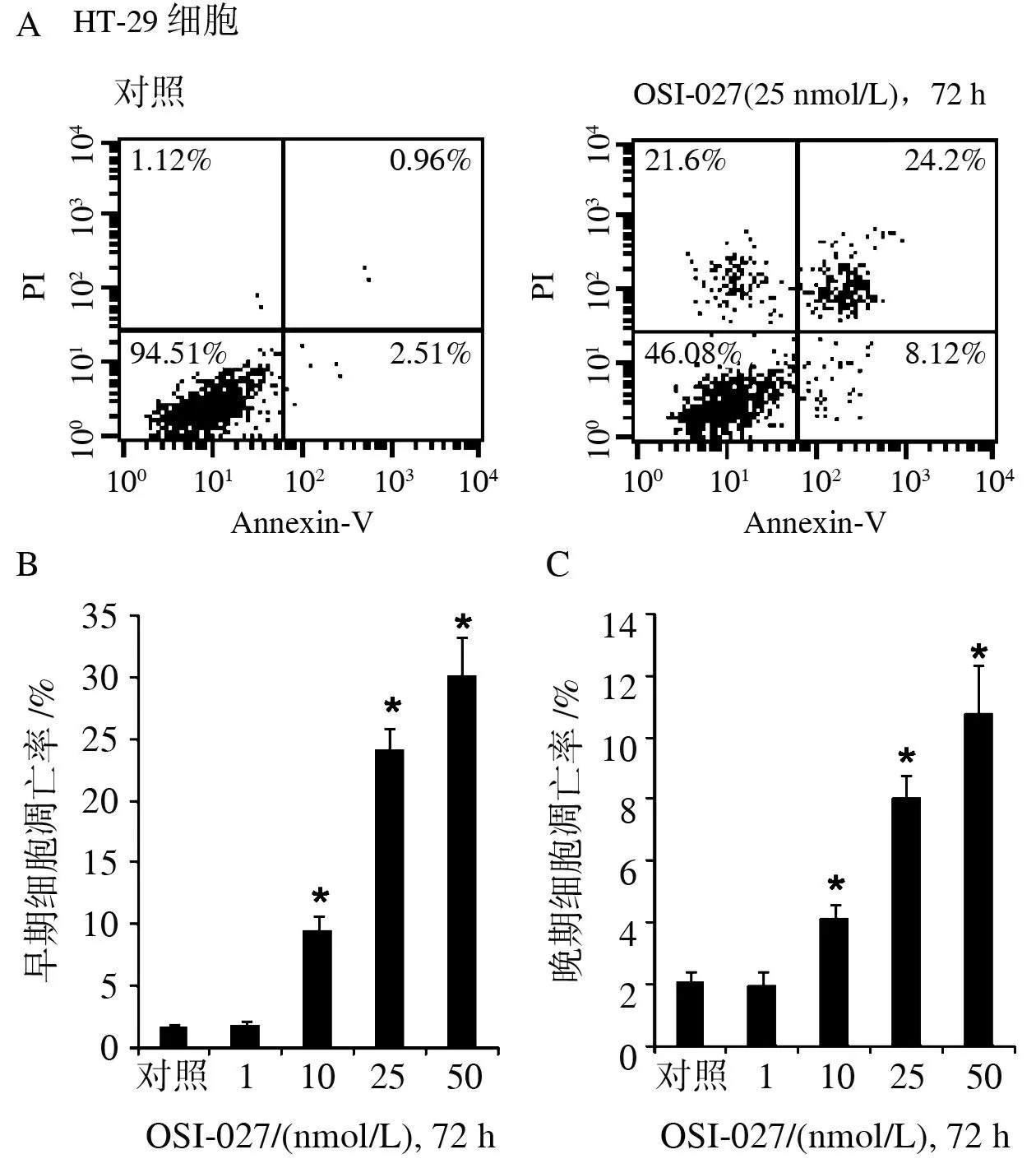
2.5Western blotting法检测结果OSI-027可诱导HT-29细胞凋亡相关蛋白的表达,且呈时间依赖性,见图6。

与对照组比较,*P<0.05
图3不同浓度OSI-027对HT-29细胞增殖率的影响

与对照组比较,*P<0.05
图4不同浓度OSI-027对HT-29细胞死亡率的影响
A:对照组与OSI-027组(药物组)记录细胞凋亡;B:药物组早期凋亡细胞;C:药物组晚期凋亡细胞;与对照组比较,*P<0.05
图5不同浓度OSI-027对HT-29细胞凋亡率的影响
与对照组比较,*P<0.05
图6OSI-027对HT-29细胞凋亡相关蛋白cleaved-caspase-3和cytochrome C表达的影响
3讨论
PI3K-Akt-mTOR信号通路中的mTOR信号分子参与调控能量代谢和细胞增殖;mTOR的2个直接底物,即p70S6K和4E-BP-1是蛋白质生物合成的关键因子[7]。mTOR的异常活化在肿瘤的发生、发展中有重要作用[7]。Ai等[8]研究发现,抑制mTOR能限制肿瘤细胞利用葡萄糖产生能量,阻止肿瘤细胞利用氨基酸合成新的蛋白质,从而抑制肿瘤的生长。最近有研究[9]发现,mTOR抑制剂(rapamycin)可明显减少淋巴瘤和白血病细胞的ATP生成,但Efeyan等[10]发现,通过活化胰岛素受体底物1(IRS-1)可负反馈活化存活通路Akt,抑制rapamycin及其类似物的疗效;而且,rapamycin及其类似物还可负反馈活化的Erk/MAPK通路,进一步限制其疗效[11]。而OSI-027是一种新近研发的mTOR抑制剂,能阻断2种mTOR复合物的活性,常被称为mTORC1/mTORC2双重抑制剂,具有阻滞肿瘤细胞的细胞周期以及诱导其分化和凋亡的能力[12],从而达到抗肿瘤的效果。
本研究结果显示,外源性添加的mTORC1/mTORC2双重抑制剂OSI-027可诱导结肠癌细胞HT-29的死亡,抑制HT-29细胞的存活和增殖,且其作用与药物浓度及作用时间相关。随着OSI-027浓度的增加及作用时间的增加,对HT-29的细胞毒作用也逐渐增加。OSI-027还同时诱导HT-29细胞凋亡,表现为Annexin V阳性细胞数目显著增加,细胞内cleaved-caspase-3和cytochrome C蛋白的表达水平增加。
OSI-027阻断HT-29细胞mTORC1和mTORC2的组装和活化的机制尚有待于进一步明确。
参考文献
[1]王肇炎.靶向抗肿瘤药物临床应用的成效困惑及对策[J].中华肿瘤杂志,2009,31(9):641-645.
[2]何友兼,董秋美,李宇红.结肠癌全身辅助化疗的进展[J].癌症,2005,24(12):1546-1549.
[3]Fruman DA,Rommel C.PI3K and cancer:lessons,challenges and opportunities[J].Nat Rev Drug Discov,2014,13(2):140-156.
[4]Liu P,Cheng H,Roberts TM,et al.Targeting the phosphoinositide 3-kinase pathway in cancer[J].Nat Rev Drug Discov,2009,8(8):627-644.
[5]Hennessy BT,Smith DL,Ram PT,et al.Exploiting the PI3K/AKT pathway for cancer drug discovery[J].Nat Rev Drug Discov,2005,4(12):988-1004.
[6]Zaytseva YY,Valentino JD,Gulhati P,et al.mTOR inhibitors in cancer therapy[J].Cancer Lett,2012,319(1):1-7.
[7]Majumder PK,Febbo PG,Bikoff R,et al.mTOR inhibition reverses Akt-dependent prostate intraepithelial neoplasia through regulation of apoptotic and HIF-1-dependent pathways[J].Nat Med,2004,10(6):594-601.
[8]Ai W,Bertram PG,Tsang CK,et al.Regulation of subtelomeric silencing during stress response[J].Mol Cell,2002,10(6):1295-1305.
[9]Bhagwat SV,Gokhale PC,Crew AP,et al.Preclinical characterization of OSI-027,a potent and selective inhibitor of mTORC1 and mTORC2:distinct from rapamycin[J].Mol Cancer Ther,2011,10(8):1394-1406.
[10]Efeyan A,Sabatini DM.mTOR and cancer:many loops in one pathway[J].Curr Opin Cell Biol,2010,22(2):169-176.
[11]Altomare DA,Testa JR.Perturbations of the AKT signaling pathway in human cancer[J].Oncogene,2005,24(50):7455-7464.
[12]Xu RH,Pelicano H,Zhang H,et al.Synergistic effect of targeting mTOR by rapamycin and depleting ATP by inhibition of glycolysis in lymphoma and leukemia cells[J].Leukemia,2005,19(12):2153-2158.
Inhibitory Effect of Novel mTORC1/mTORC2 Dual Inhibitor OSI-027 on Human Colon Cancer Cell Line HT-29 in Vitro
CHENGuopingCAODachunLIUHailin
DepartmentofGastroenterology,TheNinthPeople’sHospital,ShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai200011,China
AbstractObjective: To investigate the inhibitory effect of novel mTORC1/mTORC2 dual inhibitor OSI-027 on human colon cancer cell line HT-29 in vitro.Methods: HT-29 cells, cultured in vitro,were either treated with different concentrations of OSI-027(0.1,1,10,25 and 50 nmol/L),or treated with 25 nmol/L OSI-027 for 0,24,48,72,96 h,respectively. Methyl thiazolyl tetrazolium assay(MTT) and cell colony forming assay were used to detect the growth and proliferation of HT-29 cells after treatment with OSI-027. Flow cytometry(FACS) and trypan blue staining were used to detect the influence of OSI-027 on apoptosis and death of HT-29 cells. Western blotting was used to detect the expression of apoptosis-related proteins cleaved-caspase-3 and cytochrome C.Results: OSI-027 inhibited the survival of HT-29 cells, and the inhibition was concentration and time dependent. It also inhibited the proliferation of HT-29 cells, and the inhibition was concentration dependent. It also induced apoptosis and death, and the inducement was concentration dependent.Expression levels of apoptosis-related proteins cleaved-caspase-3 and cytochrome C increased after OSI-027 treatment. Conclusions: The novel mTORC1/mTORC2 dual inhibitor OSI-027 can inhibit the proliferation of human colon cancer cell HT-29 and induce cell apoptosis.
Key WordsColon cancer;OSI-027;Mammalian target of rapamycin;Apoptosis;Signal transduction
中图分类号R735.3
文献标识码A
通讯作者刘海林,E-mail:liuhailin@medmail.com.cn

