碳热还原氮化法制备氮化钒
储志强,郭学益,田庆华,张 立
碳热还原氮化法制备氮化钒
储志强1, 2,郭学益1,田庆华1,张 立3
(1. 中南大学冶金科学与工程学院,长沙 410083;2. 湖南省冶金材料研究院,长沙 410129;3. 中南大学粉末冶金研究院,长沙 410083)
以V2O5为原料,采用碳热还原法制备氮化钒,通过扫描电镜(SEM)和X射线衍射(XRD)观察与分析还原氮化产物的形貌与组成,分析产物的碳、氮、氧含量,研究原料配碳量、氮化温度和氮化时间等对还原氮化产物的影响。结果表明:还原氮化产物为碳氮化钒的固溶体。原料配碳量是影响反应产物中氮含量的关键因素,配碳比(质量分数)约为21%时还原氮化产物具有最高的氮含量14.76%;氮化温度应控制在1 400~1 420 ℃范围内,氮化时间达到4 h即可实现氮化完全。
五氧化二钒;氮化钒;碳热还原;氮化
氮化钒是一种优质的微合金化添加剂,其中的钒元素同钢中的碳和氮生成硬质的难熔金属碳化物和氮化物微细颗粒,这些化合物可细化钢的组织和晶粒,提高晶粒的细化温度,降低过热敏感性,并提高钢的韧性、强度和耐磨性[1−5]。
有关氮化钒的研究和制备,国内外的冶金工作者做了很多工作,目前美国、日本、德国、俄罗斯等在氮化钒的合成机理、工艺参数及生产设备等进行了卓有成效的研究[6−9],美国战略矿物公司下属的南非Vametco矿物公司为全球最大的氮化钒生产供应商[4]。氮化钒的制备可用钒的氧化物以及钒酸氨、多钒酸铵为原料,以碳、氢气、氨气、一氧化碳等为还原剂,在高温或真空下进行还原,之后再通入氮气或氨气进行氮化[10−12]。根据制备体系和生产设备的不同,氮化钒的制备方法可分为高温真空法和高温非真空法两大类[13]。我国对氮化钒的研发起步较晚,但近年来随着氮化钒在钢铁、化工、能源等行业的广泛应用,氮化钒制备的基础理论与生产技术取得了较快的发展。东北大学、北京科技大学、四川大学等对氮化钒的制备过程的热力学与动力学机理及制备工艺展开了研究[14−17],攀枝花钢铁公司开发了推板窑法制备技术[18],唐山钢铁公司与长沙隆泰科技有限公司合作开发了的微波加热制备技术[19−21]。
目前氮化钒制备过程的关键核心技术被美国、日本等国垄断,对氮化钒制备的设备与制备工艺严格保密。与国外相比,国内厂家的技术装备、生产成本,特别是产品性能均具有较大的差距。本文作者提出一种高温真空碳热还原技术制备氮化钒,对氮化钒制备过程的作用机理以及主要工艺参数进行研究,对我国氮化钒产业的发展具有指导意义。
1 理论分析
1.1 反应过程热力学分析
V2O5的还原和氮化过程可简化为:V2O5→ VO2→V2O3→VC→VN[22],钒的氧化物从高价位到低价位依次是V2O5,V2O4,V2O3,VO,根据其氧势的高低,V2O5的还原为逐级分步还原,依次为,生成的VC在氮气作用下最终生成VN[14]。
V2O5→VC的转化过程存在2种方式:第1种方式以C经Boudourd反应产生的CO气体作还原剂,通过气−固反应还原钒氧化物生成VC;第2种方式是C作为还原剂,通过固-固反应的模式直接与钒氧化物反应生成VC[17]。
由热力学计算与分析可知[17],在一定温度和氮气气氛下,碳还原五氧化二钒制备氮化钒在热力学上是可行的,还原过程存在间接还原和直接还原2种方式,何种方式占主导地位取决于V2O5和C的初始混合态。为了减少钒的挥化损失,应在五氧化二钒的熔点下进行一级还原反应,同时为了避免生成的氮化钒重新转变为碳化钒,反应温度应控制在1 546 K以下。
1.2 反应过程动力学分析
碳还原五氧化二钒制备氮气钒的反应过程动力学速率方程可通过氮气条件下氮化钒的TG/DTA曲线以及DTG曲线确定。TG/ DTG/DTA曲线显示氧化钒的碳热氮化还原过程是多个反应并存的复合反应过程,存在2个明显的质量损失阶段和3个不同的吸热反应峰,说明有不同类型的化学反应发生,并且前一个吸热峰未结束,后一吸热峰即开始,表明不同的反应交错在一起同时进行[16]。
根据TG/DTA曲线以及DTG曲线,氧化钒的碳热还原氮化复合反应可分为2个阶段,即低温反应阶段和高温反应阶段。低温反应阶段的活化能较低,反应容易进行,反应机理为一级化学反应;高温反应阶段的活化能很高,是整个反应的控制环节,反应机理为二级化学反应[16]。
氧化钒的碳热还原氮化反应体系符合反应控制机制(Rn模型),氮气气氛有利于反应的进行,升高温度可加快反应进行的速率。实际生产过程应尽可能将V2O5还原为VC,再调节温度和氮气分压制取VN或V(C,N)。但必须指出的是过高的反应+温度反而会导致发生氮化钒转变为碳化钒的反应,因此,反应过程的实际温度应控制在1 450 K以下。
2 实验
2.1 氮化钒的制备
采用真空碳热还原法制备碳化钒,再直接渗氮制取氮化钒。钒源为工业用V2O5粉末,纯度为99%;以冶金用高纯炭黑作为碳源,纯度大于99%;氮源为高纯氮气。
在V2O5粉末中加入炭黑,配碳量(质量分数)分别为20.0%、20.5%、21.0%、21.5%、22.0%和22.5%,同时加入适量聚乙烯醇水溶液,利用行星球磨机混合均匀。混合料通过液压压片机和钢制模具压制成直径为45 mm、厚度20 mm的球饼样品。将压坯置入真空炉内,抽真空至20 MPa,150 ℃下保温4 h烘干。然后以40 ℃/min 速率升温至还原温度1 400~1 420 ℃,保温约4~6 h。升温过程中通入高纯氮气进行氮化,因氮化过程中氮气参与氮化反应而不断消耗,故需通过氮气阀门控制氮气的加入量,并保证真空炉内压力在260 kPa左右。氮化反应完毕后真空炉停止加热,继续通入氮气,同时调节真空炉的出气口,维持真空炉内微正压,在氮气气氛的保护下冷却到室温,得到氮化钒产品。
2.2 性能检测
采用D-5000全自动X射线衍射仪测定所得氮化钒的物相组成;通过JSM-6360LV扫描电镜观察氮化钒颗粒形貌;用JZ-1型密度测量仪测定氮化钒的表观密度;利用化学滴定法分析氮化钒的钒含量;用TC-436氧氮仪测定氮化钒的氮含量;用CS-444碳 硫测定仪测定氮化钒的碳含量;采用SETSYS EVOLUTION综合热分析仪对氮化钒进行热重分析。
3 结果与讨论
3.1 热质量分析
图1和图2所示分别为氮化钒在氮气和氩气条件下的质量损失曲线和质量损失速率曲线。从图1和图2可看出,温度低于1 160 K时,不同气氛下的曲线重合性很好,这时氮气和氩气所起的作用完全一样,只充当保护气体;通过调节真空炉的出气口阀门,降低真空炉内CO分压,可促进V2O5的逐步还原。温度高于1 560 K时,由于VN转化为VC而释放出N2产生新的质量损失,因此在实际制备VN过程中,当氮气压力为101 kPa时,氮化温度不能超过1 560 K(和理论分析的1 546 K接近),否则VN转变为VC。最初发生质量损失的温度(656K)为一级还原开始温度,这表明在低于V2O5的熔点温度下V2O5就发生了还原反应。

图1 氮气钒在氮气和氩气气氛下的质量损失曲线
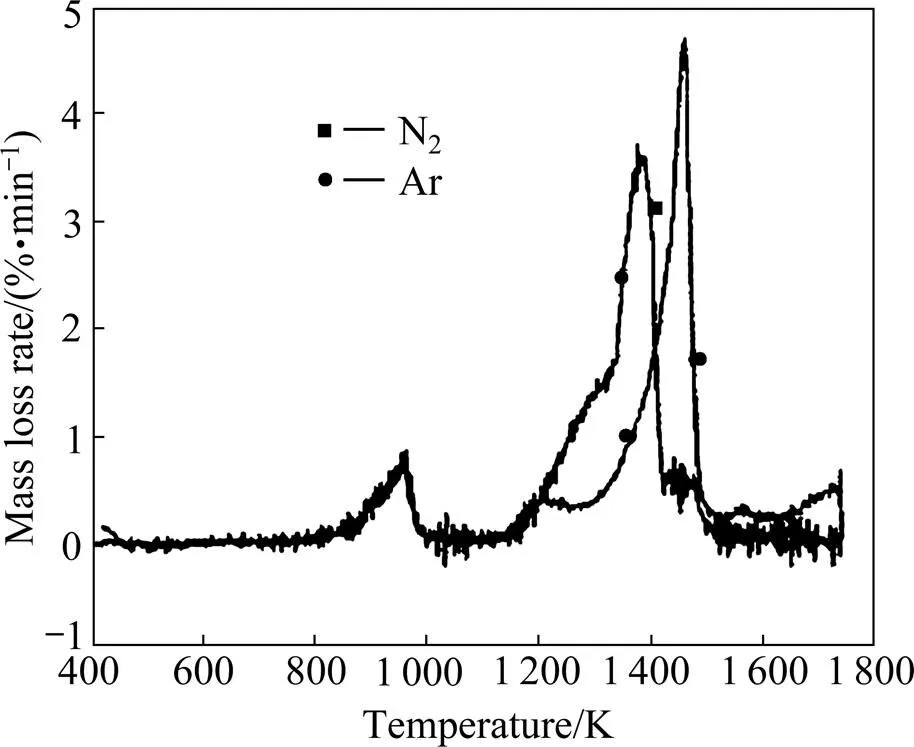
图2 氮气钒在氮气和氩气气氛下的质量损失速率曲线
3.2 物相分析
图3所示为氮化钒产品的XRD谱。由图可见V2O5的还原氮化产物的XRD谱与纯VN和VC的标准图谱相吻合,因此确定产物为碳氮化钒的固溶体。制备过程工艺参数不同,产品的氮含量在一定范围内发生 变化。
3.3 配碳量
图4和图5所示为配碳量对产物中碳、氧含量以及氮含量的影响。在氮化钒的制备过程中,配碳比是还原氮化产物中碳、氧和氮含量的主要影响因素,配碳量太少,还原不充分,产品的氧含量高,导致氮含量低;但配碳比过高时,碳还原反应过程中产生CO气体,CO气体溢出时导致颗粒内部产生许多气孔,气孔的数量与大小也影响氮化反应的进行。从图5可看出,随配碳比增加,产物的氮含量增加,当配碳比为21%时,产物的氮含量达到最大值14.76%,配碳比进一步提高时,产物中的氮含量下降。这是因为VN、VC和VO形成固溶体,而VN、VC和VO均为面心立方间隙型化合物,N、C和O在面心立方点阵中占用同样的位置[6],只有当C和O总含量最小时,还原氮化产物才可能得到最大的N含量。综合图4和图5,为了保证还原氮化产物具有最高的氮含量,原料的质量配碳比约为21%。
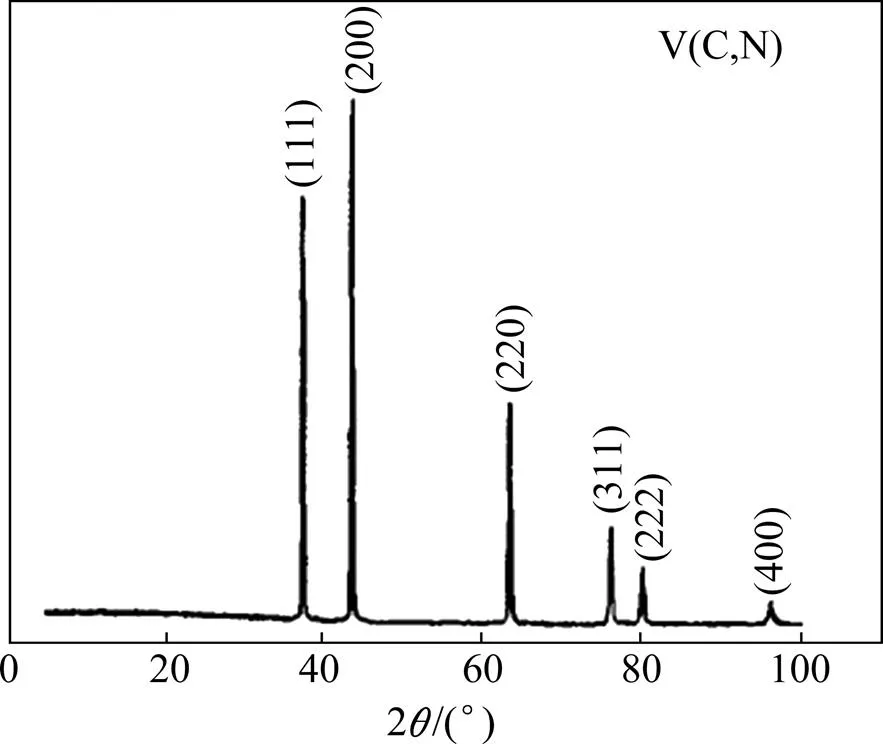
图3 氮化钒产品的XRD谱

图4 原料配碳量对产品中碳和氧含量的影响

图5 配碳量对产品中氮含量的影响
3.4 氮化温度
图6所示为氮化温度对产物氮含量的影响(配碳量为21.0%)。从反应过程热力学角度看,提高反应温度对吸热反应有利,对放热反应不利。三氧化二钒的还原过程是一个吸热过程,必须高于一定的温度反应才可发生,但中间产物VC的氮化系放热反应,提高温度对反应不利,因此氮化钒的制备需选择适宜的温度。从反应过程动力学角度看,无论是吸热反应还是放热反应,提高温度都有利于活化反应物的分子,加快反应的进行。从图6可看出,随温度升高,产物的氮含量增加,氮化温度达到1 420 ℃时,氮含量为14.76%,原因是升高温度使还原反应速率加快。当温度超过1 420 ℃时,随温度升高,产物中氮含量反而降低,这是因为高温下生成的VN发生以下反应:VN+C=VC+1/2 N2。因此控制适宜的氮化反应温度是提高产物氮含量的关键之一。实际生产过程中氮化温度应控制在1 400~1 420 ℃范围内。
3.5 氮化时间
图7所示为在氮化温度1 420 ℃下,氮化时间对产物中氮含量的影响。从图可知,当氮化反应时间小于4 h时,氮化时间对氮含量的影响很大,随氮化时间增加,产物氮含量增加,因为反应时间过短,氮化反应进行不彻底。当氮化反应时间超过4 h后,氮化时间对产物氮含量影响不明显,产物氮含量几乎不再发生变化,说明氮化时间达到4 h即可实现氮化完全。
3.6 产品性能
图8所示为氮化钒的SEM形貌及实物照片,其中图8(a),(b)分别为本研究制备的2个批次氮化钒样品的SEM形貌。批次1的制备条件:配碳量21%,氮化温度1 420 ℃,氮化时间4 h;批次2的制备条件:配碳量20%,氮化温度1 400 ℃,氮化时间4 h;图8(c)为代表国外氮化钒质量最高水平的美国战略矿物公司同类产品的SEM形貌[ 4],图8(d)为采用本方法制备的氮化钒产品实物照片,表1所列为本研究制备的氮化钒样品与美国战略矿物公司同类产品的性能对比。由表1可知:本研究制备的氮化钒性能指标已达到国外同类产品水平,部分性能超过国外同类产品。

图6 氮化温度对产品氮含量的影响

图7 氮化时间对产品氮含量的影响

图8 氮化钒的SEM形貌及实物照片

表1 氮化钒的性能对比
4 结论
1) 以V2O5为原料,采用碳热还原氮化法制备氮化钒,产品的氮含量随氮化温度升高而增加,当氮化温度超过1 420 ℃时, VN发生分解反应,导致产物的氮含量下降。制备过程中氮化温度应控制在1 400~ 1 420 ℃范围内。
2) 还原氮化产物为碳氮化钒的固溶体,原料配碳量是影响反应产物中氮含量的关键因素,配碳量约为21%时产物的含氮量最高,为14.76%。
3) 产品的氮含量随氮化时间延长而增加,氮化反应时间超过4 h后,氮化时间对产物氮含量影响不明显,产物已实现完全氮化。
REFERENCES
[1] 翁庆强. 目前国内氮化钒生产情况浅析[J]. 四川冶金, 2015, 37(2): 1−4. WENG Qing-qiang. The current domestic production of vanadium nitride analysis [J]. Sichuan Metallurgy, 2015, 37(2): 1−4.
[2] 孙凌云, 柯晓涛, 蒋业华. 钒氮合金的应用及展望[J]. 四川冶金, 2005(27): 12−17. SUN Ling-yun, KE Xiao-tao, JJIANG Ye-hua. Application and prospects of VN alloy [J]. Sichuan Metallurgy, 2005, 27(4): 12−17.
[3] 完卫国, 王 莹, 吴结才. 钒氮微合金化技术的研究与应用综述[J]. 江西冶金, 2004, 24(5): 26−30. WANG Wei-guo, WAN Ying, WU Jie-cai. The review of researches and application of V-N microalloying technogy [J]. Jiangxi Metallurgy, 2005(27): 12−17.
[4] 王 斌, 朱 军, 杜金晶. 钒基铁合金的应用及研究近况[J]. 铁合金, 2015(7): 12−15. WANG Bin, ZHU Jun, DU Jin-jing. Application and recent research of vanadium-based ferroalloys [J]. Ferro-alloys, 2015(7): 12−15.
[5] 冯远莉, 刘战英, 陈春生, 等. VN合金在大规格角钢生产中的应用[J]. 钢铁钒钛, 2004, 25(2): 40−43. FENG Yuan-li, LIU Zhan-ying, CHEN Chun-sheng, et al. Application of VN alloy in production of large size angle steel [J]. Iron Steel Vanadium Titanium, 2004, 25(2): 40−43.
[6] IVASHCHENKO V I, ATURHCI P E. Phonon softeningand the phase transition in VN [J]. Phys Rev B, 2008, 78(22): 224113− 1−224113−8.
[7] GAJBHIYE N S. NJINGTHOUJAM R S. Low temperature synthesis, crystal structure and thermal stability studies nanocrystalline VN particles [J]. Materials Research Bulletin, 2006, 41(9): 1612−1621.
[8] WIKLUND U, CESAS B, STAVED N. Evaporated vanadiumnitride friction material in dry sliding against stainlesssteel [J]. Wear, 2006, 261: 2−8.
[9] TRIPATHY P K, ARGA A, BOSE D K. Preparation of vanadium carbonitride and its subsequent metallization by thermal decomposition [J]. Journal of Alloys and Compounds, 1994, 209(1/2): 175−180.
[10] 王乖宁. V2O3制取氮化钒铁的技术研究[J]. 铁合金, 2014(6): 21−24. WANG Guai-ning. Research of the synthesis of nitrided ferrovanadium [J]. Ferro Alloys, 2014(6): 21−24.
[11] 薜正良, 陈志超, 王 炜, 等. 碳热还原氮化一步法制备钒氮合金工艺研究[J]. 武汉科技大学学报, 2012, 35(3): 161−163. XUE Zheng-liang, CHEN Zhi-chao, WANG Wei, et al. One-step method of carbon thermal reduction and nitridation to produce vanadium nitrogen alloy [J]. Journal of Wuhan University of Science and Technology, 2012, 35(3): 161−163.
[12] 解万里, 陈东辉, 高明磊. 用三氧化二钒制取氮化钒试验研究[J]. 河北冶金, 2012(3): 29−31. XIE Wan-li, CHEN Dong-hui, GAO Ming-lei. Trial research to make vanadium with V2O3[J]. Hebei Metallurgy, 2012(3): 29−31.
[13] 黄中省, 陈为亮, 伍贺东, 等. 氮化钒的研究进展[J]. 铁合金, 2008(3): 20−24. HUANG Zhong-sheng, CHEN Wei-liang, WU He-dong, et al. Development on researching vanadium nitride [J]. Ferro-alloys, 2008(3): 20−24.
[14] 董 江, 薜正良, 余 岳. V2O5还原氮化一步法合成氮化钒[J]. 太原理工大学学报, 2014, 45(2): 168−171. DONG Jiang, XUE Zheng-liang, YU Yue. Synthesis of vanadium nitride with reduction and nitridation by one-step method from V2O5[J]. Journal of Taiyuan University of Techaotogy, 2014, 45(2): 168−171.
[15] 罗利霞, 王 永. 氮化钒热力学性质的第一性原理计算[J]. 四川大学学报(自然科学报), 2015, 52(2): 353−357. LUO Li-xia, WANG Yong. First-principles study of thermodynamic properties of vanadium nitride [J]. Journal of Sichuan Uiversity: Natural Science Edition, 2015, 52(2): 353−357.
[16] 于三三, 付念新, 高 峰, 等. 一步法合成氮化钒的动力学研究[J]. 稀有金属, 2008, 32(1): 84−87. YU San-san, FU Nian-xin, GAO Feng, et al. Chemical kinetics of synthesizing vanadium carbonitride by one step method [J]. Chinese Journal of Rare Metals, 2008, 32(1): 84−87.
[17] 方民宪, 陈厚生. 碳热还原法制取VC、VN和V(C,N)的热力学原理研究[J]. 矿冶, 2007, 16(3): 46−51. FANG Min-xian, CHEN Hou-sheng. Study on thermodynemic principle of preparation of VC, VN and V(C,N) by carbon-heat reducing [J]. Mining&Metallurgy, 2007, 16(3): 46−51.
[18] 孙朝晖, 周家琮, 杨仰军. 攀钢氮化钒技术的发展及市场前景[J]. 钢铁钒钛, 2001, 22(4): 57−60. SUN Zhao-hui, ZHOU Jia-cong, YANG Yang-juan. Technical development and market prospect for vanadium nitride at pangang [J]. Iron Steel Vanadium Titanium, 2001, 22(4): 57−60.
[19] 丁 喻, 周继承, 傅惠华. 大型工业微波炉在氮化钒试生产中的应用[J]. 钢铁钒钛, 2008, 29(4): 18−21. DING Yu, ZHOU Ji-cheng, FU Hui-hua. Application of the targe Industrial microwave oven in pre-production of vanadium nitride product [J]. Iron Steel Vanadium Titanium, 2008, 29(4): 18−21.
[20] 潘惠娟, 张泽彪, 彭金辉, 等. 微波辅助加热还原法制备氮化钒[J]. 有色金属: 冶炼部分, 2011(10): 40−42. PAN Hui-juan, ZHANG Ze-biao, PENG Jin-hui, et al. Preparation Technology of high density vanadium nitride in microwave field [J]. Nonferrous Metal: Extractive Metallurgy, 2011(10): 40−42.
[21] 王 维, 陈白珍, 肖文丁, 等. 微波加热制备氮化钒工艺[J]. 稀有金属材料与工程, 2010, 39(5): 924−927. WANG Wei, CHEN Bai-zhen, XIAO Wen-ding, et al. Preparation techaology of vanadium nitride by microwave heating [J]. Rare Metal Materials and Engineering, 2010, 39(5): 924−927.
[22] 唐仁政, 田荣璋. 二元合金相图及中间相晶体结构[M]. 长沙: 中南大学出版社, 2009: 910. TANG Ren-zheng, TIAN Rong-zhang. Binary Alloy Phase Diagrams and Crystal Structure of Intermediate Phase [M]. Changsha: Central-Suoth Uiversity Press, 2009: 910.
(编辑 汤金芝)
Preparation of vanadium nitride by carbothermic reduction and nitrogenization
CHU Zhi-qiang1, 2, GUO Xue-yi1, TIAN Qing-hua1, ZHANG Li3
(1. School of Metallurgy Science and Engineering, Central Suoth University, Changsha 410083, China; 2. Hunan Research Institute of Metallurgy and Materials, Changsha 410014, China;3. Institute of Powder Metallurgy, Central Suoth University, Changsha 410083, China)
Vanadium nitride was prepared by carbon thermal reduction method using V2O5as raw material. The morphology and composition of the reduction products were observed and analyzed by SEM and XRD. The contents of carbon, nitrogen and oxygen of the product were tested, and the effects of raw materials parameters, such as carbon content, temperature and time on the reduction of the product were also studied. The results show that the reduction product is a solid solution of carbon and nitride. The carbon content of raw material is the key factor to affect the content of nitrogen in the reaction products, and nitrogen content in the product has the highest value of 14.76% when the mass fraction of carbon in raw materials is about 21%; the nitriding temperature should be controlled in the range of 1 400~ 1 420 ℃, and the nitriding time can be reached by 4 h.
V2O5; VN; carbothermic reduction; nitrogenization
TF123
A
1673-0224(2015)6-965-06
湖南省科技厅工业科技计划重点项目(06GK3121)
2015-05-13;
2015-09-23
储志强,高级工程师。电话:13908451179;E-mail: cz9680@163.com

