蓝花楹茎腐病——病原与系统发育1)
朱涵明月 李西 朱天辉
(四川农业大学,成都,611130)
责任编辑:程 红。
蓝花楹(Jacaranda acutifolia Humb.et Bonpl.)隶属于双子叶植物纲(Magnoliopsida)、唇形目(Lamiales)、紫葳科(Bignoniaceae)、蓝花楹属(Jacaranda),别名含羞草叶蓝花楹、尖叶蓝花楹、蓝雾树[1-2]。由于蓝花楹树形酷似凤凰木,属稀有的蓝紫色系和冷色系高大乔木,春末秋初开花之时叶落尽,蓝紫色硕大的花朵锦簇缀满枝头蔚为壮观,因而被定义为一种极具开发前景的园林观赏植物[3-4]。蓝花楹起源于阿根廷、玻利维亚、巴西等地区,近些年在我国的海南、福建、广西、广东、云南、四川等地均有引种和栽培[5]。目前,国内外对蓝花楹的研究主要集中在组织培养与快速繁殖[6]、花器官特征观察[7]、生态学特性研究[8]及种子萌发与幼苗生长营养物质[9]等方面,而对于蓝花楹病害的报道仍处于空白。2014年3月,笔者于四川省西昌市蓝花楹栽培区内首次发现1种为害蓝花楹寄主植株茎干基部的新病害——蓝花楹茎腐病。侵染部位发生在根茎处,茎部皮层组织及木质部的腐烂可导致整株植株的死亡,严重威胁着该物种的经济效益和观赏价值。为此,笔者通过固定标准地连续定点观察并对发病植株病原菌进行分离和致病性测定,结合形态学及rDNA-ITS序列分析确定其病原菌种类、研究其系统发育,以期为蓝花楹茎腐病的有效防治奠定理论基础,同时为蓝花楹新病害的研究提供参考。
1 材料与方法
1.1 蓝花楹茎腐病病害调查
自2014年3月中旬起,在固定样方内,采用随机抽样的方法,分别对四川省西昌市3个蓝花楹栽培园区内的3~5年生蓝花楹茎腐病病害为害症状、感病指数进行调查、记录,每栽培园区内随机选取30株。根据实际感病情况,将栽培园区内蓝花楹发生茎腐病的病害程度分为5级:0级,植株生长健康,茎干生长正常,茎干及根部均未变色;Ⅰ级,茎干主体生长正常,基部部分发生变色,变色面积为0~25%;Ⅱ级,茎干轻微变色,但仍正常生长,茎干基部变色面积为>25%~50%;Ⅲ级,茎干基部变色明显,变色面积为>50%~75%;Ⅳ级,茎干基部几乎全部变色,茎基部皮层组织出现变软、开裂现象,变色面积为>75%~100%;V级,茎干基部全部变色,面积达到100%,根部腐烂,植株枯萎,死亡。根据感病指数公式计算园区内蓝花楹茎腐病病害发生情况的感病指数。
感病指数=(∑(病级株数×相对应代表数值)/(株数总和×发病最重的代表数值))×100。
1.2 病样采集及病原菌分离、纯化、培养
随机选取蓝花楹栽培园区内不同发病程度的茎腐病植株10株。每株截取茎干基部距离土层10~50 cm处圆柱体枝干,装入无菌袋内带回实验室,于冰箱内4℃保存,等待病原菌的分离、培养试验。用已灭菌镊子和无菌棉签擦除枝干表面杂物,然后采用病原菌常规组织分离法进行蓝花楹茎腐病病原菌的分离,单孢纯化,具体参照韩永超等[10]的方法。对初步分离得到的菌株按照形态学特性进行粗略归类,编号,纯化培养。
1.3 病原菌致病性测定
将分离得到的具有显著优势的菌株单独接种到已配制好的马铃薯琼脂(PDA)培养基上,培养48 h后用无菌水洗下。结合冷怀琼等[11]确定的产孢条件,在25℃、pH=7、黑暗与光照交替处理条件下连续培养5~7 d,收集分生孢子,用无菌水稀释成3×104菌落·mL-1,制成病原菌孢子悬浮液。取孢悬液100 mL,采用刺伤枝干法,均匀的涂抹于室内盆栽2年生蓝花楹刺伤茎干基部(75%酒精表面消毒,无菌水冲洗3~5次),同时以只涂抹无菌水植株作为空白对照,每试验3组重复。15 d后观察茎干基部感病情况,与自然发病茎干比较后,对感病植株茎基部再次进行病原菌的分离,并与1.2分离得到的优势菌株进行形态学比较分析。
1.4 病原菌鉴定
1.4.1 形态学鉴定
将致病性检测筛选出的优势菌株接种到PDA培养基上,25℃、pH=7,黑暗与光照交替处理条件下连续培养5~7 d后观察菌落培养性状,并参照李婕等的方法[12]进行病原菌的肉眼及显微形态学观察。根据病菌生长速度、菌落形态特征和产孢特性查阅真菌分类鉴定手册,确定病原菌种类。
1.4.2 分子生物学鉴定床震荡
DN培A养的 的提 方取 法:优,具势菌体株参菌照丝王的风提芹取等采[13]用的液方体法摇,略有改动。分别接种菌株于PDA培养基上,室温下连续培养5 d后,取菌落边缘菌丝少许,转接于瓶装量℃为、pH 40= m7,L1的2 5 P r·DB mi液n-体1条培件养下锥震形荡瓶培(1养0 05 m~L7) d中。,将2 5无菌水冲洗、纱布过滤后收集到的菌丝置于-20℃条件下保存、备用。基因组DNA的提取主要参照天根植物基因组DNA提取试剂盒的操作步骤,具体可参照韩振云等的方法[14]。
PCR扩增:rDNA片段的扩增引物选择由上海生工技术公司合成的真菌通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')。反应扩增体系(20μL)包括,基因组DNA(1.0μL),10×PCR buffer(2.0μL),dNTP(0.25 mmol·L-1,1.0μL),r Taq(5 U·uL-1,0.2 μL),Primer1(1μmol·L-1,0.5μL),Primer2(1μmol·L-1,0.5μL),ddH2O(14.8μL)。反应程序为96℃预变性5min;进入循环,94℃变性30 s,52℃退火30s,72℃延伸1 min,30个循环;72℃延伸10 min。4℃保存。PCR产物的检测在1.5%琼脂糖凝胶电泳上进行。
产物的回收、克隆、测序:参照林剑伟等[15]的试验,利用回收试剂盒对目标基因片段进行切胶、回收、纯化。将回收得到的DNA通过与T载体(pMD18-T)的连接后转入到感受态大肠杆菌内,最后选取阳性克隆产物送至深圳华大生物公司进行测序。
1.4.3 病原菌基于ITS序列的系统发育分析
根据生物公司发回的片段序列,登陆NCBI进行Blast比对,从GeneBank中下载同源性较高菌株的rDNA-ITS序列,利用MEGA 5.0建立病原菌菌株系统发育树,进行基于rDNA-ITS的序列分析。
1.5 数据处理
利用Microsoft Excel和SPSS18.0进行ANOVA分析。
2 结果与分析
2.1 蓝花楹茎腐病病害症状及危害程度
调查结果显示,蓝花楹茎腐病主要为害3~5年生蓝花楹幼年植株,幼林群体发病率占全部感病植株的80%,为总调查数量的30%;春季3—4月份为蓝花楹茎腐病的发病初期,5—7月份进入发病盛行期,受到病原菌侵染的植株初期枝干茎基部呈灰褐色,继而转化为深褐色,同时植株叶片出现变黄、干枯、脱落的现象;随着感病程度的增加,严重受害部位会有褐色液体流出,茎基部皮层组织出现变软、开裂、甚至腐烂等症状;病害由茎干基部顺势向下纵向蔓延,甚至可扩展至蓝花楹根部,导致根部皮层组织及木质部的腐烂,从而使得整株植株死亡(图1)。
结合蓝花楹茎腐病病害分级标准,调查结果表明,5个病害等级均有不同程度的发生(表1),其中以1、2等级发生较为普遍,3、4、5等级较少,虽然健康植株所占比例较高,达到44.44%,但各等级感病指数总计达到25.32%。由此可知,该栽培园区内蓝花楹茎腐病的发生较为严重,且发病程度与蓝花楹的龄级结构有关。

图1 蓝花楹茎腐病症状
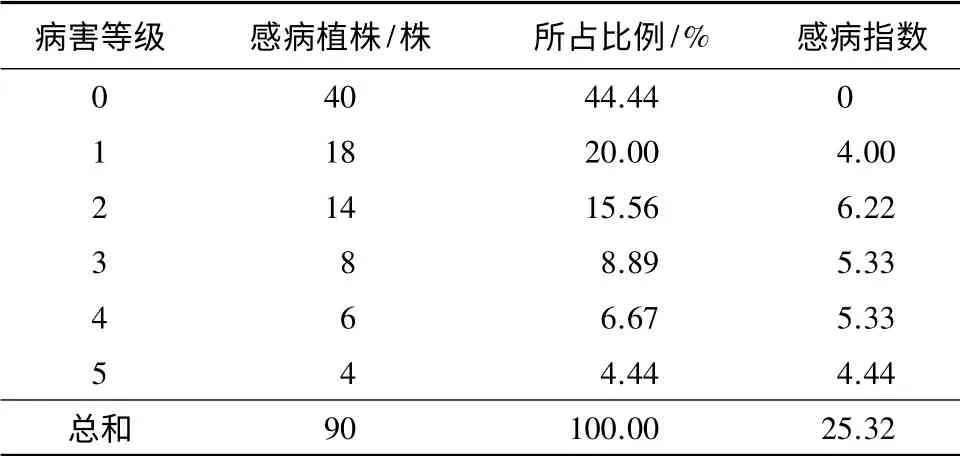
表1 蓝花楹茎腐病侵染指数
2.2 优势病原菌种群
从野外采集的发病茎干基部共取面积1 cm×1 cm的分离组织样品100块,通过常规组织分离和PDA平板培养法分离、培养得到真菌48株,其中优势菌群有两类共39株,占分离菌株总数的81.25%,其余杂菌仅占18.75%。两类优势菌群形态学差异显著,但均具有典型镰刀菌属真菌的菌落特征,分别编号为A1、B1。A1类群培养7 d后菌落呈现红紫色,B1菌落则近白色。从杂菌中筛选出6株形态学有明显差异的菌株纯化培养后,分别编号为C1、D1、E1、F1、G1、H1。蓝花楹茎腐病病原菌的分离过程中未见细菌、放线菌及其他霉菌菌落。
2.3 优势菌致病性
利用2.2中纯化得到的8种菌株的孢子悬浮液进行致病性测定。结果表明:仅A1和B1菌株在刺伤接种条件下能够使蓝花楹2年生盆栽幼苗茎干基部感病,且二者分别接种15 d后植株茎干基部均出现灰褐色至褐色不同程度病斑,茎干皮层组织变软、少量部分甚至表现出腐烂症状,与野外调查时蓝花楹茎腐病的病症完全一致;而其余6种菌株均不能影响蓝花楹幼苗的生长,说明这6株杂菌不是蓝花楹茎腐病的致病菌。此外,将A1与B1同时利用刺伤接种法接种于健康蓝花楹幼苗茎干,15 d后发现被接种的蓝花楹茎干基部均出现不同程度的变色、开裂、变软、流出褐色液体现象,甚至部分植株根部出现严重腐烂的症状。分别对单独接种A1、B1的感病植株和同时接种A1、B1的发病组织进行再分离试验得到与原接种菌株形态一致的分离菌株,从而证明A1与B1均是蓝花楹茎腐病的病原菌,且二者共同作用下致病性更强。
2.4 病原菌形态学特性
将拟确定的病原菌A1、B1接种到含PDA的平板上,25℃、pH=7条件下培养5~7 d后,观察到A1菌落初期菌丝浓密乳白色,后随着培养时间的增加逐渐变为粉白色、浅粉色、肉色,最后略带紫色(图2A-B)。菌落圆形,气生菌丝高3~5 mm,显微镜下观察,可看到无色镰刀形大型分生孢子,两端稍尖,中间略弯曲(图2C),基部细胞花柄状,小分生孢子,倒卵形,一般无隔;B1菌落中央形成明显凸起状,菌落表面呈白色,密生气生菌丝棉絮状,菌落背面黄绿色(图2D-E),在显微镜下可观察到镰刀形大型、有隔(一般为3~5个)分生孢子,菌丝顶端或菌丝中间生长出球形厚垣孢子(图2F-G),培养初期菌丝为白色,后期菌落背面产生黄色色素,产生大小两类分生孢子,分别呈卵圆形(0~1个隔)和马特型(多为3个分隔,微弯曲)。结合真菌形态学分类鉴定手册初步判断A1和B1分别为尖孢镰刀菌(Fusarium oxysporum)和厚垣镰刀菌(Fusarium chlamydosporum)。

图2 A1、B1菌落、分生孢子及菌丝显微形态
2.5 病原菌分子生物学
在依据形态学鉴定的基础上,利用真菌通用引物ITS1和ITS4分别对A1、B1菌株进行基于rDNAITS序列的分子生物学鉴定。在1.5%琼脂糖凝胶电泳检测下,得到2条清晰的500 bp大小的基因片段(图3),且该片段无拖尾现象,表明DNA纯度较高,未被污染,可满足后续测序要求。
利用回收试剂盒对目标基因片段进行切胶、回收、纯化,再将回收得到的A1、B1的DNA分别与T载体(pMD18-T)连接,转入到感受态大肠杆菌内,均得到白色菌落。挑取白色菌斑克隆,PCR扩增,检测到多个蓝色斑点,即克隆成功且均包含目的基因片段(图4)。
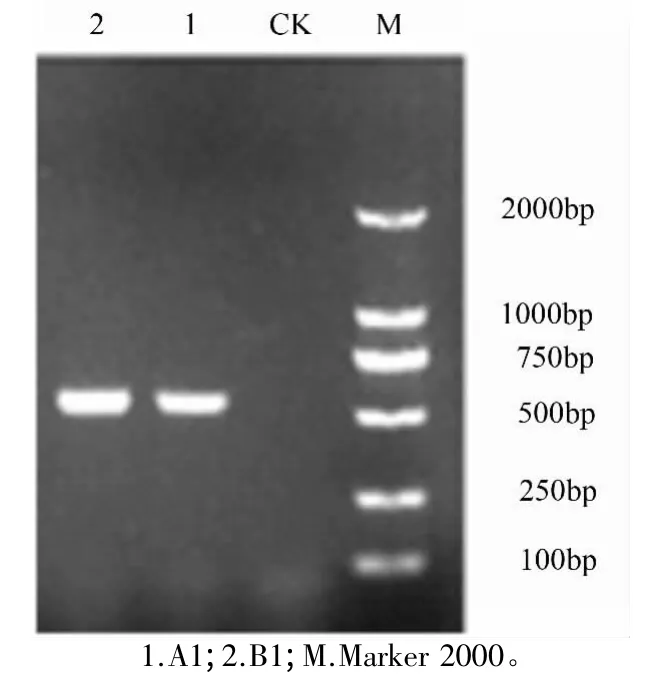
图3 尖孢镰刀菌和厚垣镰刀菌电泳结果
选取阳性克隆成功的菌株经深圳华大生物公司测序分别得到A1、B1两条大小为516、523 bp的序列。根据生物公司发回的片段序列,分别与上传至 NCBI的序列进行基于ITS序列的同源性分析。
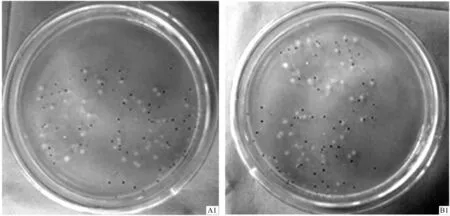
图4 A1、B1菌株克隆产物
2.6 病原菌系统发育分析
对A1、B1菌株进行同源性ITS序列的Blast比对,发现菌株A1、B1分别与F.oxysporum和F.chlamydosporum菌株同源性达到99%,其代表性同源性较高序列登录号分别是JF807396.1和EU653293.1,因此判断A1、B1菌株分别为F.oxysporum和F.chlamydosporum。从GeneBank中下载同源性较高菌株的rDNA-ITS序列,利用MEGA 5.0建立菌株A1、B1的系统发育树(图5),进行基于rDNA-ITS的序列分析。

图5 基于rDNA-ITS的A1、B1菌株与相关菌株的系统发育树
3 结论与讨论
蓝花楹是一种有较高观赏价值的园林植物,但近年来在四川栽培区出现较大面积整株死亡的现象,笔者通过固定样方定期定点观察,发现1种新病害——蓝花楹茎腐病。经病株采样、分离、单孢培养及致病性测定,得到2株具有代表性的菌株A1和B1,对其形态学特征进行观察初步判断二者分别为F.oxysporum和F.chlamydosporum。试验中得到的A1形态学特性与Li[16]、Lops[17]、García-Bastidas[18]等研究中对尖孢镰刀菌形态学特性描述相一致,而B1形态学特性则与Lazreg等[19-20]和Lazarotto等[21]的研究结论相同,因此基于形态学特性初步对二者的分类地位做出判断。由于分子生物学技术鉴定菌株分类具有快速、准确、易操作的特点[22],所以本试验采用传统鉴定手段与分子生物学相结合的方式,通过登陆NCBI进行Blast比对,建立同源性较高的Fusarium属菌株的系统发育树,最终确定菌株A1和B1分别为F.oxysporum和F.chlamydosporum,且分子鉴定与形态学鉴定结果一致,这为鉴定结果的准确性提供了重要基础保障。
致病性测定试验发现,F.oxysporum与F.chlamydosporum单独接种于被刺伤的蓝花楹盆栽幼苗一段时间后均可引起与野外自然发病相同的症状,二者同时接种时症状更为明显,说明F.oxysporum和F.chlamydosporum均是蓝花楹茎腐病的病原菌,且二者具有协同增效的作用,共同导致蓝花楹茎腐病的发生。目前,国内外对于F.oxysporum引起多种真菌性植株根腐病害的研究报道较多,如黄芪根腐病[23]、灯盏花根腐病[24]、蟹爪兰根腐病[17]等,但是国内暂无有关F.chlamydosporum可引起寄主植株根腐病的报道,在国外仅在辣椒[25]和地中海白松[20]等少数寄主上有过报道,所以本研究所报道的F.oxysporum与F.chlamydosporum可作为引起蓝花楹茎腐病的新病原,但二者是否为复合侵染,特别是F.chlamydosporum如何对蓝花楹造成茎腐病的作用机制尚不清楚,有待于更深入研究。
[1]周静,张炜,李大明,等.蓝花楹JaCBF1转录因子片段的序列分析及耐寒性功能验证[J].林业科学研究,2013,26(4):414-419.
[2]张颖,林开文,郑华,等.蓝花楹挥发物的ATD-GC/MS联用分析及园林芳香性评价[J].安徽农业科学,2013,41(10):4450-4451,4521.
[3]周燕,谢益民,甘定能,等.蓝花楹木质素—碳水化合物复合体在硫酸盐法蒸煮过程中的变化[J].林产化学与工业,2007,27(2):49-52.
[4]王红梅.蓝花楹组培技术研究[J].西部林业科学,2008,37(3):18-22.
[5]李剑.不同基质对蓝花楹种子发芽率的影响试验[J].林业调查规划,2008,33(3):130-132.
[6]阳莉,石大兴,麦苗苗,等.蓝花楹组织培养与快速繁殖研究[J].热带亚热带植物学报,2012,20(1):26-32.
[7]李青,刘月婷,李帆,等.蓝花楹开花特性及其花器官构造特征观察[J].广东农业科学,2012,39(9):42-45.
[8]丁晓纲,刘喻娟,张应中,等.不同氮素浓度指数施肥对银桦、蓝花楹幼苗生长及其根系和叶片的影响[J].中国农学通报,2013,29(19):39-45.
[9]任雅君,梅洛银,丁敢丽,等.2种水温浸种对蓝花楹种子发芽指标的影响[J].安徽农业科学,2010,38(14):7720-7721,7723.
[10]韩永超,向发云,曾祥国,等.草莓根颈腐烂病的病原鉴定[J].中国农业科学,2014,47(1):53-60.
[11]冷怀琼,刘襄成,沈言章.柑桔炭疽菌次生分生孢子形成的研究[J].植物病理学报,1984,14(2):95-100.
[12]李婕,李永川,杨虹,等.甘蔗黑腐病病原菌的鉴定[J].云南大学学报:自然科学版,2014,36(1):139-143.
[13]王风芹,汪媛媛,陶西,等.耐高温东方伊萨酵母乙醇发酵特性[J].农业工程学报,2014,30(3):180-187.
[14]韩振云,宋婷婷,田佶,等.苹果属观赏海棠McUFGT的克隆及其在不同叶色品种间的表达差异分析[J].园艺学报,2014,41(2):301-310.
[15]林建伟,阙友雄,陈天生,等.一株甘蔗黑穗病菌的分离与系统发育分析[J].中国农学通报,2007,23(5):293-297.
[16]Li Y,Chi L D,Mao L G,et al.First report of ginger rhizome rot caused by Fusarium oxysporum in China[J].Plant Disease,2014,98(2):282-282.
[17]Lops F,Cibelli F,Raimondo M L,et al.First report of stem wilt and root rot of Schlumbergera truncata caused by Fusarium oxysporum f.sp.opuntiarum in southern Italy[J].Plant Disease,2013,97(6):846-846.
[18]García-Bastidas F,Ordóñez N,Konkol J,et al.First report of Fusarium oxysporum f.sp.cubense tropical race 4 associated with panama disease of banana outside southeast Asia[J].Plant Disease,2014,98(5):694-694.
[19]Lazreg F,Belabid L,Sanchez J,et al.First report of Fusarium chlamydosporum causing damping-off disease on aleppo pine in algeria[J].Plant Disease,2013,97(11):1506-1506.
[20]Lazreg F,Belabid L,Sanchez J,et al.Pathogenicity of Fusarium spp.associated with diseases of Aleppo-pine seedlings in Algerian forest nurseries[J].J For Sci,2014,60(3):115-120.
[21]Lazarotto M,Mezzomo R,Maciel CG,et al.Mycelia growth and sporulation of Fusarium chlamydosporum species complex under different culture conditions[J].Revista de Ciências Agrárias,2014,57(1):35-40.
[22]蒋盛岩,张志光.真菌的分子生物学鉴定方法研究进展[J].生物学通报,2002,37(10):4-6.
[23]罗光宏,陈叶,王振,等.黄芪根腐病发生危害与防治[J].植物保护,2005,31(4):74-75.
[24]赖宝春,胡先奇,罗文富.云南灯盏花根腐病的2种新病原鉴定及防治药剂的室内筛选[J].植物保护,2014,40(2):141-145,150.
[25]Kumar K,Bhagat S,Madhuri K,et al.Occurrence of unreported fruit rot caused by Fusarium chlamydosporum on Capsicum annum in Bay Island,India[J].Vegetable Science,2013,39(2):195-197.

