9例卵巢恶性中胚叶混合瘤临床病理特点、鉴别诊断及预后分析
谭莫伟,张乐星
(1.重庆市万州区第一人民医院病理科 404000;2.重庆三峡医药高等专科学校 404000)
卵巢恶性中胚叶混合瘤(malignant mixed mesodermal tumor of uterus,MMMT)又称卵巢恶性苗勒管混合瘤、卵巢癌肉瘤,为一种具有极高恶性程度的卵巢肿瘤[1]。该病临床较为罕见,仅占卵巢恶性肿瘤的1%~2%[2]。MMMT 不仅具有恶性上皮性成分,同时具有间质恶性成分,对放射治疗敏感性较差。现对重庆市万州区第一人民医院收治的9例MMMT 患者临床病理特点进行分析,以期为临床诊断治疗提供更为有利的证据,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析重庆市万州区第一人民医院1985年1月至2013年12月期间收治的9例卵巢MMMT 患者临床病理资料,年龄43~76岁,平均(59.83±10.06)岁;所有患者均属于绝经妇女,从绝经至发病2~17年,平均(9.5±3.1)年;9例患者均无放化疗史、家庭肿瘤史。EIGO[3]分期:Ⅰ期1例,Ⅱ期3例,Ⅲ期3例,Ⅳ期2例。手术后患者存活时间6~16个月。9例患者临床资料见表1。
1.2 方法 采用10%中性甲醛对标本进行固定,常规脱水、石蜡包埋、切片,HE染色,光镜观察。并采用Envision二步法进行免疫组织化学染色。细胞角蛋白(CK)、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、波形蛋白(vimentin)、结蛋白(desmin)和高度糖基化的i型跨膜糖蛋白(CD34)Envision 即用型试剂均由福州迈新生物技术开发有限公司生产。
1.3 结果判定 阳性判定标准为肿瘤细胞质或细胞核内存在棕黄色颗粒。

表1 9例患者临床资料
2 结 果
2.1 临床资料 该9例MMMT 患者临床症状均表现为腹部包块,同时伴有腹部不适及腹痛。经B超检查结果显示其中8例患者为一侧卵巢肿块,另外有1例患者为双侧卵巢肿块。4例患者糖类抗原(CA125)检测大于75μmol/mL,5 例患者CA125检测小于75μmol/mL。
2.2 病理检查
2.2.1 巨检 8例一侧卵巢存在肿瘤的患者中,发生于左侧的有5例,右侧有3例;另外1例患者为双侧卵巢同时存在肿瘤。肿瘤形状为圆形或卵圆形,有不完整包膜;直径4.2~7.6 cm,平均(5.96±1.05)cm。多数肿瘤切面为灰褐色或灰红色,质软、脆,有的质地细嫩呈鱼肉状。2例可见软骨或骨样组织。1例有囊性变,囊内充满血性液体。
2.2.2 镜检 组织学图像较为复杂,恶性上皮成分和间叶成分混合分布。上皮成分中子宫内膜样腺癌5例,透明细胞癌3例,黏液腺癌1例,见图1A。癌组织呈实性片团状或乳头状、腺管状。细胞呈不规则形或方形、柱状,细胞核大而深染,核仁明显,易见核分裂象。肿瘤的间叶成分,细胞呈梭形或不规则形,大小不一,边界不清,分布不均匀,且易见核分裂象,编织状或束状排列,或杂乱无章。部分间叶组织分化较好,类似宫内膜样间质、胚胎性黏液样细胞、横纹肌细胞、平滑肌细胞等,也可见少量软骨、骨样组织,软骨肉瘤,横纹肌肉瘤,见图1B。本组病例中,可见软骨肉瘤成分的有6例,可见骨肉瘤成分的有2例,可见血管肉瘤成分的有1例。
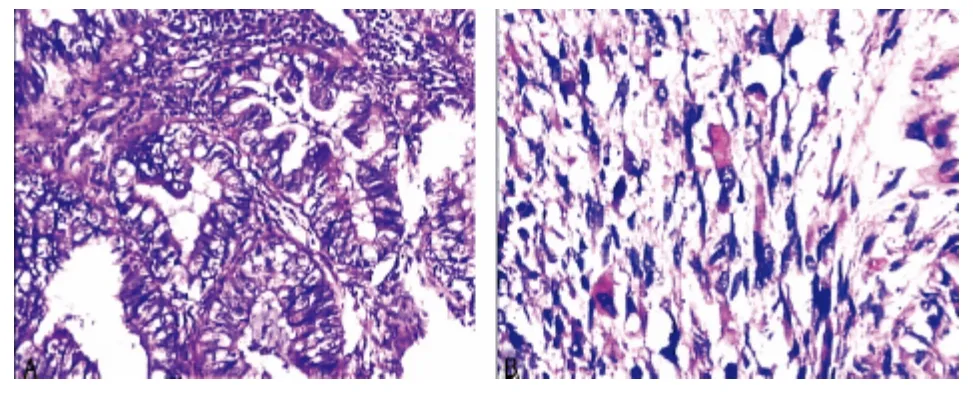
图1 卵巢MMMT 组织病理学照片图(HE×200)
2.2.3 特殊染色及免疫组织化学 嗜银纤维染色可见网状纤维包绕上皮性癌巢周围,而肉瘤样区域则包绕瘤细胞,过碘酸雪夫(PAS)染色显示腺体含中性黏液,Mallory磷钨酸苏木精(PTAH)染色部分间叶成分显示横纹。本研究中,9例患者上皮成分CK 检测均为阳性(+),见图2A,间质成分vimentin检测均为+,见图2B;其中有3例上皮成分ER 检测为+,2例上皮成分PR 检测为+;2例desmin +,1例CD34检测为+。上皮及间叶成分p53 +,软骨成分S-100 +。
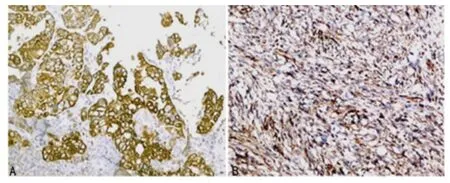
图2 CK8和vimentin蛋白表达情况(免疫组织化学×200)
2.3 治疗 本组所有患者均采用手术治疗,行双侧附件+全子宫切除4例,双侧附件+全子宫切除+盆腔淋巴结清扫的患者5例,行淋巴结清扫者均发现淋巴结肿瘤转移,其转移性肿瘤成分多数为癌,少数伴有少量肉瘤成分。术后采用环磷酰胺、阿霉素及顺铂(CAP方案)进行全身化疗的患者7例,另外2例患者放弃术后治疗。所有患者均予以随访,平均存活时间为9.3个月,其中,手术+化疗组患者存活时间为8个月2例,10个月2例,14个月1例,16个月2例;单纯手术治疗的患者,存活时间为6个月1例,7个月1例。直接死因,1例患者因感冒引起多器官衰竭死亡,其余患者因肿瘤转移导致死亡。
3 讨 论
MMMT 属于一种含有上皮和间叶两种成分的高度恶性肿瘤,常发生于子宫,发生于卵巢的MMMT 极为少见,仅占卵巢恶性肿瘤的1%~2%。有学者认为,恶性细胞主要是来源于生殖脊内苗勒结节,但在胚胎发生过程中,其最终来源于中胚层[4]。
目前,对于MMMT 的起源存在着较多争论,其中有3种较为公认的学说[5]:(1)联合学说:认为一种具有多潜能分化的细胞是该肿瘤的起源,当这种细胞受到外界刺激时,会向肿瘤发生转化,同时能够向上皮和间叶两个方向进行转化;(2)碰撞学说:认为该肿瘤分别起源于2种或2种以上干细胞,并且能够同时向癌细胞和肉瘤细胞发生分化,这一学说的证据是在部分病例中能够看到上皮和间叶成分二者之间存在明显分界;(3)转化学说:这一理论其实属于联合学说的一种变形,认为MMMT 是通过一种肿瘤细胞转化为另一种肿瘤细胞,同时这种转化过程是由癌转化为肉瘤[6]。
关于该肿瘤的分期,美国国家癌症综合网(National Comprehensive Cancer Network,NCCN)2011版卵巢癌临床实践指南中指出,大部分病理学家认为MMMT 属于分化差的卵巢上皮性癌[7]。因此,MMMT 分期也可采用原发性腹膜癌和卵巢上皮性癌分期系统。
在对MMMT 进行诊断过程中,应当采用临床与病理结合的方式进行。肿瘤在绝经后老年女性最为多发,临床主要表现为腹痛、腹胀、阴道出血、腹部包块,给予其B超和CA125联合检查,能够使卵巢肿瘤临床诊断的准确率得到有效提高。病理组织学检查,光镜能够看见上皮和间叶两种成分,上皮成分通常为腺样结构,可类似于子宫内膜,也可是非子宫内膜样,如透明细胞型、浆液性,甚至鳞状细胞癌。上皮成分常呈巢团状、条索状分布。间叶成分是宫内膜间质肉瘤、平滑肌肉瘤、纤维肉瘤、软骨肉瘤、骨肉瘤、脂肪肉瘤、横纹肌肉瘤、血管肉瘤等[8],各种肉瘤成分可混合存在。本研究中,癌性成分大部分为宫内膜样腺癌或透明细胞癌及浆液腺癌,肉瘤性成分大部分为梭形细胞,异源性分化表现为横纹肌肉瘤、软骨肉瘤及骨肉瘤。与国内研究报道一致。
在病理诊断中,应当加强MMMT 与未成熟畸胎瘤之间的鉴别诊断,其鉴别关键点主要为查找是否含有以不成熟成分为特点的三胚层分化证据,后者除中胚层外,还有内胚层和外胚层成分,且肿瘤中总会存在着一定数量的良性胚胎性成分[9]。MMMT 相比未成熟畸胎瘤而言,其仅为简单的多种恶性上皮和间叶成分二者的混合,并不会向三胚层分化,不会发生未成熟的胚胎性器官样结构改变[10]。MMMT 上皮成分不是肠、胃型等胚胎性上皮,一般是分化较低的浆液性腺癌、宫内膜样癌或腺鳞癌;间叶成分不是幼稚软骨等胚胎性间叶组织,一般是软骨肉瘤、平滑肌肉瘤或横纹肌肉瘤,不会看见胚胎性软骨分化为成熟软骨的各种中间形态[11],同时,最为重要的是不会见未成熟畸胎瘤的神经管等胚胎性神经外胚叶分化。此外,在临床实践中,应当全面充分对卵巢的标本进行取材[12],由此方可对肿瘤全貌尽览,避免因取材不够充分,未查见苗勒管上皮成分,仅表现为单一的肉瘤成分而造成误诊为卵巢肉瘤。MMMT 还应与卵巢腺肉瘤鉴别,因为前者为高度恶性,后者为低度恶性,二者预后有很大不同。在组织学上,腺肉瘤由良性的上皮成分和恶性的间叶成分组成。腺肉瘤的上皮成分最常见的是宫内膜样上皮,也可为宫颈管或输卵管型上皮,被覆于囊腔内或裂隙内,常伴有鳞化或黏液化生。MMMT 恶性程度很高,其临床过程一般是进展性的,预后很差,大多数患者会在短期内死亡,平均存活期仅为11~12 个月。有研究表明[13],不含软骨成分的患者,其生存期明显短于含有软骨成分的患者。70%患者会在1年内发生死亡。预后与病理类型、CA125水平、临床分期、手术方式以及术后残留肿瘤大小等存在着明确关系。若同源性、早期及CA125检测小于或等于75 μmol/mL、残留肿瘤小于或等于1cm,则预后较好。目前,临床对MMMT 治疗的有效手段仍然是手术治疗,术后同时给予辅助化疗,大部分化疗采用含铂类药物联合化疗。有学者证明,采用手术配合放、化疗能够使患者的生存时间得到延长[14]。本组病例中,经化学治疗的患者,2例患者存活时间为8个月,2例患者存活时间为10个月,1例患者存活时间为14个月,2例患者存活时间为16个月;未经化疗的患者中,1例患者存活时间为6 个月,1 例患者存活时间为7 个月。表面上看,手术配合化疗能够使患者的生存时间得到延长,但仔细分析,未化疗者存活时间较短与患者分期较高也有明显的关系。由于本组病例较少,未能进行统计分析。
综上所述,组织学形态是MMMT 诊断的主要依据,同时B超和CA125联合检查,能够使其临床诊断的准确率得到有效提高,但临床需要注意与未成熟畸胎瘤等肿瘤的鉴别诊断。
[1] Zorzou MP,Markaki S,Rodolakis A,et al.Clinicopathological features of ovarian carcinosarcomas:a single institution experience[J].Gynecol Oncol,2005,96(1):136-142.
[2] Lee SH,Kim J,Kim JH,et al.Malignant mixed mullerian tumor of the cervix including components of a rhabdomyosarcoma:case report and literature review[J].Eur J Gynaecol Oncol,2010,31(4):462-466.
[3] Bashour BN,Rancer K,Rance CP.Malignant mixed mullerian tumor(MMMT)of the cervix following cyclophosphamide therapy for nephritic syndrome[J].J Pediatr,1973,82(2):292-293
[4] Cantrell LA.Van Le L.carcinosarcoma of the ovary a reciew[J].Obstet Gynecol Surv,2009,64(10):673-680.
[5] Chiu SY,Twu NF,Lai CH,et al.Primary malignant mixed müllerian tumor of the ovary[J].Taiwan J Obstet Gynecol,2010,49(1):87-90.
[6] Goldman NA,De LM,Jones JG,et al.Malignant mixed mullerian tumor of the uterus in a patient taking raloxifene[J].Obstet Gynecol,2005,105(5Pt 2):1278-1280.
[7] 吕国庆.卵巢恶性中胚叶混合瘤临床病理观察[J].中外健康文摘,2012,9(1):221-223.
[9] 陆怡,吴红阳,彭万仁,等.子宫多发性恶性中胚叶混合瘤1例报道并文[J].罕少疾病杂志,2011,18(1):40-43.
[10] 张立华,李帅,刘剑羽.子宫恶性中胚叶混合瘤的MRI表现[J].中华放射学杂志,2012,46(2):139-142.
[11] Gupta N,Dudding N,Smith JH.Eight cases of malignant mixed Müllerian tumor(carcinosarcoma)of the uterus:findings in SurePath?cervical cytology[J].Diagn Cytopathol,2014,42(2):165-169.
[12] Chao KC,Wang PH,Chang CC,et al.Establishment and characterization of a cell line,MT-213-VGH,isolated from a mixed mullerian tumor of the uterus[J].Acta Cytol,2001,45(5):683-690.
[13] 王海霞,赵俊红,解其贵,等.17 例子宫恶性中胚叶混合瘤临床病理特征及PRA、PKB蛋白表达及其意义[J].中国癌症杂志,2008,18(10):740-743.
[14] 朱丽丽,周颖,朱敏,等.卵巢恶性苗勒氏管混合瘤1 例[J].大连医科大学学报,2013,35(5):506-508.

