泛耐药铜绿假单胞菌医院获得性肺炎抗感染疗效分析
曾奕彬 林冠文 刘蕴婷 林茂锐 方晓琳
(1广州市脑科医院 广州市惠爱医院 广州医科大学附属脑科医院,广东 广州 510095;2广东省第二人民医院 广东省应急医院,广东 广州 510317)
·临床实践·
泛耐药铜绿假单胞菌医院获得性肺炎抗感染疗效分析
曾奕彬1林冠文2刘蕴婷2林茂锐2方晓琳2
(1广州市脑科医院 广州市惠爱医院 广州医科大学附属脑科医院,广东 广州 510095;2广东省第二人民医院 广东省应急医院,广东 广州 510317)
目的:比较头孢哌酮舒巴坦单用和联合阿米卡星治疗泛耐药铜绿假单胞菌(PDRPA)所致医院获得性肺炎(HAP)的疗效。方法:将2012年6月至2013年12月份收治的84例PDRPA-HAP患者分为单用组(单用头孢哌酮舒巴坦)和联合组(头孢哌酮舒巴坦联合阿米卡星)。参照卫计委制定的《抗生素临床研究指导原则》相关标准评价抗感染疗效。结果:两组细菌清除率比较,差异有统计学意义(χ2=5.765,P=0.016);临床疗效比较,差异无统计学意义(χ2=2.791,P=0.095);药品不良反应比较,差异无统计学意义(P>0.05)。结论:头孢哌酮舒巴坦联合阿米卡星治疗PDRPA-HAP的细菌清除率优于单用头孢哌酮舒巴坦,值得进一步扩大研究观察。
泛耐药性;铜绿假单胞菌;医院获得性肺炎
铜绿假单胞菌(pseudomonas aeruginosa,PA)是临床最常见的非发酵菌,是医院获得性肺炎(hospital acquired pneumonia,HAP)重要的条件致病菌,具有易定植、易变异和多重耐药的特点,可引起机体多系统、多器官或多部位的严重感染,特别是呼吸道和伤口感染。近年来,国内多项大型流行病学调查显示我国PA感染,尤其是肺部感染的发病率不断增加。2005年,胡必杰等[1]报告562例HAP中PA的分离率为18.6%,列第一位;我国近期临床调查结果显示,PA分离率为23.0%,居第2位[2]。泛耐药铜绿假单胞菌(pan-drug resistant pseudomonas aeruginosa,PDRPA)引起的HAP病死率高,治疗困难,如防控不当,更易引起交叉感染和暴发。为探讨PDRPA-HAP的有效治疗方案,本研究对单用头孢哌酮舒巴坦和头孢哌酮舒巴坦联合阿米卡星两组方案进行了对比分析,现报告如下。
1 资料与方法
1.1 病例选择
纳入标准:①住院患者,入院48 h之后出现咳嗽、痰液粘稠,肺部出现湿啰音,并有下列情况之一:发热;白细胞总数和(或)嗜中性粒细胞比例增高;X线片检查显示肺部有炎性浸润性病变;慢性气道疾患患者稳定期(慢性支气管炎伴或不伴阻塞性肺气肿、哮喘、支气管扩张症)继发急性感染,并有病原学改变或X线胸片显示与入院时比较有明显改变或新病变。②存在PA感染危险因素:如基础疾病、免疫状态、先期抗生素治疗、其他与发病相关的危险因素如机械通气时间等。③痰标本质量合格。痰标本接种前进行革兰染色镜检,判断痰标本是否合格,同时注意有无白细胞吞噬或伴行现象及细菌的染色和形态。④呼吸道分泌物,包括痰、咽拭子、气管吸引标本、保护性毛刷标本、支气管肺泡灌洗液等PA培养阳性,药敏测定结果药敏测定结果为PDRPA。PDRPA:指对表1中所有代表性抗菌药物均不敏感[3]。⑤经筛选的痰液,连续两次分离到PA或痰细菌定量培养分离PA菌数≥106cfu/mL、气管内吸引物PA≥105cfu/mL、肺泡灌洗液PA≥104cfu/mL、防污染保护性气管镜毛刷PA≥103cfu/mL。
排除标准:①有青霉素或头孢菌素类抗生素过敏者;②严重肝肾功能衰竭者;③用药过程因故中断治疗,未能完成预定疗程者。
2012年6月至2013年12月我院收治符合上述筛选标准的PDRPA-HAP患者84例。入选病例随机分为单用组(单用头孢哌酮舒巴坦,42例)和联合组(头孢哌酮舒巴坦联合阿米卡星,42例),两组患者一般情况比较,差异无统计学意义(P>0.05),见表2。
1.2 分离、鉴定
采用美国BD phoeix100全自动细菌鉴定仪进行菌株鉴定,依据美国CLSI2013年版标准判断结果。每批次和每月进行质控检验,质控菌株由卫生部临床检验中心提供:铜绿假单胞菌ATCC27853。

表1 定义泛耐药铜绿假单胞菌的药物类别及代表性药物

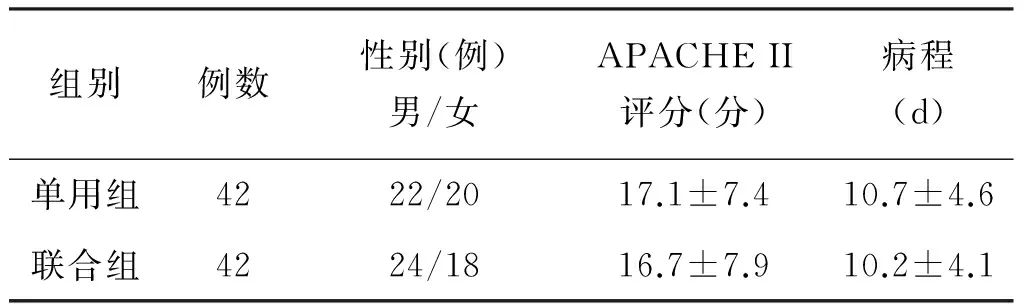
组别例数性别(例)男/女APACHEII评分(分)病程(d)单用组4222/2017.1±7.410.7±4.6联合组4224/1816.7±7.910.2±4.1
1.3 给药方法
单用组:单用头孢哌酮舒巴坦(辉瑞制药有限公司,1.5 g/瓶,头孢哌酮:舒巴坦为500 mg∶250 mg)3.0 g,每6 小时静脉滴注1次,疗程10~14 d。
联合组:头孢哌酮舒巴坦联合阿米卡星(齐鲁制药,0.2 g/瓶)0.4 g,每12小时静脉滴注1次,其中阿米卡星用药疗程7 d,头孢哌酮舒巴坦10~14 d。
如合并其他细菌及真菌感染,则同时给予相应治疗。
1.4 疗效评价
1.4.1 临床疗效 参照卫生部颁发的《抗菌药物临床研究指导原则》,从临床症状、体征、实验室检查、细菌学检查等各方面进行综合评价,以确定临床疗效,并按痊愈、显效、进步、无效进行评定。痊愈:临床症状、体征、实验室检查、细菌学检查均为阴性;显效:临床症状、体征、实验室检查有1项未恢复,细菌学检查为阴性;进步:临床症状、体征、实验室检查有2项未恢复,细菌学检查为阳性;无效:用药72 h病情无好转或加重。
1.4.2 细菌学疗效:(1)清除:疗程结束后细菌培养无致病菌生长;(2)未清除:疗程结束后原致病菌依然存在。
1.5 不良反应评价
在以下药品不良反应分析的5个原则中,前四个选项都选择“是”,则关联性评价为“肯定”;前四个选项中有3个选择“是”,则关联性评价为“很可能”;前四个选项中有2个选择“是”,则关联性评价为“可能”:(1)用药与不良反应/事件的出现有无合理的时间关系。(2)反应是否符合该药已知的不良反应类型。(3)停药或减量后,反应是否消失或减轻。(4)再次使用可疑药品是否再次出现同样反应/事件。(5)反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释。
1.6 统计学分析
2 结 果
2.1 临床疗效
联合组总有效率为38.1%,高于单用组的21.4%,但两组疗效比较,差异无统计学意义(χ2=2.791,P=0.095),如表3所示。
2.2 细菌清除率
单用组疗程结束后1周细菌清除15株(35.7%),联合组清除26株(61.9%),两组比较,差异有统计学意义(χ2=5.765,P=0.016)。
2.3 不良反应
单用组发生腹泻1例、恶心1例,联合组发生皮疹1例、腹泻1例,经对症处理后均恢复正常。两组不良反应发生率比较,差异无统计学意义(P>0.05)。
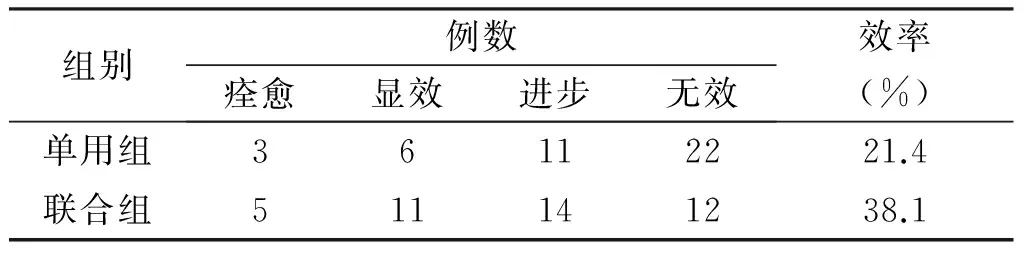
表3 两组患者临床疗效比较(例)
3 讨 论
PA是临床最常见的MDR和PDR致病菌之一,其耐药机制涉及多个方面[4-7],包括:(1)产生灭活酶:①产生β-内酰胺酶;②产生氨基糖苷类钝化酶。(2)膜通透性下降:①主动外排系统过度表达;②膜孔蛋白丢失或表达下降;(3)靶位改变;(4)生物被膜形成等。由于细菌耐药性的不断增加,临床上对PDRPA肺部感染的治疗面临越来越多的困难。近年来,国内外很多学者对多重耐药、PDRPA进行了体外抗菌药物联合杀菌试验研究,并找到一些协同杀菌的联合用药组合,如抗假单胞菌β-内酰胺类+抗假单胞菌喹诺酮类或抗假单胞菌喹诺酮类+氨基糖苷类等。但由于其耐药机制极为复杂,病情呈现多样性,临床上如何选择最优的用药方案尚无统一定论。
PDRPA引起的HAP病死率高,治疗困难。如防控不当,更易引起交叉感染和暴发。因此寻找最优的抗菌方案,指导临床PDRPA-HAP的治疗具有重要临床意义。
头孢哌酮舒巴坦是由头孢哌酮、舒巴坦组成的复方制剂,前者为第三代头孢菌素,通过抑制细菌细胞壁的合成而发挥杀菌作用;后者为β-内酰胺酶抑制剂,对耐药菌株产生的各种β-内酰胺酶具有不可逆性的抑制作用,从而增强头孢哌酮抵抗β-内酰胺酶降解的能力,以保持其对耐药菌发挥杀菌作用。硫酸阿米卡星是一种氨基糖苷类抗生素,对PA及其他假单胞菌、不动杆菌属、产碱杆菌属等有良好抑制作用。2012年CHINET细菌耐药性检测结果显示,PA对阿米卡星的敏感度为82.3%,但不建议单独应用于肺部感染[8]。
体外联合药敏试验证实了β-内酰胺类抗菌药物联合阿米卡星对PDRPA的抗菌活性有显著增强[9]。因此,本研究选择头孢哌酮舒巴坦联合阿米卡星治疗PDRPA-HAP。与单用头孢哌酮舒巴坦组比较,联合用药组的临床疗效有效率较高,但差异无统计学意义。联合用药组的细菌清除率显著高于单药组,差异有统计学意义。两组的不良反应发生率,比较差异无统计学意义。由于本研究资料病例数较少,故应进一步加大样本量动态观察各项指标,以取得更确切的临床研究结果。
现在医院普遍开展的细菌药敏试验多为体外单一的抗菌药物杀/抑菌试验。多重耐药菌的联合用药抗感染治疗主要以临床经验为主,方案选择不当容易延误患者治疗时机,导致感染加重甚至死亡等严重后果。体外个体化的抗菌药物联合杀菌试验可能更有助于选择治疗PDRPA的抗菌药物联合用药方案[7]。目前,尚缺乏MCBT指导PDRPA-HAP治疗的临床研究资料。因此,有必要进一步研究个体化MCBT对治疗PDRPA-HAP的临床指导意义。
[1] 胡必杰,魏 丽,张秀珍,等. 医院获得性肺炎发病时间对病原构成影响的回顾性队列研究[J].中华结核和呼吸杂志,2005,28(2):112-116.
[2] 陈宏彬,赵春江,王 辉,等. 2011年中国13家教学医院院内感染常见病原菌耐药性分析[J].中华内科杂志,2013,52(3):203-212.
[3] 李春辉,吴安华. 医疗机构耐药菌MDR、XDR、PDR的国际标准化定义专家建议(草案)[J].中国感染控制杂志,2011,10(3):238-240.
[4] Robert A, Bonomo, Dora Szabo. Mechanisms of Multidrug Resistance in Acinetobacter Species and Pseudomonas aeruginosa [J]. Clinical Infectious Diseases, 2006, 43(9):S49-S56.
[5] Bonfiglio G, Laksai Y, Franchino L, et al. Mechanisms of bata-lactam resistance Pseudomonas aeruginosa isolated in an Italian survey[J].J Antimocrob Chemother, 1998, 42:697-702.
[6] Poirel L, Nass T, Nicolas D, et al. Characterization of VIM-2, a arbapenem-hydrolyingMetallo-β-lactamase and its plasmid-and integronbome gene from a Pseudomonas aeruginosa clinical isolate in France [J]. Antimicrob Agents Chemother, 2000, 44:891-897.
[7] 付玉梅,杨晓仪,梁惠芬,等 . 社区医疗机构 多重耐药铜绿假单胞菌产金属β内酰胺酶检测[J]. 中华生物医学工程杂志,2012,18 (4):314-316.
[8] 中华医学会呼吸病学分会感染学组.铜绿假单胞菌下呼吸道感染诊治专家共识[J]. 中华结核和呼吸杂志,2014,37(1):9-15.
[9] 杨菁菁,孙铁英,胡云建. 泛耐药铜绿假单胞菌的抗菌药物联合杀菌试验[J]. 中国感染与化疗杂志,2010,10(5):357-362.
(本文编辑:张辉)
·医学新闻·
阿司匹林为肿瘤免疫治疗添动力
据生物谷报道,根据一项发表在著名国际学术期刊cell上的最新研究,在进行肿瘤免疫治疗的同时服用阿司匹林可以大大提高治疗效果。
来自英国弗朗西斯克里克研究所的研究人员们通过研究证明皮肤癌,乳腺癌和大肠癌细胞经常会产生大量前列腺素E2(PGE2),这种分子能够减弱免疫系统对病变细胞的正常应答,帮助癌细胞进行隐藏,这一过程使得肿瘤能够快速生长,也部分解释了为什么一些免疫治疗方法不能达到预期效果。
阿司匹林是COX抑制剂的一种,这种药物能够抑制PGE2的合成达到重新唤醒免疫系统的效果。因此与单独使用免疫疗法相比,将免疫治疗方法与阿司匹林或其他COX抑制剂联合使用能够大大减缓小鼠体内大肠癌或黑色素瘤的生长。
领导该项研究的 Caetano Reise Sousa教授这样说道:“我们的研究进一步证明了一些癌细胞通过合成PGE2逃脱免疫系统的监视和杀伤,如果能够消除癌细胞合成PEG2的能力就能够有效移除它的保护屏障,解除对免疫系统的束缚。”
在病人进行免疫治疗的同时给予类似阿司匹林的COX抑制剂能够为病人带来更多的潜在获益,虽然这项研究只是一些初步工作,但是这仍然提示通过药物联用可以使得癌症免疫治疗更加有效,并可能为病人的生命带来巨大改变。
Efficacy of anti-infection therapy in hospital-acquired pneumonia caused by pan-drug resistant Pseudomonas aeruginosa
ZengYibin1,LinGuanwen2,LiuYunting2,LinMaorui2,FangXiaolin2
(1GuangzhouBrainHospital/GuangzhouHui-AiHospital/BrainHospitalAffiliatedtoGuangzhouMedicalUniversity,Guangzhou510095;2GuangdongNO.2ProvincialPeople′sHospital/GuangdongProvincialEmergencyHospital,Guangzhou510317,China)
Objective:To compare the efficacy of cefoperazone/sulbactam (CPZ/SBT) alone vs in combination with amikacin in treatment of hospital-acquired pneumonia (HAP) caused by pan-drug resistant Pseudomonas aeruginosa (PDRPA). Methods:Between June 2012 and December 2013, a total of 84 patients with PDRPA-caused HAP were divided into the monotherapy group (CPZ/SBT alone) and the combination therapy group (CPZ/SBT plus Amikacin). The efficacy of anti-infection therapy was evaluated with reference to the “Guidelines on Clinical Studies Using Antibiotics" by China Committee of Health and Family Planning.Results:The two groups showed statistically significant difference in bacterial clearance rate (χ2= 5.765,P=0.016) but comparable clinical efficacy (χ2=2.791,P=0.095). There was statistically significant difference in adverse drug reactions between the groups(P>0.05).Conclusion: CPZ/SBT combined with amikacin results in higher bacterial clearance rate than CPZ/SBT alone in treatment of PDRPA-caused HAP, which warrants further observation in larger studies.
pan-drug resistance; Pseudomonas aeruginosa; hospital-acquired pneumonia
10.3969/j.issn.2095-9664.2015.05.015
广东省医学科研基金项目(A2014154)
曾奕彬(1982-),男,本科,主治医师。
R563.1
2095-9664(2015)05-0059-04
2015-01-22)
研究方向:医院感染管理和抗菌药物合理应用研究。

