HMGB1和sRAGE在肺功能正常吸烟者中的表达及其临床意义
吴冬霞 萧 鲲 许浦生
(1清远市人民医院防控科,广东 清远 511500;2广州惠爱医院重症监护病房,广东 广州 510000;3广州医科大学附属第二医院呼吸科, 广东 广州 510000)
·论著·
HMGB1和sRAGE在肺功能正常吸烟者中的表达及其临床意义
吴冬霞1萧 鲲2许浦生3*
(1清远市人民医院防控科,广东 清远 511500;2广州惠爱医院重症监护病房,广东 广州 510000;3广州医科大学附属第二医院呼吸科, 广东 广州 510000)
目的:观察肺功能正常吸烟者血清HMGB1和sRAGE的表达及个体差异性对其表达的影响,初步探讨其临床意义。方法:选取2013年2月- 2014年2月在广州医科大学附属第二医院体检中心体检后证实为健康者40人,其中吸烟组20人,非吸烟组20人,收集40例研究对象的一般人口学资料、肺功能状况和血清HMGB1、sRAGE的表达水平,根据结果进行统计分析。结果:吸烟组血清sRAGE水平低于非吸烟组;血清HMGB1与肺功能水平显著相关,但这种相关性仅见于吸烟者;结论:吸烟者在尚无呼吸道症状和肺功能改变时便已出现血清sRAGE水平的下降;在吸烟者出现COPD之前,其血清HMGB1和sRAGE的表达水平可能作为肺功能评估的指标。
HMGB1;sRAGE;肺功能正常吸烟者;临床意义
慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)是一种常见的以持续气流受限为特征的可以预防和治疗的疾病,气流受限呈进行性发展,与气道和肺脏对有毒颗粒或气体的慢性炎性反应增强有关[1]。
高迁移率族蛋白1(high mobility group protein box 1,HMGB1)是一种重要的炎症介质,可触发和调节炎症反应,介导器官组织的炎症损伤。晚期糖基化终产物受体(receptor for advanced glycation end- products,RAGE)是HMGB1的主要受体之一,而RAGE的内源分泌型,即可溶性RAGE(soluble RAGE,sRAGE)能通过与RAGE竞争同RAGE配体的结合、阻断RAGE信号而在炎症性疾病中起保护作用[2-4]。研究证实,吸烟COPD患者的血清HMGB1水平高于非吸烟COPD患者和非吸烟者[5],且COPD患者血清sRAGE的表达要低于正常吸烟人群[6-7],但尚未见肺功能正常吸烟者HMGB1和sRAGE表达水平的报道。本研究希望通过观察、分析肺功能正常吸烟者血清HMGB1和sRAGE的表达,初步探讨其临床意义,为COPD的早期诊治提供新的思路。
1 资料与方法
1.1 研究对象
挑选2013年2月至2014年2月在广州医科大学附属第二医院体检中心体检后证实为健康者40人,年龄在26~79岁,依据研究对象的一般生活资料调查结果,将其分为吸烟组及非吸烟组,其中吸烟组20人,男性10人,女性10人,非吸烟组20人,男性10人,女性10人。排除标准:①其他可影响系统性炎症的疾病:如感染、冠心病、糖尿病、精神疾病、风湿免疫性疾病、肿瘤、肾功能不全、血液系统疾病等;②其他可能影响肺功能和局部炎症的疾病:如肺炎、慢性阻塞性肺疾病、支气管哮喘、纤维增殖型肺结核、支气管扩张症、近8周內的上呼吸道感染等;③既往吸烟但现已戒烟者。
1.2 方法
1.2.1 一般资料收集 收集研究对象一般资料,包括年龄、性别、联系方式、个人吸烟状况、身高、体重等。
1.2.2 肺功能检查 分别进行常规肺通气功能检查和支气管激发试验检查,确认研究对象肺功能正常及支气管激发试验阴性后,根据研究对象的吸烟史分别将其纳入“吸烟组”或“非吸烟组”。
1.2.3 血清HMGB1、sRAGE表达水平的检测 采用双抗体夹心酶联免疫吸附试验( ELISA )进行测定。每个样本取全血2 mL以3 000×g离心10min,吸出上层血清置于-20℃冰箱保存,集中检测。操作步骤严格按照说明书进行。
1.3 统计分析
2 结 果
2.1 吸烟组与非吸烟组的对比分析
2.1.1 吸烟组与非吸烟组一般人口学资料的比较 吸烟组与非吸烟组之间在性别、年龄和BMI指数上的差异无统计学意义(P<0.05),见表1。

表1 吸烟组和非吸烟组一般人口学资料的比较
2.1.2 吸烟组与非吸烟组肺功能的比较 经正态分布检验后采用独立样本t检验,吸烟组与非吸烟组在各项肺功能相关指标上的差异无统计学意义(P<0.05),见表2。
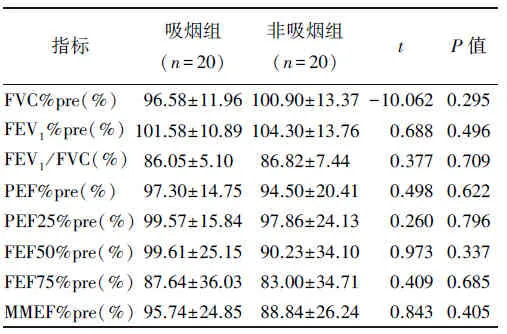
表2 吸烟组和非吸烟组肺功能的比较
2.1.3 吸烟组与非吸烟组血清HMGB1、sRAGE的比较 吸烟组血清sRAGE水平低于非吸烟组(P=0.044),吸烟组与非吸烟组在血清HMGB1水平上的差异无统计学意义(P<0.05),见表3。
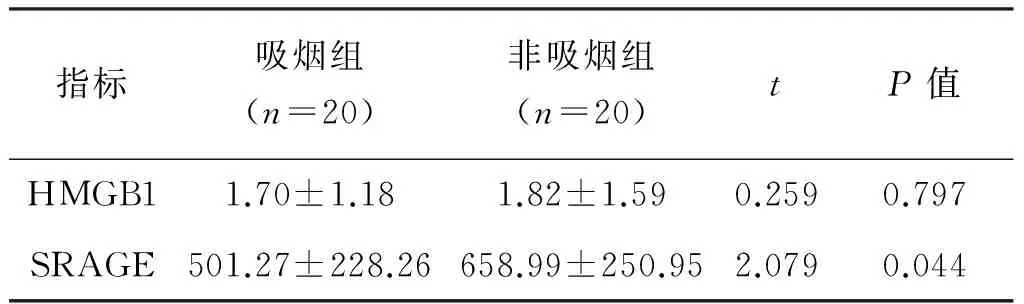
表3 吸烟组与非吸烟组血清HMGB1、sRAGE的比较
2.2 HMGB1、sRAGE与健康人群肺功能的相关性分析
2.2.1 HMGB1、sRAGE与健康人群肺功能的相关性分析 在控制性别、年龄、身高和体重后,健康人群血清HMGB1、sRAGE水平与肺功能相关性分析显示,见表4:血清HMGB1水平与FEV1/FVC(r=-0.354,P=0.034)、FEF50%pre(r=-0.354,P=0.042)、FEF75%pre(r=-0.362,P=0.030)和MMEF%pre(r=-0.465,P=0.004)呈负相关;血清sRAGE水平与肺功能无明显相关性,差异无统计学意义。
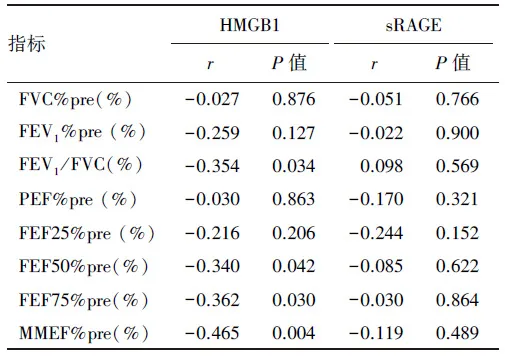
表4 HMGB1、sRAGE与健康人群肺功能的相关性分析
2.2.2 HMGB1、sRAGE与健康人群吸烟亚组肺功能的相关性分析 因吸烟人群与非吸烟人群在血清sRAGE水平上存在差异,推测其与肺功能的相关性上也可能存在差异,故分别针对吸烟组与非吸烟组进行亚组分析。
在控制性别、年龄、身高和体重后,健康人群吸烟亚组血清HMGB1、sRAGE水平与肺功能相关性分析显示,见表5:血清HMGB1水平与FEV1%pre(r=0.511,P=0.043)、FEV1/FVC(r=-0.616,P=0.011)、FEF25%pre(r=-0.758,P=0.001)、FEF50%pre(r=-0.692,P=0.003)、FEF75%pre(r=-0.515,P=0.041)和MMEF%pre(r=-0.758,P=0.001)呈负相关;血清sRAGE水平与肺功能无明显相关性,差异无统计学意义(P<0.05)。
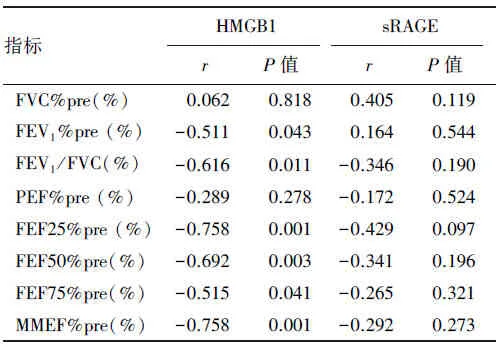
表5 HMGB1、sRAGE与健康人群吸烟亚组肺功能的相关性分析
2.2.3 HMGB1、sRAGE与健康人群非吸烟亚组肺功能的相关性分析 在控制性别、年龄、身高和体重后,非吸烟亚组血清HMGB1与sRAGE水平均与肺功能无明显相关性,差异无统计学意义(P<0.05),见表6。
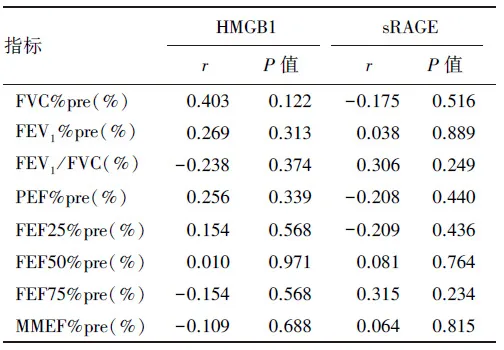
表6 HMGB1、sRAGE与健康人群非吸烟亚组肺功能的相关性分析
3 讨 论
本组前期研究[8]发现,对于肺功能正常的人群,可按照其肺功能特点将其分类,并推测机体可能存在AGEs-sRAGE等多种保护机制。因此,本研究希望分别从血清HMGB1、sRAGE在肺功能正常吸烟者与非吸烟者中表达的差异,血清HMGB1、sRAGE与肺功能的相关性此两方面,初步探讨其临床意义。
本研究发现,虽然吸烟组与非吸烟组在一般人口学资料、各项肺功能指标和血清HMGB1水平上的对比均无统计学差异,但吸烟组血清sRAGE水平低于非吸烟组,因此提示:①吸烟者在尚无呼吸道症状和肺功能改变时便可出现血清sRAGE水平的下降;②吸烟已证实可导致血清HMGB1的升高,但吸烟者sRAGE的下降可能更早于HMGB1的升高。那么,为什么本研究中吸烟组的各项肺功能指标均属正常,且与非吸烟组对比未见统计学差异,笔者考虑可能原因:①烟草依赖对吸烟组的损害尚属初期的阶段,损害程度尚较轻微;②人体存在保护机制对抗损害;③血清HMGB1和血清sRAGE的水平可能并不能完全反映气道炎症水平,而本研究未对诱导痰HMGB1和诱导痰sRAGE的进行观察;④尼古丁依赖程度、吸烟指数、体育锻炼强度、饮用绿茶习惯及情绪状态等均可能影响炎症介质的表达;⑤人种和个体差异;⑥研究对象较少。
本研究也发现:吸烟者血清HMGB1与大气道功能、小气道功能均呈负相关,血清sRAGE水平与肺功能无明显相关性,证实吸烟者早期即出现肺功能受损,而且这种肺功能的受损并未能被目前的肺功能检查发现,提示吸烟者的血清HMGB1和sRAGE的表达水平对其COPD的早期诊断有独特的意义,可能更优于常规的肺功能检查,可能作为评估肺功能早期受损的指标。
然而,本研究尚存在一定的不足,如:对于研究对象的诱导痰HMGB1和sRAGE的水平未进行观察;而且,有学者提出sRAGE不能反应COPD的严重程度的观点,但也有学者发现sRAGE与COPD患者的FEV1和FEV1/FVC相关[9];为何会有相反的观点,本组认为这与研究对象的个体差异有关,即不同的人群对吸烟的反应性不一,这需要本组进一步探索。本组将沿着本研究的方向继续深化,以期为COPD的早期诊治提供科学依据。
[1] Vestbo J, Hurd SS, Agustí AG, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructivepulmonary disease:GOLD executive summary[J]. Am J Respir Crit Care Med,2013,187(4):347-365.
[2] 纪子梅,梅晓冬.慢性阻塞性肺疾病患者血清高迁移率族蛋白B1和纤维蛋白原的检测及意义[J]. 广东医学, 2012,33(7):990-991.
[3] Klune JR, Dhupar R, Cardinal J, et al. HMGB1:Endogenous danger signaling[J]. J Mol Med, 2008,14(6):476-484.
[4] Yonekura H, Yamamoto Y, Sakurai S, et a1. Novel splice variants of the receptor for advanced glycation end-products expressed in human vascular endothelial cells and pericytes,and their putative roles in diabetes-induced vascular injury[J]. Biochem J, 2003,370 (Pt 3):1097-1109.
[5] Upham JW, Smith DJ, Yerkovich ST. Does RAGE protect smokers from COPD [J]. Eur Respir J, 2011,38(3):743-748.
[6] Park L, Raman K G, Lee K J, et al. Suppression of accelerated diabetic atherosclerosis by the soluble receptor for advanced glycation endproducts[J]. Nature medicine, 1998, 4(9):1025-1031.
[7] Goova MT, Li J, Kislinger T, et al. Blockade of receptor for advanced glycation end-products restores effective wound healing in diabetic mice[J]. The American journal of pathology, 2001, 159(2):513-525.
[8] 萧 鲲, 许浦生. 肺功能正常人群吸烟状况和气道炎性因子表达谱的探索[J]. 广州医科大学学报, 2014,42(5):46-53.
[9] Iwamoto H, Gao J, Pulkkinen V, et al. Soluble receptor for advanced glycation end-products and progression of airway disease[J]. BMC Pulmonary Medicine, 2014, 14(4):1-7.
(本文编辑:欧阳菁)
Expression and clinical significance of HMGB1 and sRAGE in smokers with normal lung function
WuDongxia1,XiaoKun2,XuPusheng3
(1DepartmentofDiseaseControlandPrevention,QingyuanMunicipalPeople′sHospital,Qingyuan,Guangdong511500;2ICU,GuangzhouHuiaiHospital,Guangzhou510000;3DepartmentofRespiratoryMedicine,SecondAffiliatedHospitalofGuangzhouMedicalUniversity,Guangzhou510000,China)
Objective:To observe the expression levels of serum HMGB1 and sRAGE in smokers with normal lung function and the influence of individual differences in the expression levels, and to investigate its clinical significance.Methods:Forty healthy subjects who received workup in the Health Examination Center, Second Affiliated Hospital of Guangzhou Medical University between February 2013 and February 2014 were included in the study, and divided into the smoking group and non-smoking group (n=20 each). The general demographic data, pulmonary function, and serum HMGB1 and sRAGE expression levels in the 40 subjects were collected and statistically analyzed.Results: The serum sRAGE expression level in the smoking group was lower than that in the non-smoking group; the serum HMGB1 expression level was significantly correlated with lung function, but this correlation was only found in smokers.Conclusion:Serum sRAGE expression level decreases in patients with no respiratory symptoms and lung function changes. Before development of COPD, serum HMGB1 and sRAGE expression levels may be used as indicators of lung function assessment in smokers.
HMGB1; sRAGE; smokers with normal lung function; clinical significance
10.3969/j.issn.2095-9664.2015.05.004
广东省科技计划项目(No.00666930170696095)
吴冬霞(1982-),女,主治医师,硕士 。
R563.9
2095-9664(2015)05-0016-04
2014-11-09)
研究方向:慢性阻塞性肺疾病。
*通讯作者:E-mail:13802525927@139.com

