大麻素WIN55,212-2对裸小鼠肝癌移植瘤及PPARγ表达的影响
邓远斐 许达才 肖顺华 赵 青*
(1广州医科大学生物化学与分子生物学教研室,广东 广州 510182; 2江苏建康职业学院药学系生化教研室,江苏 南京 211800)
·论著·
大麻素WIN55,212-2对裸小鼠肝癌移植瘤及PPARγ表达的影响
邓远斐1许达才1肖顺华2赵 青1*
(1广州医科大学生物化学与分子生物学教研室,广东 广州 510182;2江苏建康职业学院药学系生化教研室,江苏 南京 211800)
目的:探讨大麻素WIN55,212-2(WIN) 对裸小鼠肝癌移植瘤及过氧化物酶体增殖物激活受体(PPARγ)、c-myc表达的影响。方法:采用5 mg/kg的WIN对荷瘤裸小鼠进行瘤周皮下注射干预15 d,每3天测量1次瘤体体重和体积,计算肿瘤体积和抑瘤率。荧光定量PCR和Western blotting测定HepG2移植瘤中PPARγ和c-myc的表达情况。结果:WIN对HepG2细胞移植瘤具有抑制作用,抑瘤率为66.00%,荧光定量PCR结果显示WIN抑制HepG2细胞移植瘤c-myc在mRNA水平的表达,促进HepG2细胞移植瘤PPARγ在mRNA水平表达。Western blotting 结果显示WIN抑制HepG2细胞移植瘤c-myc在蛋白水平的表达,促进HepG2细胞移植瘤PPARγ在蛋白水平表达。结论:WIN能够抑制HepG2细胞移植瘤的生长和c-myc的表达,并上调PPARγ的表达。
大麻素;WIN55,212-2;肝癌细胞;移植瘤;c-myc; PPARγ
大麻系统由大麻类物质(cannaboids)及大麻素受体(cannabinoid receptor 1 and 2,CB1/2)组成,大麻类物质主要有天然的△9-四氢大麻酚(△9-tetrahydrocannbinol,THC)、人工合成的大麻素WIN和内源性大麻素AEA及JWH等。THC、JWH-015在HepG2和Huh7细胞中上调过氧化物酶体增殖物激活受体γ(peroxisome proliferactor-activated receptor gamma, PPARγ)表达,进而发挥抗肿瘤作用[1]。国外研究报道, WIN能激活PPARγ通路诱导HepG2细胞凋亡[2];本实验室则发现, WIN能活化肝癌细胞PPARγ,抑制下游基因c-myc表达,进而抑制细胞的增殖、诱导其凋亡[3-5]。但大麻素WIN在体内对HepG2移植瘤的作用及机制尚未见报道。本研究主要探讨大麻素WIN对HepG2移植瘤生长的影响及可能的机制。
PPARγ在调节细胞生长、促进凋亡和抑制肿瘤发生、发展方面已越来越受到重视[6],而PPARγ及其配体是今后肿瘤治疗的新靶点已成共识。但是, 目前大多数研究尚停留在细胞分子水平[7], 而对肝癌癌体内作用的研究更未见报道。本实验旨在探讨WIN在肝癌裸小鼠移植瘤内对PPARγ及其下游分子 c-myc的调控作用, 为进一步的临床试验打下基础。
1 材料与方法
1.1 材料
二氧化碳培养箱(美国Thermo公司),多功能多色荧光成像系统(型号:VersaDoc MP 4000,美国 BIO-RAD公司)。BALB/c雄性裸鼠购自广东省医学实验动物中心,SPF级别,6周龄,体质量18~20 g;PPARγ一抗购自美国Thermo公司;β-actin一抗、c-myc一抗购自proteintech group;SYBR®PremixExTaqTM(Tli RNaseH Plus)、PrimeScript®RT-PCR Kit试剂盒购自日本TaKaRa;二亚基甲砜(dimethyl sulfoxide,美国DMSO)、大麻素WIN、Cremophor购自美国Sigma;RIPA裂解液(中)购自上海碧云天。荧光定量PCR的引物由上海生工生物工程有限公司合成,GAPDH的正向引物:5′-TGGAGAAGGCTGG GGCTCATTT-3′,反向引物:5′-TGGTGCAGGAGGCAT TGCTGAT-3′;c-myc的正向引物:5,-AGCGACTCT GAGGAGGAACAAG-3′,反向引物:5′-GTGGCACCT CTTGAGGACCA-3′;PPARγ的正向引物:5′-CCGTGGCCGCAGATTTGAAAGA-3′,反向引物:5′-AAGTTGGTGGGCCAGAATGGCA-3′。
1.2 方法
1.2.1 成瘤模型的建立 HepG2细胞于5%CO2、37 ℃培养箱中培养,取对数生长期的HepG2细胞,胰酶消化,PBS洗涤2次,用无血清的RPMI-1640培养基重悬细胞,计数,调整细胞密度为1×107个/mL。15只BALB/c裸鼠,随机分成两组:成瘤组(n=12)和空白组(n=3)。成瘤组每只裸鼠接种HepG2细胞悬液100 μL(即细胞数为1×106个)于腹右侧;空白组每只裸鼠在腹右侧注射100 μL不含HepG2细胞的无血清RPMI-1640培养基。裸鼠接种HepG2细胞4 d后,分别用游标卡尺和天平测量肿瘤体积和裸鼠体重,每3天测量1次,成瘤过程中要密切关注裸鼠的饮食、活动情况。瘤块体积的计算公式:V=a×b2×3.14/6(a为长径,b为短径)。
1.2.2 大麻素WIN对HepG2移植瘤的影响 称量0.002 g WIN粉末溶解于100 μL DMSO中,配制成WIN溶液,按照WIN溶液体积∶Cremophor体积∶生理盐水体积=1∶3∶6配制WIN注射液,而 DMSO注射液中用DMSO代替WIN溶液,其余成分不变。裸鼠接种HepG2细胞15 d后,把成瘤组裸鼠随机分成两组:WIN组(n=6)、对照组(n=6)。每天在WIN组瘤旁皮下注射WIN注射液,剂量为 5 mg/kg;对照组及空白组注射等体积DMSO注射液。连续注射15 d,每3天测量体重和瘤块体积。颈椎脱臼处死小鼠,剥出完整瘤块,称量瘤块的质量,计算药物WIN的抑瘤率,抑瘤率=(对照组平均瘤重-WIN组平均瘤重)/对照组平均瘤重×100%。
1.2.3 荧光定量PCR技术检测肿瘤组织c-myc、PPARγ mRNA的表达 提取WIN组和对照组瘤块的总RNA,按照试剂盒要求操作。定量PCR采用的体系为20 μL,反应条件:①95℃ 10min(循环数为1);②95 ℃ 5 s,60 ℃ 34 s(循环数为40);③95 ℃ 1 min,60 ℃ 30 s,95 ℃ 30 s(循环数为1)。荧光定量PCR结果判定:△Ct=Ct目的基因-Ct内参,△△Ct=△Ct处理组-△Ct对照组,RQ(Relative Quantitation)处理组=2-△△Ct,其中对照组RQ值设为1。以GAPDH为内参,依据2-△△CT法计算各mRNA的相对表达量。
1.2.4 Western blotting检测肿瘤组织中c-myc、PPARγ蛋白的表达 提取WIN组及对照组瘤块的蛋白质,SDS-聚丙烯酰胺凝胶电泳分离蛋白,然后将蛋白转移至PVDF膜,转膜后用脱脂奶粉在室温下封闭1 h,以一抗在4 ℃孵育过夜。孵育一抗后洗膜3次,以二抗在室温下孵育1 h,洗膜3次后进行ECL化学发光检测,在多功能多色荧光成像系统中拍照记录。
1.3 统计学分析
应用SPSS 13.0统计软件进行分析。计量资料以表示,多组比较采用单因素Dunnett方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 各组裸鼠的致瘤率
WIN组及对照组裸鼠均于接种HepG2细胞4 d后明显成瘤,移植瘤模型成功建立,各组裸鼠致瘤率均为100%,无显著差异。
2.2 大麻素WIN对裸鼠移植瘤生长的抑制作用
从模型建立至第15天,各组肿瘤体积无显著差异,第16天起(即开始用WIN处理的第1天),WIN组的皮下移植瘤生长速度显著慢于对照组(P<0.05),见图1;WIN组皮下移植瘤体积和重量均显著小于对照组(P<0.05),见表1和图2。WIN对肝癌HepG2裸鼠移植瘤有较明显的生长抑制作用,且WIN对裸鼠移植瘤的抑瘤率为66.00%,见表1。
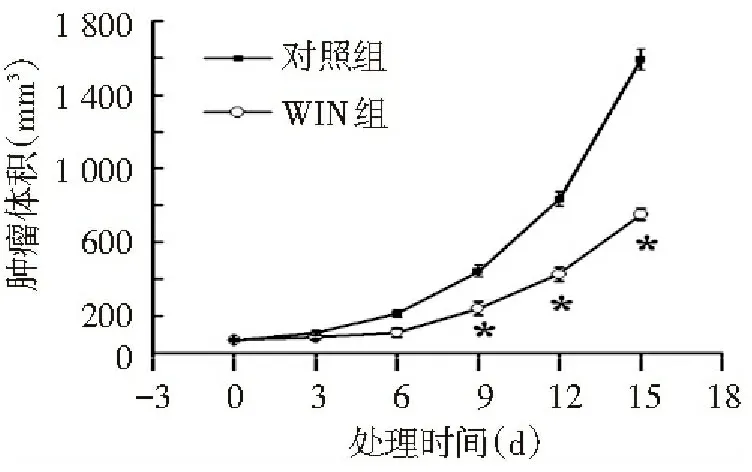
注:与对照组比较,*P<0.05
图1 WIN对HepG2移植瘤生长曲线的影响

表1 WIN对人肝癌细胞HepG2移植瘤的影响
注:与对照组比较,*P<0.05

注:A:实验分组;B:成瘤组裸鼠HepG2移植瘤大小
图2 各实验组裸鼠HepG2移植瘤的大小
2.3 WIN抑制HepG2移植瘤中c-myc mRNA表达及上调PPARγ mRNA表达
荧光定量PCR的结果显示, WIN组c-myc mRNA表达水平低于对照组,WIN抑制了c-myc mRNA的表达(P<0.05),具有下调作用;WIN组PPARγ mRNA表达水平高于对照组(P<0.05),促进了PPARγ mRNA的表达,具有上调作用,见图3,4。
2.4 大麻素WIN抑制HepG2移植瘤c-myc蛋白表达,上调PPARγ蛋白表达
Western blotting结果显示,c-myc蛋白在WIN组中的表达水平比对照组低,而PPARγ蛋白在WIN组中的表达水平比对照组高,见图5。用Quantity One软件计算各条带的灰度值,结果显示,WIN抑制了c-myc蛋白的表达,具有下调作用(P<0.05),而促进了PPARγ蛋白的表达,具有上调作用(P<0.05),见图5。
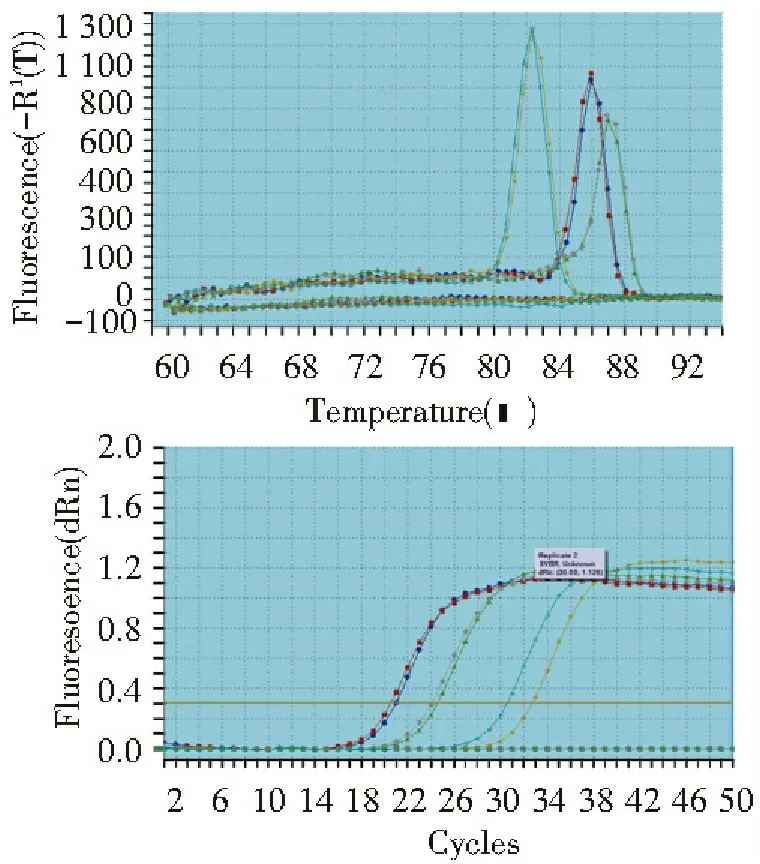
图3 WIN对HepG2移植瘤 c-myc、PPARγ mRNA熔解曲线(上)、扩增曲线(下)的影响
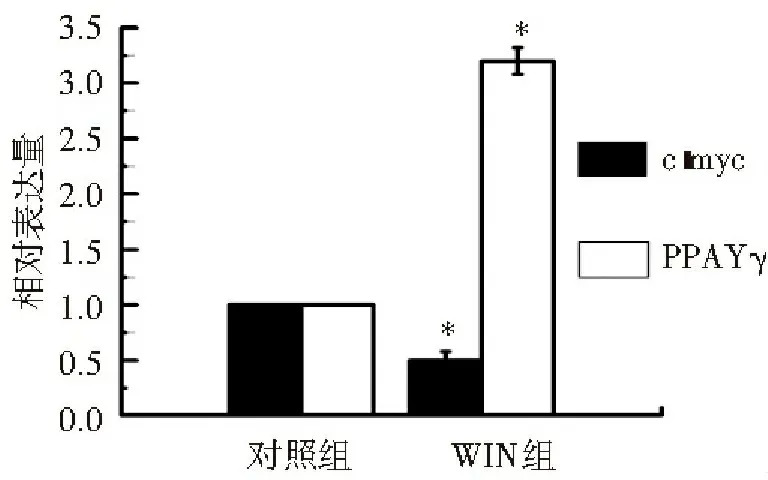
图4 WIN对HepG2移植瘤 c-myc、PPARγ mRNA表达的影响
注:对照组比较,*P<0.05
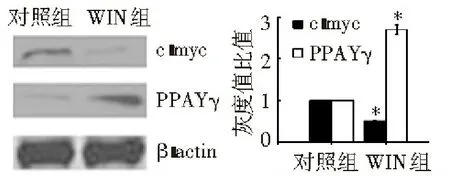
注:对照组比较,*P<0.05
图5 WIN对HepG2移植瘤中c-myc和>PPARγ蛋白表达的影响
3 讨 论
大麻早在几个世纪前就作为草药,用来治疗疾病,大麻类药物具有止痛、镇静、抗痉挛、抗呕吐、抗青光眼、抗惊厥等药理作用。近年来,大麻类药物的抗肿瘤作用倍受关注[8]。天然大麻素由于依赖性、成瘾性强,往往在化疗的同时产生较严重的不良反应,如精神依赖性,而人工合成大麻素WIN的依赖性、成瘾性弱,具有抗肿瘤药物的潜能[9]。
研究表明,植物大麻素及内源性大麻素在不同的肿瘤细胞株中发挥抗增殖和诱导凋亡的作用[10-14],这激起了科学工作者对合成大麻素生物活性研究的兴趣,也表明了大麻素WIN是一种有前途的药物。在最近的研究中,本组首先发现大麻素WIN以浓度依赖性和时间依赖性的方式抑制BEL7402肝癌细胞增殖并且诱导其凋亡,本组还发现大麻素WIN的促凋亡作用能够被PPARγ拮抗剂GW9662减弱,这表明PPARγ介导WIN所诱导的凋亡作用[3]。众所周知,大麻素WIN是大麻素受体CB1/CB2激动剂。PPARγ是核激素受体超家族的配体激活的转录因子。本组的前期研究发现,在BEL7402肝癌细胞中,WIN显著上调PPARγ的表达,但CB2受体选择性拮抗剂AM630能够阻断WIN的这种诱导作用,表明CB2介导WIN对PPARγ诱导的表达。凝胶电泳结果显示,WIN可促进该细胞中PPARγ与DNA结合,这进一步说明WIN通过激活PPARγ来调控细胞增殖、凋亡相关基因的表达。实际上,WIN以时间依赖性的方式抑制重要癌基因c-myc的表达,而PPARγ拮抗剂GW9662能够阻断这种抑制作用。总之,本组前期研究结果表明,WIN能够通过线粒体caspase信号通路及PPARγ的介导来抑制肝癌细胞的增殖、诱导其凋亡,但在体内WIN是否能够抑制肝癌的增殖尚未见报道。
PPARγ是由配体激活的核转录因子, 为核激素受体超家族中的成员。许多研究表明, 在人类的多种肿瘤细胞中均存在PPARγ的表达, 如肝癌、胃癌、乳腺癌、结肠癌、肺癌、脂肪肉瘤及前列腺癌等, 并对细胞增殖、分化及凋亡具有调节作用。国内外已有大量研究证实,PPARγ配体能上调PPARγ的表达[7], 而此结论在本组前期细胞水平的研究结果中也得到证实[3]。但在体内WIN是否能够通过PPARγ的介导来抑制肝癌细胞的增殖尚未见报道。本研究观察到WIN能上调核受体PPARγ的表达, 抑制了c-myc的表达,并显现出良好的抗肿瘤活性,结合前期体外研究结果,本组推测,WIN可能是通过激活核受体来实现其抗肿瘤活性的。
WIN能够抑制肝癌细胞移植瘤生长,此效应可能与WIN上调PPARγ的表达水平,进而下调c-myc的表达水平有关。其机制有待于进一步研究。随着研究的深入, PPARγ必将成为肿瘤治疗的新切入点, 而WIN也将成为肝癌治疗的新选择。
[1] Vara D, Morell C, Rodríguez-Henche N, et al. Involvement of PPARγ in the antitumoral action of cannabinoids on hepatocellular carcinoma[J]. Cell Death Dis,2013,4(5):e618.
[2] Michela G, Ornella P,Patrizia P, et al. Apoptosis induced in HepG2 cells by the synthetic cannabinoid WIN:Involvement of the transcription factor PPARgama [J]. Biochimie, 2009, 91(4):457-465.
[3] Hong YH, Zhou YT, Wang Y, et al. PPARγ mediates the effect of WIN55, 212-2, an synthetic cannabinoid, on the proliferation and apoptosis of the BEL7402 hepatocarcinoma cells [J]. Mol Bio Rep, 2013, 40(11):6287-6293.
[4] 王 映, 周于婷, 赵 青. 大麻受体激动剂WIN-55,212-2对肝癌细胞HepG2增殖和凋亡的影响[J]. 细胞与分子免疫学杂志, 2010, 26(4):344-347.
[5] 朱晓琴,周于婷,陈新美,等.大麻受体激动剂THC抑制肝癌细胞HepG2增殖和诱导其凋亡的实验研究[J].华中科技大学学报:医学版,2010,39(3):376-380.
[6] 夏学巍,苏长保.PPARγ受体激动剂抗肿瘤作用机制研究进展[J].基础医学与临床, 2005,25(12):1109-1113.
[7] Paniqrahy D, Huanq S, Kieran MW, et al. PPARgama as a therapeutic target for tumor angiogenesis and metastasis [J].Cancer Biol Ther, 2005, 4(7):687-693.
[8] Cridqe BJ, Rosenqren RJ. Critical appraisal of the potential use of cannabinoids in cancer management[J]. Cancer Manaq Res, 2013, 5:301-313.
[9] Amchova P, Kucerova J, Giuqliano V, et al. Enhanced self-administrantion of the CB1 receptor agonist WIN55, 212-2 in olfactory bulbectomized rats:evaluation of possible serotonergic and dopaminergic underlying mechanism[J]. Front Pharmacol, 2014, 5:44.
[10] Hermanson DJ, Marnett LJ. Cannabinoids, endocannabinoids, and cancer[J]. Cancer Metastasis Rev, 2011, 30(3-4):599-612.
[11] Calvaruso G, Pellerio O, Notaro A, et al. Cananbinoid-associated cell death mechanism in tumor models [J]. Int J Oncol, 2012, 41(2):407-413.
[12] Pertwee RG. Receptors and channels targeted by synthetic cannabinoid receptor agonists and antagonist[J].Curr Med Chem, 2010, 17(14):1360-1381.
[13] Pertwee RG. Pharmacological actions of cannabinoids[J]. Handb Exp Pharmacol, 2005, (168):1-51.
[14] Kumar RN, Chambers WA, Pertwee RG. Pharmacological actions and therapeutic uses of cannabis and cannabinoids [J]. Anaesthesia, 2001, 56(11):1059-1068.
(本文编辑:张辉)
·医学新闻·
我国3D打印髋关节进入“量产”时代
据科技日报报道,我国首个3D打印人体植入物——人工髋关节产品获得国家食品药品监督管理总局注册批准。该产品也是国际上首个通过临床验证后获得注册的3D打印人工髋关节假体,标志着我国3D打印植入物已迈进产品化阶段。
本次获得注册的人工髋关节产品属于三类骨科植入物,是我国监管等级最高的医疗器械产品,是由北京大学第三医院骨科张克、刘忠军、蔡宏医生和国内最大的人工关节生产企业——北京爱康宜诚医疗器材股份有限公司合作研制的。
2009年,北京大学第三医院骨科关节组负责人张克教授带领骨科关节组团队将3D打印技术引入骨科,历经3年,研制出我国首个3D打印人工髋关节产品。该产品的临床观察工作由北京大学第三医院牵头,联合北京积水潭医院、北京大学人民医院、山东大学第二医院和武汉普爱医院共同完成。2012年6月至今,共有32位患者接受了3D打印人工髋关节手术,临床观察效果良好。
曾主刀完成世界首例应用3D打印技术人工定制枢椎治疗寰枢椎恶性肿瘤的北京大学第三医院骨科主任刘忠军教授指出,该产品的注册成功,为患者提供了使用先进技术治疗病痛的有效手段;产品国产化后将打破国外产品对高端市场的垄断,大大降低价格,为患者节约大笔医疗支出;对推动整个3D打印产业链的发展具有里程碑意义。
刘忠军坦言,此次审批注册成功,意味着3D打印植入物得到了认可,为同类产品获批开辟了先河。后续研制的同类产品也有望加速获到审批。
Effect of cannabinoid WIN55,212-2 on HepG2 tumor xenograft and PPAR-γ expression in nude mice
DengYuanfei1,XuDacai1,XiaoShunhua2,ZhaoQing1*
(1DepartmentofBiochemistryandMolecularBiology,GuangzhouMedicalUniversity,Guangzhou510182;2DepartmentofBiochemistry,FacultyofPharmacy,JiangsuJiankangVocationalCollege,Nanjing211800,Jiangsu,China)
Objective:To investigate the effect of a cannabinoid, WIN55,212-2 (WIN), on HepG2 hepatocellular carcinoma xenografts and expression of peroxisome proliferators activated receptor (PPAR-γ) and c-myc in nude mice. Methods :The tumor-bearing nude mice were injected subcutaneously around the tumor sites with 5 mg/kg WIN for 15 d. The weight and size of the tumor were measure every 3d for calculation of the tumor volume and tumor inhibition rate. PCR and western blotting assay were used to measure the expression of PPAR-γ and of c-myc in HepG2 tumor xenograft. Results:WIN showed inhibitory effect on the growth of HepG2 tumor xenograft, with an inhibition rate being 66.00%. Fluorescence quantitative PCR showed that WIN inhibited the expression of c-myc mRNA and promoted the expression of PPAR-γ mRNA in HepG2 tumor xenografts. Western blotting analysis showed that WIN inhibited the expression of c-myc proteins and promoted the expression of PPAR-γ proteins in HepG2 tumor xenografts. Conclusion:WIN may inhibit the growth of HepG2 tumor xenograft and c-myc expression, and upregulate the expression of PPAR-γ.
cannabinoid; WIN55,212-2; hepatocarcinoma cell; tumor xenograft; c-myc; PPAR-γ
10.3969/j.issn.2095-9664.2015.05.001
国家自然科学基金(81372466)
邓远斐(1990-),女,硕士,助理研究员。
R735.7
2095-9664(2015)05-0001-05
2014-12-22)
研究方向:恶性肿瘤分子靶向治疗研究工作。
*通讯作者:E-mail:zhaoqing66@yahoo.com

