恩替卡韦对乙型肝炎肝硬化患者血清sTRAIL的影响及疗效分析
陈典颜 林 丹 刘三都
(1黔南州人民医院,贵州 都匀 558000 ;2海南医学院附属医院,海南 海口570100)
·临床研究·
恩替卡韦对乙型肝炎肝硬化患者血清sTRAIL的影响及疗效分析
陈典颜1林 丹2*刘三都1
(1黔南州人民医院,贵州 都匀 558000 ;2海南医学院附属医院,海南 海口570100)
目的:探讨HBV感染导致肝硬化的过程中可溶性肿瘤坏死因子相关凋亡诱导配体(sTRAIL)介导的免疫损伤及恩替卡韦通过影响sTRAIL及抑制HBV-DNA复制,延缓或阻止乙型肝炎肝硬化发展的作用。方法:选取2013年1月至2014年1月海南医学院附属医院中医科乙型肝炎肝硬化患者40例为治疗组,健康体检者45例为对照组。治疗组予恩替卡韦(0.5 mg,每日一次)口服,疗程48周。两组患者分别于治疗前、治疗12、24、48周使用ELISA检测血清中sTRAIL水平,RT-PCR检测血清中HBV-DNA载量的变化,全自动生化分析仪检测肝功能,全自动血凝仪检测凝血酶原时间。同时在治疗组中随机选取16例患者,Child-Pugh分级分别为A级6例,B级5例,C级5例,于恩替卡韦治疗前及治疗24周时进行肝脏穿刺组织病理检查。结果:治疗组治疗前sTRAIL、HBV DNA及ALT水平均高于健康对照组,差异有统计学意义(P<0.05);经线性相关分析,治疗组患者血清sTRAI与ALT含量呈显著正相关(r=0.736,P=0.000),血清sTRAIL与HBV-DNA载量无相关性(r=-0.0127,P=0.382)。恩替卡韦治疗后,治疗组血清sTRAIL水平下降,ALT恢复正常,HBV-DNA载量降低,肝脏组织病理学改善,与治疗前比较,差异有统计学意义(P<0.05)。结论:sTRAIL介导乙型肝炎肝硬化患者肝脏的免疫损伤过程。经恩替卡韦治疗后sTRAIL与ALT降低, HBV-DNA复制抑制,肝脏组织病理学改善,从而延缓或阻止肝硬化的发展。在恩替卡韦抗病毒过程中动态监测sTRAIL的变化有助于肝硬化预后的判断。
乙型肝炎肝硬化;可溶性肿瘤细胞坏死因子相关凋亡诱导配体(sTRAIL);恩替卡韦;疗效分析
肿瘤坏死因子超家族的成员之一可溶性肿瘤坏死因子相关凋亡诱导配体(sTRAIL)又称凋亡素2配体(Apo-2L),TRAIL是TNF超家族的凋亡分子,其特异性诱导转化细胞,肿瘤细胞和病毒感染细胞发生凋亡,不造成正常组织细胞凋亡[1]。在乙型肝炎肝硬化的发病机制中sTRAIL介导的肝脏免疫损伤作用成为关注的热点。本研究通过分析乙型肝炎肝硬化患者血清中sTRAIL与HBV-DNA、ALT相关性,揭示HBV感染导致的肝硬化过程中sTRAIL的免疫介导作用;同时评价恩替卡韦对乙型肝炎肝硬化的疗效及其对血清中sTRAIL的影响情况,为进一步的临床研究提供依据。
1 资料与方法
1.1 研究对象
选取2013年1月至2014年1月海南医学院附属医院消化内科乙型肝炎肝硬化患者40例为治疗组,其中男21例,女19例,平均年龄41±6岁。乙型肝炎肝硬化诊断符合2010年《慢性乙型肝炎防治指南》[2]的诊断标准。其中按照病理诊断16例,临床诊断4例,B超诊断20例。治疗组予恩替卡韦(0.5 mg,口服,一日一次);如有转氨酶增高予六味五灵片(1.5,口服,一日三次);如有胆红素升高予丁二磺酸腺苷蛋氨酸片(500mg,口服,一日三次)。观察疗程48周。治疗组在观察过程中均无失访、死亡和停药。在48周的治疗过程中未见副作用出现。选取健康体检者45例为对照组,男22例,女23例,平均年龄43±5岁,所有血清肝功能正常,各型肝炎病毒学指标阴性。
1.2 方法
1.2.1 血清中sTRAIL含量检测 晨起空腹抽血6 mL离心分离血清,用酶联免疫吸附试验(ELISA)法检测标本的sTRAIL。sTRAIL试剂盒购自BlueGene上海蓝基生物科技有限公司。各操作过程严格按说明书操作。由海南医学院附属医院中心实验室完成。
1.2.2 HBV-DNA检测 采用RT-PCR技术检测HBV-DNA载量,该过程完成于海南医学院附属医院中心实验室。
1.2.3 肝功能检测及凝血酶原时间检测 采用全自动生化分析仪对治疗组及对照组进行肝功能测定,用全自动血凝仪检测凝血酶原时间该步骤由海南医学院附属医院中心实验室完成。
1.2.4 肝脏穿刺活体组织检查 在充分与患者及家属沟通的基础上,经患者及家属同意对16例患者行CT引导下肝脏穿刺活体组织检查术。详细观察并记录两组患者治疗前后Child-Pugh 分级、肝脏组织病理学炎症活动、纤维化分期变化,分类标准[3]见表1、表2。
1.2.5 B超 上腹部B超由海南医学院附属医院超声中心完成。
1.3 统计学处理
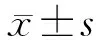
2 结 果
2.1 对照组与治疗组治疗前sTRAIL、HBV-DNA、ALT的水平比较
本研究观察对照组45例,治疗组40例,分别检测血清中sTRAIL的,同时观察其与血清HBV-DNA和ALT之间的关系,发现治疗组sTRAIL水平高于对照组(P<0.05),差异有统计学意义。见表3。
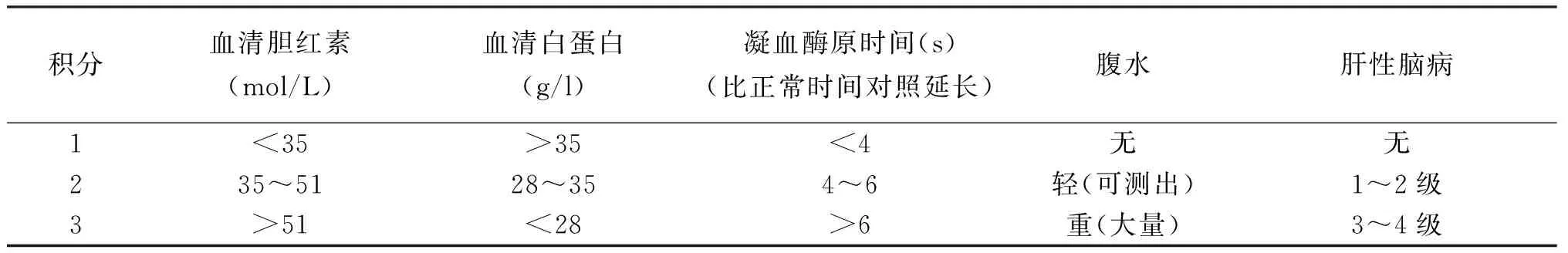
表1 CTP评分标准
注:Child-Pugh分级:A 5~6;B 7~9;C>9

表2 肝脏组织病理学炎症活动、纤维化分期标准

表3 两组治疗前血清sTRAIL、HBV-DNA及ALT的含量比较
注:与对照组比较,*P<0.05。
2.2 治疗组sTRAIL、HBV-DNA、ALT的相关性分析结果
血清中sTRAIL与HBV-DNA血清载量无相关性(r=-0.0127,P=0.382);血清中sTRAIL与ALT血清含量呈显著正相关(r=0.736,P=0.000<0.05),即患者血清中ALT水平越高,血清中sTRAIL的水平也越高。
2.3 治疗组治疗前后sTRAIL和ALT的变化
经恩替卡韦治疗后,sTRAIL含量在治疗4、12周时逐渐下降,在治疗24及48周时含量较治疗12周上升但低于治疗前水平。各时间点分别与治疗前比较差异有统计学意义(P<0.05)。ALT水平随治疗时间的延长均较治疗前下降,差异有统计学意义(P<0.05)。见表4。
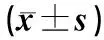
表4 治疗组各时间点血清中sTRAIL、ALT水平的比较
注:与治疗前比较,*P<0.005。
2.4 治疗组各时间点HBV-DNA载量变化情况
在各时间点检测HBV-DNA载量较治疗前下降,HBV-DNA载量于第4周时较治疗前下降,24、48周时基本达到检测低限值。见表5。

表5 治疗组各时间点HBV-DNA载量的变化
注:治疗前比较,*P<0.005。
2.5 恩替卡韦治疗前治疗组患者肝脏组织病理学检查情况
炎症活动情况G1期占6.3%,G2~G4期占93.7%;纤维化分期S1期占25%,S2~S5期占75%。见表6。
2.6 恩替卡韦治疗24周后治疗组患者肝脏组织病理学情况
经恩替卡韦治疗24周后,G0期患者由治疗前的0%增加为6.25%,G4期患者由治疗前25%下降到18.8%;S0期患者由治疗前0%提高到25%,S3期由31.2%减低到12.5%,S4期由12.5%减少到0%;2例Child-Pugh分级为B级的患者也进步为A级,提示恩替卡韦可有效控制乙型肝炎肝硬化患者肝细胞的炎症活动,减轻纤维化程度,见表7、图1。

表6 治疗组患者治疗前病理学(%)情况

表7 治疗组患者经恩替卡韦治疗24周后病理学(%)情况

注:A:治疗前;B:治疗24周后
图1 经恩替卡韦治疗前后乙型肝炎肝硬化患者肝组织H-E染色(×100)
3 讨 论
我国现有慢性乙型肝炎患者2000万例,属于HBV感染的高发区,每年因HBV导致的肝硬化及肝癌死亡约30余万例[4],慢性乙型肝炎及其导致的肝硬化在相当长的一个时期内危害人民的健康。因此,阻止肝硬化的发展,改善患者的生活质量显得尤为重要。
乙型肝炎肝硬化的发病机制极其复杂,至今尚未明确。目前认为在病毒清除、肝细胞损伤及慢性化过程中细胞免疫起重要作用[5]。HBV感染机体后可激活机体的免疫监视功能,使许多免疫分子参与清除HBV感染的肝细胞的免疫反应中如sTRAIL。
sTRAIL受体有5种,参与凋亡反应的受体是DR4及DR5、DcR1和DcR2。sTRAIL与受体DR4及DR5结合可诱导特异性免疫,杀伤HBV感染的肝细胞,而对未感染的肝细胞无影响。有研究表明,HBV感染人肝细胞后,细胞内的HBV复制增加,sTRAIL诱导的凋亡作用随之增强[6]。在乙型肝炎肝硬化患者中,sTRAIL作为免疫监视分子即可及时清除HBV,又可杀伤靶细胞,进而使肝脏的损伤进一步加重[7]。
本研究显示,乙型肝炎肝硬化患者血清中sTRAIL的含量明显增加,直线相关性分析发现sTRAIL与ALT血清含量呈显著正相关(r=0.736,P=0.000),而sTRAIL与HBV-DNA血清载量无相关性(r=-0.0127,P=0.382),提示sTRAIL是重要的免疫监视分子,在HBV侵入机体后反应性增高,加速将HBV清除出体外,诱导感染的肝细胞凋亡。经恩替卡韦治疗后,sTRAIL血清中的含量在治疗4、12周逐渐下降,在治疗24及48周时较治疗12周时有所上升但仍低于治疗前水平,各时间点分别与治疗前比较差异有统计学意义(P<0.05)。在治疗的24及48周时出现了平台期,这一现象间接证明了HBV的转染能使靶细胞逃脱免疫监视分子即sTRAIL的杀伤作用,使sTRAIL表达下调,导致HBV感染迁延不愈,发展为肝硬化甚至肝癌的致病机理之一[8],同时,恩替卡韦和sTRAIL都有清除HBV的作用,二者之间可能有协同作用从而下调了sTRAIL受体表达,使血清中sTRAIL含量下降。
对于乙型肝炎肝硬化患者病情的评价及预后的判断目前最具代表性的指标主要是:ALT、HBV-DNA及肝组织学改善情况。本研究显示:随着恩替卡韦治疗时间的延长ALT及HBV-DNA均较治疗前明显下降,差异有统计学意义(P<0.05)。ALT至治疗24周时达到正常值;HBV-DNA在治疗48周时已接近检测低值。HBV-DNA及ALT下降情况直接反映患者对抗病毒药物的应答情况,抗病毒治疗过程中病毒复制持续时间越长,则发生病毒耐药和反弹的风险越高,治疗效果越差[9]。sTRAIL水平能敏感地反映患者的肝脏损伤程度,动态监测sTRAIL的变化有助于对乙型肝炎肝硬化预后的判断。
乙型肝炎肝硬化的病理特点主要是汇管区扩大,胶原纤维沉积,纤维间隔增厚,肝细胞炎症坏死,在此基础上,正常小叶结构消失,代之以纤维包绕的异常肝细胞结节,期间的肝细胞可表现为不同程度的变性、坏死和再生,肝内血管解剖结构的破坏,形成假小叶[10-11]。本研究显示,经恩替卡韦治疗的40例乙型肝炎肝硬化患者,2例Child-Pugh分级为B级的患者也进步为A级。对于16例自愿行肝穿刺病理检查的患者在治疗24周时再行肝穿刺检查显示肝脏炎症活动及纤维化程度都有改善,说明乙型肝炎肝硬化的病因是HBV,抑制病毒的复制是延缓或阻止乙型肝炎肝硬化发展至关重要的治疗措施,值得临床进一步观察应用。由于样本量少及观察周期短无法进行统计分析,然而肝穿刺作为诊疗的金标准对疗效的评估及预后的判断仍很有意义。
综上所述,sTRAIL介导乙型肝炎肝硬化患者肝脏的免疫损伤过程。经恩替卡韦治疗后sTRAIL与ALT降低,抑制HBV-DNA复制,肝脏组织病理学改善,从而延缓或阻止肝硬化的发展。在恩替卡韦抗病毒过程中动态监测sTRAIL的变化有助于肝硬化预后的判断。
[1] Webster GL, Reignat S, MainiMK, et al. Incubation phase of acute hepatitis B in man:dynamic of cellular immune mechanisms[J]. Hepatology, 2009, 32(5):1117-1124.
[2] 中华医学会肝病学分会, 感染病学分会.慢性乙型肝炎防治指南[J]. 中华肝脏病杂志,2011, 19(1):13-24.
[3] 姚光弼. 临床肝脏病学第二版[M]. 上海:上海科学技术出版社, 2011:720.
[4] 庄 辉, 李 杰. 《慢性乙型肝炎防治指南(2010年版)》解读:乙型肝炎流行病学及预防[J]. 中国病毒病杂志, 2011, 1(5):325-328.
[5] 耿书英, 陈金军, 万铁林, 等. 核苷类似物治疗HbeAg阳性慢性乙型肝炎完全应答患者的病毒学特点[J].临床肝脏病杂志, 2009, 25(3):177-179.
[6] Yang Y, Zheng L, Lv G, et al. Hepatocytes treated with HBV X protein as cytotoxic effectors kill primary hepatocytes by TNF-alpha-related apoptosis-induced ligand-mediated mechanism[J].Intervirology 2007, 3(6):323-327.
[7] Janssen HL, Higuchi H, Abdulkarim A, et al. Hepatitis B virus enhances tumor necrosis factor-related apoptosis-inducing ligand(TRAIL) cytotoxicity by increasing TRAIL-R1/death receptor 4 expression [J].Hepatology, 2003, 2(5):414-420.
[8] 韩丽辉, 孙文生, 马春红, 等. 乙型肝炎病毒对肿瘤坏死因子相关凋亡诱导配体诱导凋亡的影响及其机制[J]. 中华医学杂志, 2002, 5(82):597-599.
[9] 虞作春, 蒋卫民, 尹有宽, 等. 核苷类似物治疗慢性乙型肝炎快速应答良好和快速应答不良患者的病毒学应答比较[J]. 中华传染病杂志, 2008, 26(2):103-104.
[10] 姚光弼. 临床肝脏病学第二版[M]. 上海:上海科学技术出版社, 2011:318.
[11] 萧树东, 许国铭. 中华胃肠病学第二版[M]. 北京:人民卫生出版社, 2008:622.
(本文编辑:王馨)
Effects of Entecavir on serum sTRAIL in patients with hepatitis B virus-related cirrhosis
ChenDianyan1,LinDan2,LiuSandu1
(1QiannanPrefecturalPeople′sHospital,Duyun,Guizhou558000;2AffiliatedHospitalofHainanMedicalCollege,Haikou,Hainan570100,China)
Objective:To investigate the soluble tumor necrosis factor related apoptosis induced ligand (sTRAIL) mediated immune injury, and the effects of Entecavir on delaying or preventing hepatitis B virus (HBV)-related cirrhosis by affecting sTRAIL and inhibiting HBV-DNA replication in the process of HBV infection caused cirrhosis.Methods :Forty patients with HBV-related cirrhosis hospitalized in the Department of Traditional Chinese Medicine, Affiliated Hospital of Hainan Medical College between January 2013 and January 2014 were included in the treatment group, and 45 healthy subjects were included in the control group. The treatment group received oral Entecavir (0.5 mg, once daily) for 48 weeks. We determined serum sTRAIL level by ELISA, serum HBV-DNA load by RT-PCR, liver function by automatic biochemical analyzer, and prothrombin time by automatic blood coagulation analyzer at baseline, 12, 24 and 48 weeks after treatment in both groups, respectively. At the same time, 6 patients with Grade A, 5 with Grade B, and 5 with Grade C Child-Pugh staging in the treatment group (n=16) were randomly selected for pathological examination of liver biopsy at baseline and 24 weeks after treatment.Results: The sTRAIL, HBV-DNA and alanine aminotransferase (ALT) levels at baseline in the treatment group were higher than those in the control group, and the difference was statistically significant (P<0.05). According to linear correlation analysis, there was significantly a positive correlation between the serum sTRAIL and the ALT content(r=0.736,P=0.000), but no correlation between serum sTRAIL and HBV-DNA load (r=-0.0127,P=0.382). After Entecavir treatment, decreased serum sTRAIL level, recovered ALT level, reduced HBV-DNA level and improved pathology of liver tissue were found in the treatment group, and there was statistically significant difference compared with baseline (P<0.05).Conclusion:sTRAIL can mediate the liver immune injury in patients with HBV-related cirrhosis. Entecavir treatment can decrease sTRAIL and ALT, inhibit HBV-DNA replication, improve pathology of liver tissue, and thereby delay or prevent the development of HBV-related cirrhosis. Dynamic monitoring of the change in serum sTRAIL is helpful for the prognosis of liver cirrhosis in anti-viral treatment with Entecavir.
hepatitis B virus-related cirrhosis; soluble tumor necrosis factor related apoptosis inducing ligand (sTRAIL); Entecavir; outcome analysis
10.3969/j.issn.2095-9664.2015.05.010
陈典颜(1977-)男,硕士,主治医师。
R512.62
2095-9664(2015)05-0040-05
2014-10-20)
研究方向:消化系统疾病。
*通讯作者:E-mail:2154833035@qq.com

