石墨烯基季铵盐的制备及其抗菌性能
张 华,孙庆德,王瑞芳,张 雯,张 凤
(天津工业大学改性与功能纤维天津市重点实验室,天津 300387)
石墨烯基季铵盐的制备及其抗菌性能
张 华,孙庆德,王瑞芳,张 雯,张 凤
(天津工业大学改性与功能纤维天津市重点实验室,天津 300387)
为提高氧化石墨烯的抗菌性能,对其进行功能化改性,包括羧基化改性(GO-COOH)和氨基化改性(AG),最终得到石墨烯基季铵盐(GQAS).通过透射电镜、红外光谱分析、X衍射、X光电子能谱对中间产物和终产物进行了表征,并通过紫外-可见光光谱仪和扫描电镜等测试表征了GO、GO-COOH和GQAS对革兰氏阴性大肠杆菌和革兰氏阳性金黄色葡萄球菌的抗菌性能.结果表明:GQAS对大肠杆菌的抑菌率达到86.1%,对金黄色葡萄球菌的抑菌率达到95.3%,是一种有潜力的生物医用材料.
石墨烯;季铵盐;抗菌性能;功能化
石墨烯(GO)是一种由单层碳原子紧密堆积而成的2-D蜂窝状材料,被认为是富勒烯、碳纳米管、石墨(Gt)的基本结构单元[1].石墨烯可用于高速场效应管(FET)包括隧道效应三极管的器件材料、触摸屏、低成本ID卡以及LED、OPV等光电器件,也可作为添加剂用于超级电容器和锂离子电池电极材料,或作为增强剂用于复合材料[2].近期,上海应用物理所物理生物学实验室胡文兵等[3]报道了GO的抗菌特性,发现GO的抗菌性源自于它对大肠杆菌细胞膜的破坏,更重要的是GO对哺乳动物产生的细胞毒性很小.随后,伊朗谢里夫理工大学Akhavan等[4]进一步研究了GO和还原石墨烯(rGO)对革兰氏阴性大肠杆菌和革兰氏阳性金黄色葡萄球菌的毒性作用.新加坡南洋理工大学的陈元教授报道了Gt、氧化石墨(GtO)、GO、rGO的抗菌性能和抗菌机理,并探讨了膜压和氧压对其抗菌活性的影响[5].以上研究表明,石墨烯可以作为有效的新型抗菌材料.季铵盐类抗菌剂也是一种高效抗菌剂,其阳离子吸引带负电荷的细菌细胞壁,长链烷基接触到细菌细胞壁的另一侧,作用于细菌细胞表层,破坏细胞的细胞壁和细胞膜.其作用方式有两种:一种是长链烷基破坏细菌的细胞壁而杀死细菌;另一种是由于受抗菌剂阳离子的吸引,细菌负电荷减少,继而细胞壁破裂,内溶物渗出而死[6].本文为进一步提高GO的抗菌性能,通过改进的Hummers法制备了氧化程度较高的GO,并对其进行季铵盐功能化改性.
1 实验部分
1.1 实验药品与仪器
所用药品包括:石墨(Gt),8 000目,化学纯,天津市光复精细化工研究所产品;2-(7-偶氮苯并三氮唑)-N,N,N,N-四甲基脲六氟磷酸酯(HATU),分析纯,天津市光复精细化工研究所产品;N,N-二甲基1,3-丙二胺,分析纯,天津市化学试剂研究所产品;五氧化二磷,过硫酸钾,浓硫酸(98%),高锰酸钾,硝酸钠,双氧水(30%),盐酸(36%~38%)等,上海试剂一厂产品;次氯酸,3-氯-1,2-丙二醇,盐酸,蛋白胨,酵母浸粉等,天津市科密欧化学试剂有限公司产品.
所用仪器包括:UECIOR22型傅里叶变换红外光谱仪,德国BRUKER公司产品;K-alpha X型X射线光电子能谱仪,英国Thermo Scientific公司产品;JEM-2010FEF型透射电子显微镜,HitachiS-4800型场发射扫描电子显微镜,日本Nikon公司产品;D/MAX 2500型X射线衍射仪,日本Rigaku公司产品;TU-1901型紫外可见分光光度计,北京普析通用仪器公司产品.
1.2 氧化石墨烯的制备
将40 mL浓硫酸加热至90℃,在机械搅拌的同时加入8.4 g过硫酸钾和8.4 g五氧化二磷,混合均匀后降温至80℃,加入10 g Gt,恒温水浴反应4.5 h.将反应物过滤,并用蒸馏水洗涤残留的酸,置于真空烘箱于60℃烘干,得到预氧化石墨[7].
将5 g预氧化石墨加至130 mL浓硫酸(冰水浴)中,机械搅拌反应30 min;然后加入2 g NaNO3,待固体完全溶解后缓慢加入25 g高锰酸钾,并将温度升高至35℃,反应90 min;用注射器加入230 mL蒸馏水,立即转移到95℃油浴中反应5 min,把混合物倒至2 000 mL的烧杯中滴加12.5 mL 30%双氧水趁热过滤,得到枯黄色固体;加入10%稀盐酸10 mL,洗涤离心3遍,用蒸馏水洗涤至中性;将离心后固体放置于冷冻干燥机中干燥3 d,置于干燥器中保存[8-10].
1.3 羧基化石墨烯的制备
将100 mg GO分散于100 mL蒸馏水中,超声处理1 h,得到均匀溶液.在GO悬浮液中加入1.2 g NaOH和1.0 g氯乙酸,水浴超声2 h,加入适量的稀盐酸得到均匀分散的水溶液[11].再经过滤、水洗、干燥后得到GO-COOH.其化学反应示意如下(其中用3个六圆环替代石墨烯片层):
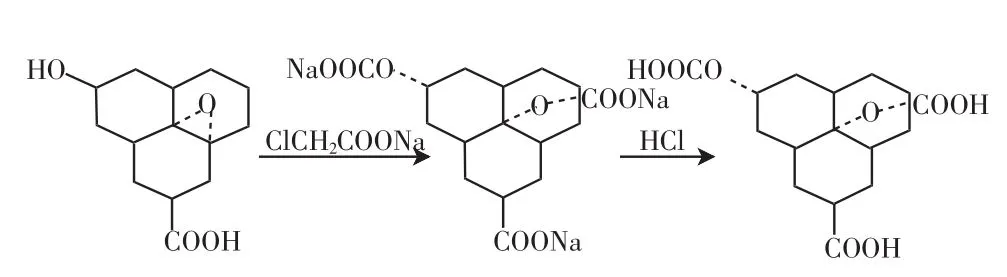
1.4 氨基化石墨烯(AG)的制备
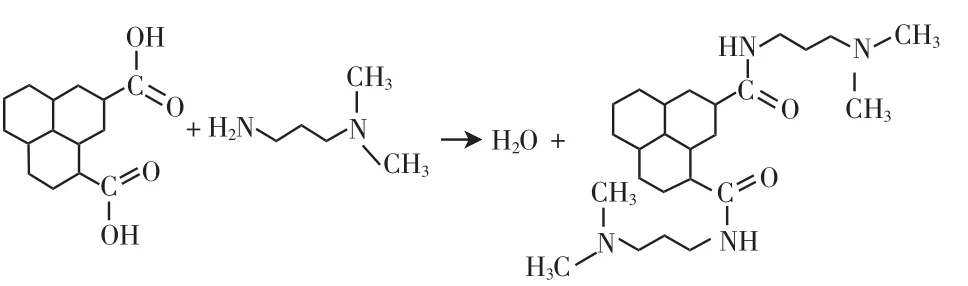
将100 mg GO-COOH分散于100 mL DMF中,于30℃机械搅拌下超声1 h,加入10 mL的N,N-二甲基1,3-丙二胺反应1 h,加入10 mg的偶联剂HATU,转入60℃的水浴,冷却回流6 h,用1 600 mL乙醇稀释产物,过滤后得到AG[12-13].化学反应示意如下:
1.5 石墨烯基季铵盐(GQAS)的制备
将100 mg AG分散于100 mL蒸馏水中,加入1 mL质量分数为36.5%的浓盐酸.加入11 g3-氯-1,2-丙二醇,冷凝回流6~7 h.将得到的产物用水和乙醇交替洗涤3次,离心后得到产物[14].化学反应示意如下:

1.6 结构表征
针对干燥至恒重的Gt、GO、GO-COOH、AG和GQAS:在室温下采用UECIOR22型傅里叶变换红外光谱仪(FT-IR)测试其400~4 000 cm-1吸收光谱;采用K-alpha X型X射线光电子能谱仪(XPS)分析其表面元素和含量;采用JEM-2010FEF型透射电子显微镜(TEM)观察石墨烯形貌,加速电压100 kV;采用D/ MAX-2500型X射线衍射仪对其进行X射线衍射(XRD)分析,Cu靶Kα1线,波长为0.154 18 nm,扫描速率为2°/min,扫描范围(2θ)为3°~40°.
1.7 抗菌实验
(1)细菌生长曲线的测定.在固体琼脂板上取单菌落,接种到预先添加有灭菌过的液体培养基的三角瓶中,然后放置在37℃恒温振荡仪中以140 r/min孵育24 h.取5 mL过夜培养的菌液,以10 000 r/min离心5 min,再用灭菌的生理盐水清洗3次,重悬.将200 μL的悬浊液加入到新鲜的LB培养基中,使得菌液最终体积为100 mL,放置到37℃的恒温摇床中以140 r/ min培养,每隔2 h从三角瓶中取样3 mL放入灭菌离心管中,放在4℃的冰箱中储存.直至26 h后,采用TU-1901型紫外可见分光光度计测出所得到溶液的O.D. 600 nm值(波长为600 nm的光密度值)[15-16].以培养时间为横坐标,O.D.600 nm值为纵坐标绘制生长曲线.
(2)抑菌率的测定.按照测生长曲线的办法培养细菌,取1 mL O.D.600=0.1的菌悬液分别和100 μL的无菌水(空白对照组)、抗菌剂混合后,接着转移至15 mL的灭菌试管中,之后加入10 mL的液体培养基.在37.5℃、140 r/min条件下震荡2 h.用200 μL稀释10万倍处理后的菌悬液铺平板,放置在37.5℃恒温培养箱中培养24 h.采用HitachiS-4800型场发射扫描电子显微镜(SEM)观察处理前后细菌的细胞形态.本实验中的抗菌剂有GO(20、50、100、250、500 μg/mL)、GO-COOH(100 μg/mL)、GQAS(100 μg/mL)的水溶液.空白对照实验为加入100 μL的无菌水[17].抑菌率=(空白样的菌落数-抗菌剂处理后的菌落数)/空白样的菌落数×100%[18].
2 结果与讨论
2.1 结构分析
图1所示为各种功能化石墨烯的红外光谱图.
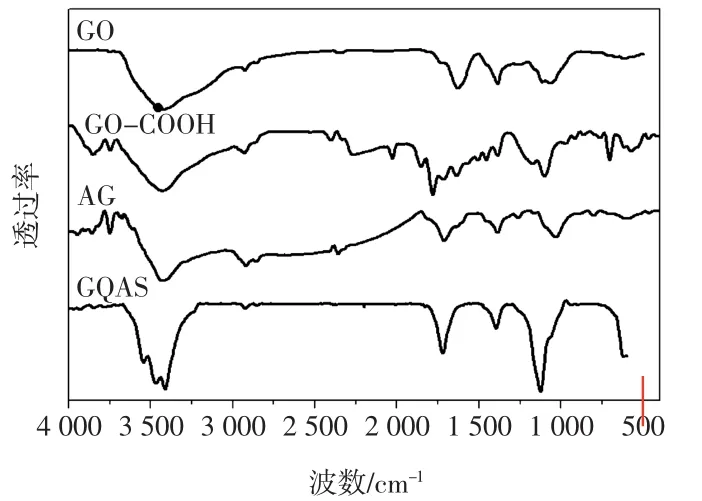
图1 各种功能化石墨烯的红外光谱图Fig.4 FT-IR spectra of GO,GO-COOH,AG and GQAS
由图1可知,GO在3 430、1 725、1 650、1 100、1 050 cm-1处分别为O—H、C—O、C—C、C(O)O、C—C伸缩振动峰.与GO相比,GO—COOH的C—OH峰强度减弱,C—O峰增强,且向高波数移动,峰位置在1 760 cm-1处,说明GO上的羟基向羧基转变.AG在3 400 cm-1处出现N—H的伸缩振动峰,2 924 cm-1处为甲基的C—H伸缩振动峰,1 710 cm-1处为C—O键的伸缩振动峰,1 350 cm-1处为新增的C—N伸缩振动峰,说明氨基化过程中形成了C—N共价键.GQAS在3 430 cm-1处出现O—H的伸缩振动峰,2 924、2 850 cm-1处出现CH3和CH2的C—H伸缩振动峰,1 710 cm-1处为C—O的伸缩振动峰,1 350 cm-1为C—N的伸缩振动峰,由此可知石墨烯基季铵盐具有O—H、CH3、CH2、C—O、C—N等官能团.
图2所示为各种功能化石墨烯的X光电子能谱图.
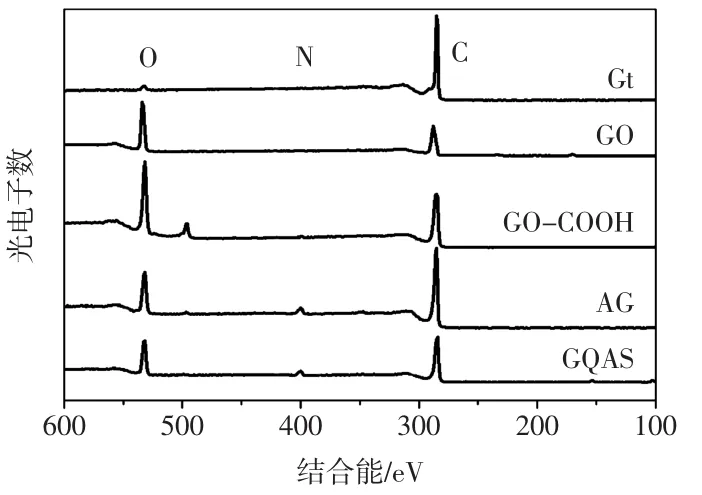
图2 Gt和各种功能化石墨烯的X光电子能谱图Fig.2 XPS spectra of Gt,GO,GO-COOH,AG and GQAS
由图2可知,在284.4、398.8和531.5 eV处的峰分别归属于碳、氮、氧的特征峰.Gt中氧碳质量比为3.19/ 96.81,GO中氧碳质量比为56.48/43.52,相比Gt而言其氧含量大幅度提高,这主要是因为GO上具有丰富的羟基、羧基、环氧基等.GO-COOH中氧碳质量比为61.05/38.42,其氧含量相对于GO中的氧含量有所增加,主要是由于GO上的羟基和环氧基部分转化成了羧基. AG和GQAS相对于GO-COOH在398.8 eV处出现了氮的特征峰,氮含量分别为5.81%和4.34%,这主要是因为AG上形成了C—N共价键,引入了N元素导致的.GQAS相对AG碳质量分数减少,氧质量分数增加,主要是由于3-氯-1,2-丙二醇被成功地接枝,引入了羟基.
2.2 尺寸大小和晶体结构
图3所示为GQAS的透射电镜图片.

图3 GQAS的透射电镜图Fig.3 TEM micrograph of GQAS
由图3可以看出,GQAS层数较少且透明,卷曲褶皱,仅有几个微米大小.
图4所示为Gt和各种功能化石墨烯的XRD图.

图4 Gt以及功能化石墨烯的XRD曲线图Fig.4 XRD patterns of Gt,GO,GO-COOH,AG and GQAS
由图4可知,天然Gt在2θ=26.5°有个很强的特征衍射峰,是(002)晶面的特征衍射峰,其层间距为d=0.34 nm.GO的特征衍射峰出现在2θ=10.9°,其晶面间距明显增大,为0.81 nm.这是由于浓硫酸的插层作用和高锰酸钾的强氧化作用,使得其面上增加了大量羟基和环氧基等官能团,面间距增大.GO-COOH的特征衍射峰出现在2θ=8.4°,晶面间距进一步增大,为1.05 nm.AG和GQAS无特征衍射峰,主要是由于随着链长的进一步增长,石墨烯片层剥离得到寡层,层间呈无序排列.
2.3 抗菌性能
图5所示为大肠杆菌和金黄色葡萄球菌的生长曲线图.

图5 大肠杆菌和金黄色葡萄球菌的生长曲线图Fig.5 Growth curve of E.coli and S.aureus
由图5可知,大肠杆菌4 h后进入对数生长期,14 h后进入稳定期,对数生长区间为4~14 h.与之相对应的金黄色葡萄球菌进入对数期的时间是6 h,16 h进入稳定期,其对数生长区间为6~16 h.
图6所示为经过无菌水、GO、GO-COOH、GQAS等试剂处理后大肠杆菌和金黄色葡萄球菌的平板计数图.

图6 大肠杆菌和金黄色葡萄球菌平板计数图Fig.6 Plate count photographs of E.coil and S.aureus
由图6可知,处理前大肠杆菌的数目为166个,经过GO、GO-COOH、GQAS处理后菌数分别为105、51和23个,得出GO、GO-COOH、GQAS的抑菌率分别为36.7%、69.3%和86.1%;处理前金黄色葡萄球菌的数目为212个,经过GO、GO-COOH、GQAS处理后菌数分别为100、46和10个,得出GO、GO-COOH、GQAS的抑菌率分别为52.8%、78.3%、95.3%.由此可知,羧基化石墨烯的抗菌性能大于GO,可能是因为其活性氧的含量高于GO,更能抑制细菌生长;而石墨烯基季铵盐的抗菌性能高于GO和羧基化石墨烯,是因为石墨烯基季铵盐具有可破坏细菌壁的季铵盐支链.
图7所示为用GQAS处理大肠杆菌和金黄色葡萄球菌前后的扫描电镜图.
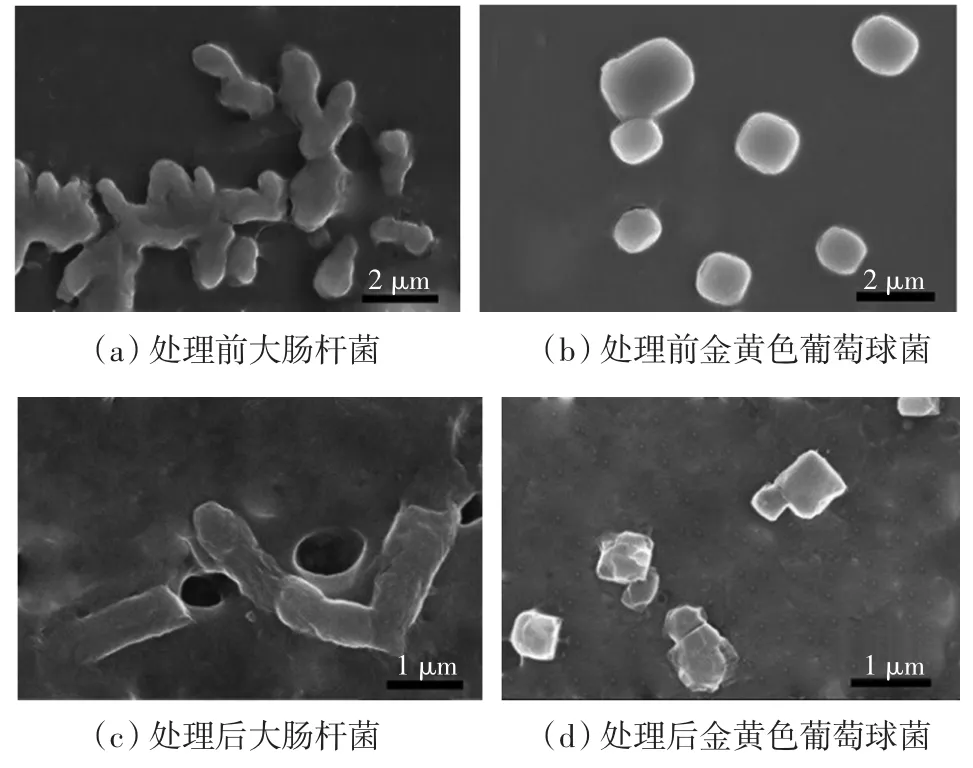
图7 GQAS处理前后的大肠杆菌和金黄色葡萄球菌的扫描电镜图Fig.7 SEM images of E.coli and S.aureus before and after having been treated with GQAS
由图7可以看出,处理前大肠杆菌和金黄色葡萄球菌的细胞结构完整,处理后细菌的细胞形态遭到破坏,特别是金黄色葡萄球菌,几乎全部细胞都遭到破坏.这主要是因为石墨烯片层尖锐的边缘破坏细胞膜,季铵盐的阳离子吸引带负电荷的细菌细胞壁,破坏细菌的细胞壁从而杀死细菌.
3 结 论
本文以水溶性HATU为偶联剂成功制备了AG,同时,制备了高效的碳纳米抗菌剂—GQAS,并对其进行结构表征和抗菌性能分析,研究结果表明:
(1)随着接枝的官能团越多、越长,功能化石墨烯的层间距也逐渐增大,氨基化石墨烯和石墨烯季铵盐片层之间是无序堆叠的.
(2)无论是对大肠杆菌还是金黄色葡萄球菌,抑菌率大小排序为:石墨烯季铵盐>羧基化石墨烯>GO.
(3)石墨烯基季铵盐对大肠杆菌的抑菌率达到86.1%,对金黄色葡萄球菌的抑菌率达到95.3%,其抗菌性能远高于GO和羧基化石墨烯.
[1] GEIM A K,NOVOSELOV K S.The rise of graphene[J].Nature Materials,2007,6(3):183-191.
[2] 陈永胜,黄毅.石墨烯—新型二维碳纳米材料[M].北京:科学出版社,2013:1-353.
[3]HU W B,PENG C,LUO W J,et al.Graphene-based antibacterial paper[J].Acs Nano,2010,4(7):4317-4323.
[4]AKHAVAN O,GHADERI E.Toxicity of graphene and graphene oxide nanowalls againstbacteria[J].AcsNano,2010,4(10):5731-5736.
[5]LIU S,ZENG T H,HOFMANN M,et al.Antibacterial activity ofgraphite,graphite oxide,graphene oxide,and reduced graphene oxide:Membrane and oxidative stress[J].Acs Nano,2011,5(9):6971-6980.
[6]李娜,罗虎.抗菌剂的应用及发展现状[J].化工技术与开发,2012,10(5):30-33.
[7] LIU H,HOU L,PENG W,et al.Fabrication and characterization of polyamide 6-functionalized graphene nanocomposite fiber[J].JournalofMaterialsScience,2012,47(23):8052-8060.
[8]HUMMERS W S,OFFEMAN R E.Preparation of graphitic oxide[J].Journal of the American Chemical Society,1958,4(4):1339-1339.
[9] 任小孟,王源升,何特.Hummers法合成石墨烯的关键工艺及反应机理[J].材料工程,2013,10(1):1-5.
[10]MARCANO D C,KOSYNKIN D V,BERLIN J M,et al.Improved synthesis of graphene oxide[J].Acs Nano,2010,4(8):4806-4814.
[11]DU D,WANG L,SHAO Y,et al.Functionalized graphene oxide as a nanocarrier in a multienzyme labeling amplification strategy for ultrasensitive electrochemical immunoassay of phosphorylated[J].AnalyticalChemistry,2011,83(3):746-752.
[12]RAMANATHAN T,FISHER F T,RUOFF R S,et al.Aminofunctionalized carbon nanotubes for binding to polymers and biological systems[J].Chemistry of Materials,2005,17(6):1290-1295.
[13]YAN J L,CHEN G J,CAO J,et al.Functionalized graphene oxide with ethylenediamineand 1,6-hexanediamine[J].New Carbon Materials,2012,27(5):370-376.
[14]徐浩,许虎君,陈玲,等.脂肪酰胺丙基N,N二甲基2,3-二羟丙基氯化铵的合成及性能[J].精细化工石油,2012,3(1):1-4.
[15]LI J,WANG G,ZHU H,et al.Antibacterial activity of largearea monolayer graphene film manipulated by charge transfer [J].Scientific Reports,2014,4(1):1-8.
[16]SHIQ,VITCHULIN,NOWAKJH,etal.Durableantibacterial Ag/polyacrylonitrile(Ag/PAN)hybrid nanofibers prepared by atmospheric plasma treatment and electrospinning[J].European Polymer Journal,2011,47(7):1402-1409.
[17]WANG Y W,CAO A,JIANG Y,et al.Superior antibacterial activity of zinc oxide/graphene oxide composites originating from high zinc concentration localized around bacteria[J].ACS Applied Materials&Interfaces,2014,6(4):2791-2798.
[18]CHEN J,PENG H,WANG X,et al.Graphene oxide exhibits broad-spectrum antimicrobial activity against bacterial phytopathogens and fungal conidia by intertwining and membrane perturbation[J].Nanoscale,2014,6(3):1879-1889.
Fabrication and antibacterial activity of graphene based quaternary ammonium salt
ZHANG Hua,SUN Qing-de,WANG Rui-fang,ZHANG Wen,ZHANG Feng
(Tianjin Municipal Key Laboratory of Fiber Modification and Functional Fiber,Tianjin Polytechnic University,Tianjin 300387,China)
Graphene based quaternary ammonium salt(GQAS)has been fabricated through a series of derivative of graphene such as carboxylated graphene oxide(GO-COOH),amino-functionalization graphene oxide(AG)in the aim of enhancing the antibacterial properties of graphene oxide.The different functionalized GO were characterized by transmission electron microscope(TEM),Fourier-transform infrared(FT-IR)spectroscopy,X-ray diffraction(XRD)and X-ray photoelectron spectroscopy(XPS).The antibacterial activity to Gram-negative Escherichia coli(E.coli)and Gram-positive Staphylococcus aureus(S.aureus)of GO,GO-COOH and GQAS were compared by UV-Vis spectrometer and scanning electron microscope (SEM).The results indicated that the antibacterial rates of GQAS are 86.1% and 95.3% to E.coli and S.aureus,respectively.So GQAS is a promising new material for biological and medical applications.
graphene;quaternary ammonium salt;antibacterial activity;functionalization
O613.71;TQ455
A
1671-024X(2015)02-0043-05
2014-12-23
天津市应用基础与前沿计划重点项目(13JCZDJC32100)
张 华(1961—),女,博士,教授,研究方向为抗菌纳米材料.E-mail:hua1210@126.com

