不同碳源对ZVI-SRB-SO42-体系中生物活性的影响
韩 煦,周天旭,刘 勇
(1.天津工业大学环境与化学工程学院,天津 300387;2.天津理工大学化学与化工学院,天津 300384)
不同碳源对ZVI-SRB-SO42-体系中生物活性的影响
韩 煦1,周天旭1,刘 勇2
(1.天津工业大学环境与化学工程学院,天津 300387;2.天津理工大学化学与化工学院,天津 300384)
选取不同有机物作为碳源,考察碳源对于高硫酸盐(SO42-)环境中硫酸盐还原菌(Sulfate-reducing bacteria,SRB)生物活性的影响;通过零价铁(Zero-valent iron,ZVI)的添加考察ZVI对于SRB生物活性的促进作用.结果表明:碳源会对SRB的生物活性产生很大影响,导致产生不同的SO42-还原效率;在SRB分别以柠檬酸钠、乳酸钠和可溶性淀粉为碳源时,通过添加ZVI可以明显提高SRB的生物活性;乳酸钠最适合作为SRB处理高SO42-浓度废水的碳源,当乳酸钠作为碳源时,SRB-ZVI体系对于SO42-初始质量浓度低于8 500 mg/L的废水具有良好的处理效果,即使废水中SO42-初始质量浓度达到11 000 mg/L时,SRB-ZVI体系对于SO42-的还原效率依然可以达到81.8%.
碳源;零价铁;硫酸盐还原菌;生物活性;硫酸盐还原
随着现代工业的发展,包括糖浆、制革、食品、采矿和造纸等越来越多的生产领域会产生大量的含硫酸盐(SO42-)废水,而大量的SO42-排入环境中会导致水体酸化,影响水生生物的生长;污染土壤,形成难溶的SO42-沉淀,使土壤板结[1].目前,一些化学和物理化学的方法已经被应用于去除水中的SO42-,例如反渗透和钡盐或者钙盐沉淀等,但这些处理方法都具有所需化学试剂和剩余化学污泥处理成本高的缺点[2].而基于SRB的SO42-废水生物处理方法具有处理成本低和污泥品质好等优点,受到越来越多的关注.SRB是一类有机化能营养的严格厌氧细菌,主要包括:脱硫弧菌属、脱硫微菌属、脱硫杆菌属、脱硫叠球菌属和脱硫肠状菌属等[3].SRB可以将电子供体(氢和碳源)的氧化与电子受体(SO42-)的还原结合起来支持自己的新陈代谢[4].其中碳源对于SO42-生物还原过程是必不可少的.不同的碳源可以产生不同的SRB生物量[5],并且影响SRB与产甲烷菌(Methane producing bacteria,MPB)对于基质的竞争结果.因此,选择不同的碳源将显著影响SO42-生物还原过程.目前,已有多种不同类型的有机物被用作碳源来促进SRB代谢过程,例如:护根物、木屑、动物粪便、植物肥料、乳清和其他农业废弃物[6-9].此外,一些合成的有机化合物特别是低相对分子质量的化合物也可以被用作碳源,例如:乳酸盐、乙酸盐、丙酸盐、丙酮酸盐和丁酸盐[10-12].Rodriguez[13]等采用UASB工艺处理酸性矿山废水时,以乙醇作为碳源,当COD/SO42-控制在1.0时,SRB对于SO42-的去除率可以达到85.6%.Zhao等[14]在研究中发现,当初始SO42-质量浓度和COD分别为2 000和4 000 mg/L时,以乳酸盐为碳源的SRB生物反应器在15 d内对于SO42-的去除效率达到了99%.为了考察碳源对于SRB的SO42-耐受性的影响,以期选择出更加适合SRB生长代谢的碳源,降低废水处理成本,本研究分别选择乳酸钠、乙酸钠、柠檬酸钠、葡萄糖和可溶性淀粉作为碳源;并且添加零价铁ZVI,验证其对于SRB活性的促进作用.本文中COD/SO42-被控制在2.0.
1 实验部分
1.1 材料与试剂
所用材料包括:原始污泥,取自天津纪庄子污水处理厂好氧区.
所用试剂包括:磷酸氢二钾、氯化钙、氯化铵、硫酸钠和盐酸,天津市风船化学试剂科技有限公司产品;乳酸钠、零价铁和酵母提取物,天津市光复科技发展公司产品;氯化钾、氯化镁、氢氧化钠和抗坏血酸,天津市北方天医化学试剂厂产品.以上试剂除酵母提取物外均为分析纯(AR),并且使用之前没有经过进一步地处理与纯化.所使用的零价铁为市售的普通铁粉.
1.2 湿态污泥的驯化
SRB湿态污泥的驯化阶段被分为5个周期,而每个驯化周期被控制在10 d左右.SRB湿态污泥的驯化采用改进的Postgate’s B液体培养基,其成分包括(单位:g/L):Na2SO4(初始2个周期1.479;第3到第5个周 期 2.958)、K2HPO4·3H2O 0.655、NH4Cl 1.0、CaCl20.816、MgCl2·6H2O 3.383、KCl 0.685、酵母提取物1.0、抗坏血酸0.1和乳酸钠5.0,并用1 mol/L的NaOH溶液或者盐酸调节培养基的pH值到7.0.SRB湿态污泥的驯化采用1.2 L的塑料驯化反应器在室温条件下进行,如图1所示.质量分数为13%的污泥被接种到培养基中,随后充入2 min氮气排除培养基和反应器中的氧以提供厌氧环境,利用磁力搅拌器保持污泥悬浊液的完全混合.SRB的生长情况可以通过污泥颜色从棕到黑的变化和SO42-浓度的变化来监测.

图1 污泥驯化反应器结构Fig.1 Structure of sludge cultivation reactor
1.3 SO42-生物还原实验
该实验被分为两个阶段并且均在250 mL反应瓶中进行.
(1)碳源对SRB生物活性的影响实验分为5组进行,每组实验中分别选取柠檬酸钠、乙酸钠、乳酸钠、葡萄糖和可溶性淀粉作为碳源,以提供COD来支持SRB的代谢过程;通过提高SO42-初始浓度来考察碳源对于高SO42-环境中SRB生物活性的影响.在第一个实验周期中,每组实验分别取一定量SRB污泥加入到150 mL含有一定浓度相应碳源的蒸馏水中,用1 mol/L的HCl和NaOH调节其pH值,随后取50 mL与污泥悬浊液有相同pH值的Na2SO4溶液,将二者混合后,向各反应瓶中充入1 min氮气后立即盖紧瓶塞以提供SRB所需的厌氧环境,每组实验中SO42-质量浓度为3 500 mg/L,而污泥质量浓度和COD均控制在7 000 mg/L.同时,另取相同数量的反应瓶加入相同浓度的碳源、SRB污泥以及Na2SO4后额外加入一定浓度的ZVI作为对照实验来考察ZVI对于SRB生物活性的促进作用.将所有反应瓶放置在摇床上进行160 r/min振荡反应,每隔一段时间,吸取4 mL样品用13 000 r/min离心机离心4 min,将所得到的上清液进行SO42-浓度和COD的测定以判断SRB的生物活性.在第一个实验周期结束后,将所有反应瓶中的污泥悬浊液离心,将污泥沉淀物取出用于第二个实验周期.在第二个实验周期中,每组实验中初始SO42-质量浓度和COD分别为5 000和10 000 mg/L,其他条件与第一个周期相同.通过比较每组实验中SO42-的去除效率来甄选出最优碳源用于后续的实验.
(2)在SRB和SRB-ZVI体系对SO42-的耐受性实验中,将SO42-初始质量浓度分别进一步提升到6 000、8 500和11 000 mg/L,考察单独的SRB体系和SRBZVI体系分别对于SO42-的耐受极限,其中初始COD/ SO42-始终被控制在2.0,其他条件均与第一个周期相同.
本文实验中,SRB-ZVI体系中ZVI的初始质量浓度均为0.3 g/L.
1.4 分析方法
SO42-浓度采用BaCl2分光光度法进行测定[15];COD的测定则采用快速密闭消解法[16].
2 结果与讨论
2.1 碳源对于SO42-生物还原效率的影响
碳源对于SO42-生物还原效率的影响如图2所示.
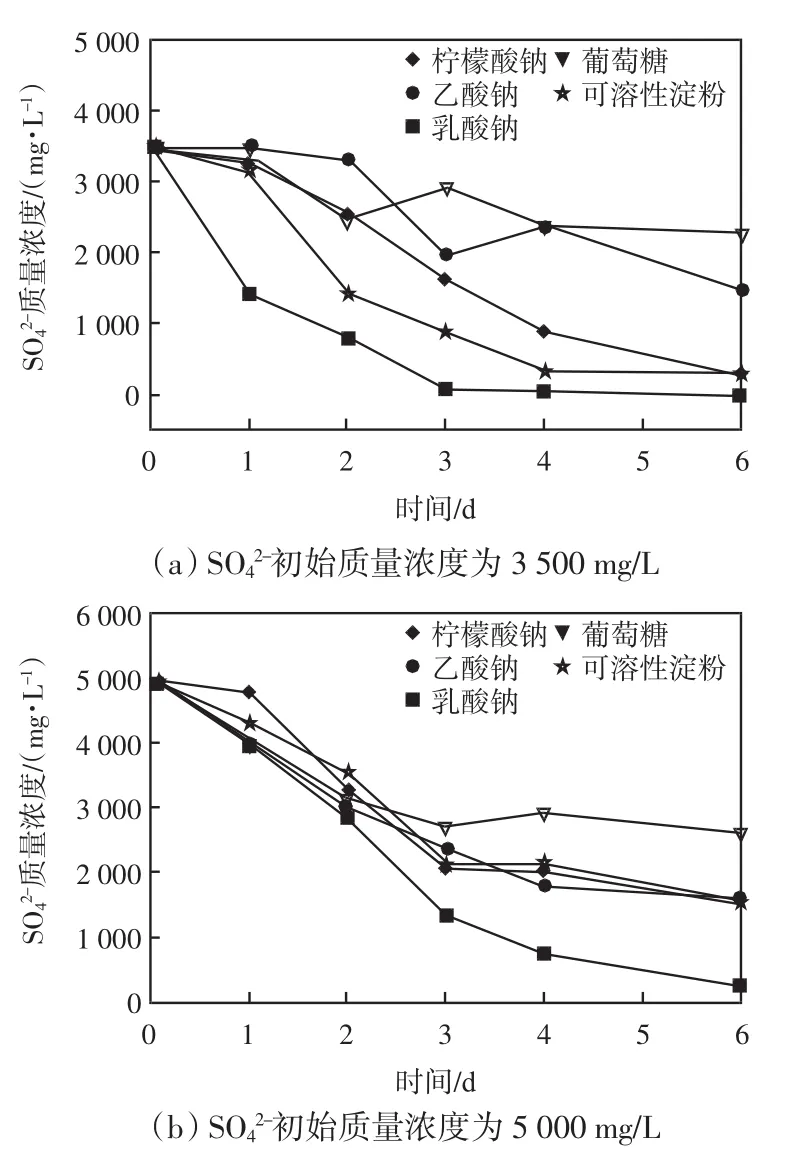
图2 碳源对于SO42-生物还原过程的影响Fig.2 Effects of carbon sources on SO42-bio-reduction
由图2(a)可知,在第一个实验周期中SO42-初始质量浓度为3 500 mg/L,在反应初始阶段,以柠檬酸钠、乙酸钠、葡萄糖和可溶性淀粉为碳源的体系中SO42-浓度相比于乳酸钠为碳源的体系并未出现明显的变化.这主要是因为在SRB驯化培养阶段采用乳酸钠作为碳源,因此当SRB以其它有机物作为碳源时需要对新环境有一个适应过程,导致在反应开始阶段SO42-还原速率下降.然而随着反应进行,SRB对于柠檬酸钠和可溶性淀粉体系的适应性增强,SRB的生物活性得到明显提升.在第6天的反应结束时,两个体系中的SO42-平均还原速率分别从延迟期的238.2(柠檬酸钠)和331.1 mg/(L·d)(可溶性淀粉)提高到576.3和567.1 mg/(L·d),并且SO42-还原效率分别达到98.8%和97.2%.此外,在乳酸钠体系中,整个反应周期中SO42-还原过程并没有出现延迟期,反应结束时模拟废水中的SO42-被完全还原.然而,当SRB以乙酸钠和葡萄糖作为碳源的时候,体系中SO42-的还原效率受到了明显抑制,反应结束时分别仅有57.8% (乙酸钠)和34.8%(葡萄糖)的SO42-被还原.
由图2(b)可知,当SO42-初始质量浓度提高到5 000 mg/L时,乳酸钠体系中SRB的生物活性维持在较高水平,在反应结束时仍有94.7%的SO42-被去除.然而,在SRB以柠檬酸钠和可溶性淀粉作为碳源的体系中,SO42-还原效率相比于第一个实验周期出现了明显的下降,在反应结束时分别仅有69.4% (柠檬酸钠)和68.5% (可溶性淀粉)的SO42-被还原.在乙酸钠和葡萄糖体系中,SO42-还原效率虽然相对于第一个周期略有升高,但也分别仅达到67.9% (乙酸钠)和48.2%(葡萄糖).由此可知,SO42-初始质量浓度的提高会对单独SRB体系中的生物活性产生抑制作用,进而导致SO42-还原效率的下降.
由方程式(1)可知,SRB可以在乳酸钠氧化与SO42-还原过程中获得大量能量用于自身的生长代谢,进而提高SRB的生物活性.因此,乳酸钠更适合作为SRB的碳源.Postgate[17]在之前的研究中同样指出SRB更喜欢以乳酸盐作为碳源.
乙酸盐虽然也是一种可以被SRB直接利用的碳源,但其对于产甲烷菌(Methane producing bacteria,MPB) 来说也是一种重要的基质,Laanbroek和Pfenning[18]指出MPB所产生的甲烷中70%来自于乙酸盐的氧化.并且总的来说,即使在乙酸盐充足的条件下,SRB在与MPB对于基质的竞争中也处于劣势[19].因此,当乙酸盐作为碳源时,SRB的活性受到抑制,导致SO42-生物还原效率下降.
而在葡萄糖为碳源的体系中,最终pH值相对于初始pH值均有一定程度的下降,这主要是因为葡萄糖厌氧降解过程中积累了大量的挥发性脂肪酸,使得反应体系酸化,而较低的pH值对SRB的生长代谢产生了不利影响[20],从而导致了较低的SO42-生物还原效率.
2.2 ZVI对于SRB生物活性的促进作用
以不同有机物作为碳源时SRB-ZVI系统对SO42-的去除效果如图3所示.
通过比较图2(a)和图3(a)可以看出,在SO42-初始质量浓度为3 500 mg/L的条件下,以柠檬酸钠、乳酸钠和可溶性淀粉为碳源的SRB-ZVI体系中SO42-还原效率相对于单独的SRB体系并没有明显的变化.同时,在乙酸钠和葡萄糖为碳源的体系中,SRB-ZVI的SO42-还原效率相对于单独SRB的情况有小幅提高,分别从57.8% (乙酸钠)和34.8% (葡萄糖)提高到69.5%和48.3%.
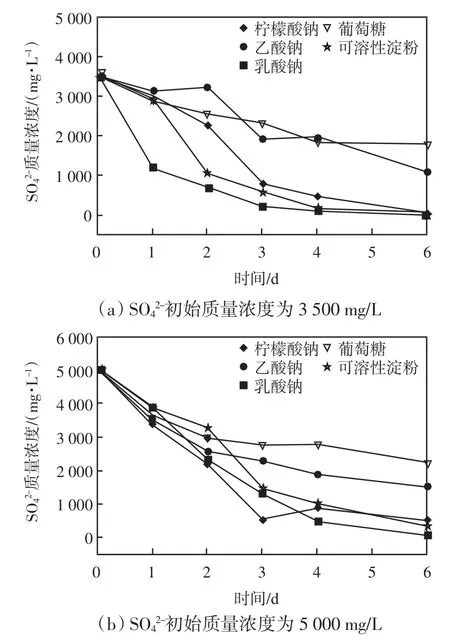
图3 不同有机物作为碳源时SRB-ZVI系统对SO42-去除能力Fig.3 Sulfate removal capacities of SRB-ZVI under different organic matters as carbon sources
比较图2(b)和图3(b)可以发现,当SO42-初始质量浓度提高到5 000 mg/L及ZVI存在的条件下,反应第一天结束时各个反应体系中的SO42-浓度均减少了超过1 200 mg/L,SRB+ZVI体系的SO42-还原效率高于单独SRB体系,表明ZVI可以提高SRB对于SO42-负荷变化的适应能力.随着反应的进行,在乙酸钠和葡萄糖为碳源的SRB-ZVI体系中SO42-还原速率开始逐渐下降,反应结束时分别仅有69.1% (乙酸钠)和55.3%(葡萄糖)的SO42-被还原,相对于单独的SRB体系并没有显著的提升.然而,在柠檬酸钠和可溶性淀粉体系中,反应结束时SRB-ZVI的SO42-还原效率分别达到了91.1%和93.6%,相对于单独SRB体系的69.4% (柠檬酸钠)和68.5% (可溶性淀粉)均有了明显提高.
由此可以看出,ZVI的添加并没有使SRB在与MPB对于碳源基质的竞争中占据优势地位,从而导致SO42-的还原效率没有明显提高.而在以葡萄糖为碳源的SRB-ZVI体系中的最终pH相对于初始pH依然出现明显的下降,表明ZVI的添加并没有抑制反应体系酸化,因此该体系中的SRB生物活性依然受到明显抑制,导致SO42-还原效率依然维持在较低的水平上.
ZVI对于SRB生物活性的促进作用主要是通过以下几个方面来实现的:
(1)ZVI在酸性环境中与H2O反应可生成OH来消耗水中的H+(如方程式(2)所示),提高了废水的pH值,以提供更适合SRB生长的酸碱环境.

(2)ZVI与H2O反应生成的H2可以被氢营养SRB当作电子供体,如方程式(3)所示,来加强SO42-生物还原过程[5].

(3)ZVI反应释放出的Fe2+可与SO42-还原过程产生的S(-II)反应生成沉淀,降低S(-II)毒性对于SRB的抑制作用,如方程式(4)所示:

虽然ZVI是工业废水处理过程中常用的反应材料,能有效地去除含氯化合物以及包括重金属在内的其他污染物[21-22].然而,本研究在预实验中发现,ZVI对于SO42-的直接还原作用并不明显,在6 d的实验中非生物体系内SO42-的浓度没有发生变化.因此可以得出结论,ZVI对于SO42-的直接还原作用可以忽略.而在SRB-ZVI体系中,当SRB分别以柠檬酸钠、乳酸钠和可溶性淀粉作为碳源时,SO42-还原效率相对于单独SRB体系均有一定程度的提高;但ZVI对于乙酸钠和葡萄糖体系中的SRB生物活性的促进作用并不明显.这表明碳源在SO42-生物还原过程中起到主要的作用,在碳源选择合适的条件下,ZVI对于SRB的生物活性起到促进加强作用
2.3SRB和SRB-ZVI体系中COD的变化
SRB和SRB-ZVI体系中COD的变化趋势如图4所示.
由图4可知,当初始SO42-质量浓度和COD分别为 5 000和10 000 mg/L时,以乳酸钠为碳源的SRB和SRB-ZVI体系中COD均有明显下降,6 d的反应结束时COD去除率均达到82%以上.当柠檬酸钠和可溶性淀粉作为碳源时,SRB体系中COD的去除率分别为64.1%(柠檬酸钠)和61.6%(可溶性淀粉),而SRB-ZVI体系中COD的去除率分别提高到了79.1%和82.6%.而当乙酸钠和葡萄糖作为碳源时,SRB和SRB-ZVI体系中的COD去除率并没有呈现出明显差别.由此表明:SO42-还原效率与COD去除率相辅相成,较高的SO42-还原效率会消耗更多的COD;SRB的生物活性在COD去除和SO42-还原过程中起到了主要作用,ZVI能够加强SRB在高SO42-环境中的生物活性.

图4 SRB和SRB-ZVI体系中COD的变化趋势Fig.4 Variations of COD in SRB and SRB-ZVI systems
2.4 SRB对于SO42-的耐受极限
在第一阶段的实验中发现,乳酸钠最适合作为SRB的碳源,因此将乳酸钠作为SO42-耐受性实验中所用的碳源,SRB体系和SRB-ZVI体系对于SO42-的耐受性如图5所示.

图5 SRB污泥对于SO42-的耐受性实验Fig.5 Experiments of sulfate tolerance of SRB sludge
由图5可知,当SO42-初始质量浓度进一步提高到6 000 mg/L时,SRB体系的SO42-还原效率明显下降,在第3个反应周期结束时仅有58.7%的SO42-被还原,然而SRB-ZVI体系依然可以保持98.9%的SO42-还原效率.由于在第3个反应周期中SRB体系的生物活性受到明显抑制,因此其不再用于第4个反应周期中.在第4个反应周期中,SO42-初始质量浓度被提高到8 500 mg/L,SRB-ZVI的SO42-还原效率下降到93%;当SO42-初始质量浓度达到11 000 mg/L,SRB-ZVI体系的生物活性有了更明显的下降,在27 d的反应中SO42-还原速率降低到81.8%.这表明单独SRB系统的生物活性随着SO42-初始浓度的升高和使用次数的增加而出现明显的下降,而通过ZVI的添加可以显著改善SRB的生物活性与SO42-耐受能力,但当SO42-初始质量浓度超过8 500 mg/L时,SRB-ZVI体系的SO42-还原效率也出现明显的下降.因此,本工艺适用于处理SO42-初始质量浓度在8 500 mg/L以下的废水.
3 结论
(1)碳源是影响SRB生物活性的一个关键性因素,不同的碳源会导致不同的SO42-还原效率.实验结果表明,在本文所选的5种有机物中,乳酸钠最适合作为SRB的碳源.
(2)SRB-ZVI体系中的生物活性在SO42-还原过程中起到主要作用.ZVI促进了SRB的生物活性,但其对于SO42-的直接还原作用并不明显.当SRB分别以柠檬酸钠、乳酸钠和可溶性淀粉作为碳源时,通过ZVI的添加可以显著加强SRB的生物活性,进而提高SO42-的还原效率.
(3)乳酸钠作为碳源时,在ZVI存在的条件下,SRB对于SO42-具有较高的耐受性,对于SO42-初始质量浓度低于8 500 mg/L的废水具有良好的处理效果.即使当SO42-初始质量浓度达到11 000 mg/L时,SRBZVI体系对于SO42-的还原效率依然可达到81.8%.
[1]王正辉.两相厌氧工艺处理高浓度硫酸盐有机废水的研究[D].南昌:南昌大学,2008.
[2]MOCKAITIS G,FRIEDL G F,RODRIGUES J A D,et al.Influence of feed time and sulfate load on the organic and sulfate removal in an ASBR[J].Bioresource Technology,2010,101(7):6642-6650.
[3]LUPTAKOVA A,KUSNIEROVA M.Bioremediation of acidmine drainage contaminated by SRB[J].Hydrometallurgy,2005,77(1/2):97-102.
[4]SARTI A,ZAIAT M.Anaerobic treatment of sulfate-rich wastewater in an anaerobic sequential batch reactor(AnSBR)using butanol as the carbon source[J].Journal of Environmental Management,2011,92(6):1537-1541.
[5]LIAMLEAM W,ANNACHHATRE A P.Electron donors for biological sulfate reduction[J].Biotechnology Advances,2007,25(5):452-463.
[6]DVORAK D H,HEDIN R S,EDENBORN H M,et al.Treatment of metal-contaminated water using bacterial sulfate reduction:Results from pilot-scale reactors[J].Biotechnology and Bioengineering,1992,40(5):609-616.
[7]HAMMACK R W,EDENBORN H M,DVORAK D H.Treatment of water from an open-pit copper mine using biogenic sulfide and limestone:A feasibility study[J].Water Research,1994,28(11):2321-2329.
[8]CHRISTENSEN B,LAAKE M,LIEN T.Treatment of acid mine water by sulfate-reducing bacteria:Results from a bench scale experiment[J].Water Research,1996,30(7):1617-1624.
[9]WAYBRANT K R,BLOWES D W,PTACEK C J.Selection of reactive mixtures for use in permeable reactive walls for treatment of mine drainage[J].Environmental Science&Technology,1998,32(13):1972-1979.
[10]OKABE S,CHARACKLIS W G.Effects of temperature and phosphorous concentration on microbial sulfate reduction by Desulfovibrio desulfuricans[J].Biotechnology and Bioengineering,1992,39(10):1031-1042.
[11]VISSER A,BEEKSMA I,VAN DER ZEE F,et al.Anaerobic degradation of volatile fatty acids at different sulphate concentrations[J].Applied Microbiology and Biotechnology,1993,40(4):549-556.
[12]HARADA H,UEMURA S,MOMONOI K.Interaction between sulfate-reducing bacteria and methane-producing bacteria in UASB reactors fed with low strength wastes containing different levels of sulfate[J].Water Research,1994,28(2):355-367.
[13]RODRIGUEZ R P,OLIVEIRA G H D,RAIMUNDI I M,et al. Assessment of a UASB reactor for the removal of sulfate from acid mine water[J].International Biodeterioration&Biodegradation,2012,74:48-53.
[14]ZHAO Y G,WANG A J,REN N Q.Effect of carbon sources on sulfidogenic bacterial communities during the starting-up of acidogenic sulfate-reducing bioreactors[J].Bioresource Technology,2010,101(9):2952-2959.
[15]CLESCERIL,GREENBERGA,EATONA.Standard Methodsfor the Examination of Water and Wastewater[M].20th ed. Washington:American Public Health Association,2001.
[16]国家环境保护总局.水和废水监测分析方法[M].北京:中国环境科学出版社,2002.
[17]POSTGATE J R.The Sulphate-Reducing Bacteria[M].London:Cambridge University Press,1979.
[18]LAANBROEK H J,PFEENIG N.Oxidation of short-chain fatty acids by sulfate-reducing bacteria in freshwater and in marine sediments[J].Archives of Microbiology,1981,128(3):330-335.
[19]CAO J,ZHANGG,MAOZS,etal.Influenceofelectrondonors on the growth and activity of sulfate-reducing bacteria[J].International Journal of Mineral Processing,2012,106:58-64.
[20]LO K V,CHEN A,LIAO P H.Anaerobic treatment of baker's yeast wastewater:II.Sulfate removal[J].Biomass,1990,23(1):25-37.
[21]LUDWIG R D,SMYTH D J A,BLOWES D W,et al.Treatment of arsenic,heavy metals,and acidity using a mixed ZVI-compost PRB[J].Environmental Science&Technology,2009,43(6):1970-1976.
[22]KAIFAS D,MALLERET L,KUMAR N,et al.Assessment of potential positive effects of ZVI surface modification and concentration levels on TCE dechlorination in the presence of competing strong oxidants,using an experimental design[J]. Science of the Total Environment,2014,481:335-342.
Effects of carbon sources on bioactivity of ZVI-SRB-SO42-systems
HAN Xu1,ZHOU Tian-xu1,LIU Yong2
(1.School of Environmental and Chemical Engineering,Tianjin Polytechnic University,Tianjin 300387,China;2.School of Chemistry and Chemical Engineering,Tianjin University of Technology,Tianjin 300384,China)
The different organic matters were chosen as carbon sources to assess the effects of carbon sources on the bioactivity of sulfate-reducing bacteria (SRB)in high sulfate environment.And then,zero-valent iron(ZVI)was added to examine the role of ZVI in promoting SRB bioactivity.The results indicated that carbon sources could bring great impacts on SRB bioactivity and result in various sulfate bio-reduction efficiencies.In addition,SRB bioactivity was strengthened when sodium citrate,sodium lactate and soluble starch were chosen as the sole carbon source in the presence of ZVI,respectively.The results also confirmed sodium lactate was the optimum carbon source for SRB in the treatment of wastewater containing high concentration of sulfate,and SRB-ZVI system exhibited a good performance in the treatment of wastewater when initial sulfate concentration is below 8 500 mg/L.The sulfate bio-reduction efficiency of SRB-ZVI system can reach 81.8% even when the initial sulfate concentration achieved 11 000 mg/L.
carbon source;zero-valent iron;sulfate-reducing bacteria;bioactivity;sulfate reduction
X703.1
A
1671-024X(2015)02-0058-06
2014-11-28
国家自然科学基金资助项目(41373114)
韩 煦(1978—),男,博士,副教授,研究方向为重金属离子在铁锰矿物中的迁移和转化.E-mail:hanxu_mail2013@163.com

