基于自组装原位生长法制备聚苯胺/CNTs纳米复合物修饰叉指电极的葡萄糖生物传感器
孙建东,马振华,姚晓霞,赵修青,李海涛,王建伟,柴秀琴,王会才,,
(1.天津兰力科化学电子高技术有限公司,天津 300143;2.天津工业大学环境与化学工程学院,天津 300387;3.天津工业大学中空纤维膜材料与膜过程国家重点实验室培育基地,天津 300387)
基于自组装原位生长法制备聚苯胺/CNTs纳米复合物修饰叉指电极的葡萄糖生物传感器
孙建东1,马振华2,姚晓霞2,赵修青2,李海涛2,王建伟2,柴秀琴3,王会才1,2,3
(1.天津兰力科化学电子高技术有限公司,天津 300143;2.天津工业大学环境与化学工程学院,天津 300387;3.天津工业大学中空纤维膜材料与膜过程国家重点实验室培育基地,天津 300387)
采用自组装原位生长制备基于聚苯胺/CNTs纳米复合物修饰叉指电极的葡萄糖生物传感器.首先采用自组装的方式制备CNTs修饰叉指电极,并采用对甲苯磺酸掺杂聚苯胺,原位在修饰电极表面生长聚苯胺,制备了PANI/CNTs修饰电极;然后将葡萄糖氧化酶固定在修饰电极表面制备了葡萄糖生物传感器.采用拉曼光谱、扫描电子显微镜、原子力显微镜等对所制备的PANI/CNTs复合物进行了表征分析;采用循环伏安法和电化学阻抗法研究了修饰电极的电化学行为.传感器性能评价结果表明:在最优化条件下,葡萄糖浓度与响应电流在0.5~30 mmol/L范围内呈现良好的线性关系,响应灵敏度为62.17 μA(/mmol·L-1),线性相关系数为0.997,检出限为0.15 mmol/L(S/N=3),并具有良好的重现性和稳定性.
聚苯胺;碳纳米管;葡萄糖氧化酶;生物传感器;自组装
聚苯胺(PANI)是一种典型的共轭导电高分子,因其具有特殊的电学性能,已广泛应用于电催化[1]、电容器[2]、燃料电池[3]以及生物传感器[4]等领域.其中,在生物传感器中,聚苯胺不仅可作为酶分子的固定化材料,而且可促进酶分子活性中心与电极之间的电子传递速率[5-6].然而,聚苯胺的导电性与其掺杂状态有关,溶液pH值及酶催化反应都有可能导致其掺杂状态改变,从而降低其导电性甚至失活[7],这一缺陷极大地限制了PANI在电化学传感器领域的应用.近年来,人们发现将聚苯胺与导电纳米材料复合,可提高聚苯胺复合材料的导电性[8-9].碳纳米管(CNTs)具有优异的导电、催化、吸附等性能,已广泛应用于生物传感器的构建[9-10],将PANI和CNTs复合,不但可以发挥复合材料中各组分的特性,两者的结合还可能产生协同效应,提高该复合材料的性能.目前聚苯胺的制备方法主要有化学法、电化学法以及生物酶催化合成法等.其中:化学法虽然合成方法简单,但是所合成的聚苯胺分子链刚性强,不溶不熔,难以加工,给传感器的制备带来了很大困难[11];电化学法合成的聚苯胺因受到电极尺寸的限制,难以大量合成并应用[12];近年来出现的酶催化合成法同样难以大量合成聚苯胺,而且合成反应速度慢,限制了其应用[6].此外,研究发现通过有机酸掺杂聚合[13-14]可以获得掺杂态聚苯胺,并可直接沉积在基材表面.近年来,微电子技术和微细加工技术已广泛应用于化学和生物传感器,利用微细加工技术可实现传感器的微型化、集成化和智能化,减少样品量,且传感器具有特定的形状和尺寸,可提高检测结果的一致性[15].在众多超微电极中,叉指电极具有产生-收集效应,可提高检测灵敏度,实现低浓度检测[16].本文采用自组装技术,将CNTs修饰在叉指电极表面,然后采用对甲苯磺酸掺杂、原位生长技术将聚苯胺修饰在电极表面,并固定葡萄糖氧化酶,制备了新型葡萄糖生物传感器,并对传感器性能进行了评价.
1 实验部分
1.1 仪器与试剂
仪器:LK2010型电化学工作站,天津市兰力科化学电子高技术有限公司产品;HR800型拉曼光谱仪,法国HORIBA公司产品;SPI3800N型原子力显微镜,日本精工产品;扫描电镜,荷兰Sirion公司产品;KH5200DB型超声波清洗器,昆山市禾创超声仪器有限公司产品;PHS-3BW pH计,上海雷磁公司产品.
试剂:苯胺,分析纯,上海五联化工厂产品;苯乙烯磺酸钠,工业级,上海嘉辰化工有限公司产品;对甲苯磺酸,分析纯,上海五联化工厂产品;多壁碳纳米管,直径10~30 nm,长度5~15 μm,深圳纳米港产品;过硫酸钾、丙酮、乙醚,分析纯,天津市风船化学试剂公司产品;4-羟基-2,2,6,6-四甲基哌啶自由基(TEMPO),质量分数≥99.3%,苏州塑化剂厂产品;聚二甲基二烯丙基氯化铵(PDDA),分子质量200~350ku,Aldrich产品;其他试剂如未特别说明均为分析纯.
1.2 聚苯乙烯磺酸钠接枝碳纳米管的合成
(1)TEMPO封端的聚苯乙烯磺酸钠(PSS-T)的合成[17-18]:在250 mL三口烧瓶中加入亚硫酸氢钠0.8 g、TEMPO 1.9 g和苯乙烯磺酸钠30 g,并加入乙二醇水溶液(质量比3∶1)40 mL,搅拌溶解,在氩气气氛下升温到60℃,加入过硫酸钾1.62 g,60℃反应1 h,然后升温到120℃反应24 h.冷却后将产物倒入大量丙酮中沉淀,过滤,洗涤,真空干燥.
(2)聚苯乙烯磺酸钠接枝碳纳米管(PSS-CNTs)的合成:将CNTs 100 mg和PSS-T 600 mg加入50 mL三口烧瓶中,然后加入乙二醇水溶液(质量比3∶1)20 mL,搅拌使其混合均匀.氩气下125℃反应12 h,冷却后将产物倒入大量丙酮中沉淀,过滤,洗涤,真空干燥.
1.3 修饰电极的制备
将叉指电极(叉指间距200 μm×200 μm,基底为微晶玻璃,如图1所示)浸入2%的PDDA溶液中,15 min后取出,用去离子水浸洗3次,每次10s,氮气吹干,此时电极表面带正电荷.然后再将电极浸入1%的PSS-CNTs中15 min,同样用去离子水浸洗3次,每次10 s,氮气吹干,此时电极表面带负电荷,如此重复上述操作即可制备CNTs自组装薄膜修饰的电极.将PSS-CNTs代替PSS-T就可得到没有修饰CNTs的对照电极.

图1 实验所用的叉指电极示意图Fig.1 Scheme of interdigitated array of gold electrode
在50 mL去离子水中加入0.227 mL苯胺(0.05mol/ L),4.76 g对甲苯磺酸(0.5 mol/L),0.28 g过硫酸铵(0.025 mol/L),搅拌10 min后,将经电解质或其与纳米碳管接枝物修饰的叉指电极放入其中.30 min时间后取出电极,用0.05 mol/L的对甲苯磺酸溶液浸洗电极表面,以除去电极表面大块的聚苯胺,然后用氮气吹干即可得到原位生长的聚苯胺及聚苯胺/CNTs复合物薄膜.最后将上述修饰电极浸入2%的戊二醛中6 h,经PBS洗涤后,在电极表面滴加5 μL质量浓度为2 mg/mL的葡萄糖氧化酶(GOD),在40℃下放置过夜,PBS浸洗后,即得到酶电极.
1.4 实验方法
循环伏安和电化学阻抗谱均采用三电极体系,在含有2.5 mmol/L Fe(CN)63/4-(1∶1)的0.1 mol/L KCl中进行;传感器响应行为测试时,以酶电极为工作电极,以饱和甘汞电极为参比电极、铂丝(直径1 mm)为对电极,以PBS缓冲液为电解池,在相对于饱和甘汞电极电极电位为+0.6 V下测定传感器对葡萄糖的响应电流.所有实验均在室温下进行.
2 结果与讨论
2.1 PANI/CNTs纳米复合物的表征
聚苯胺/CNTs复合物的拉曼光谱如图2所示.
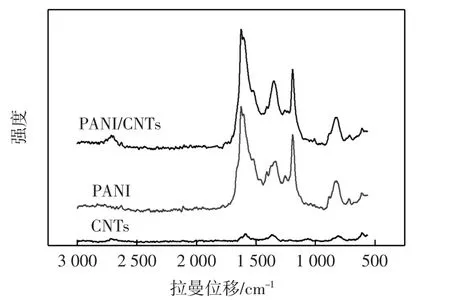
图2 CNTs、PANI及其复合物的拉曼光谱图Fig.2 Raman spectra of CNTs,PAN and PANI/CNTs
由图2可见,1 588 cm-1处的吸收峰对应于CNTs的G带吸收,它与石墨的G带吸收不同,CNTs吸收峰的肩峰向高波数方向移动,无序结构导致的D带吸收峰位于1 360 cm-1处,它还有一个二级波谱即D′带吸收峰位于2 710 cm-1[19].1 624 cm-1、1 511 cm-1、1 338 cm-1以及1 190 cm-1处的吸收峰为质子化聚苯胺的特征吸收,它表明所制备的聚苯胺为盐式结构[19-20].在聚苯胺与纳米碳管复合物的拉曼光谱中都存在聚苯胺和CNTs的吸收峰,表明已成功制备了聚苯胺/CNTs纳米复合物.
聚苯胺/CNTs复合物的SEM照片如图3所示.
从图3(a)中可看出:被聚合物包覆的纳米碳管均匀地分散在聚苯胺中,没有明显的团聚,复合物表面粗糙,具有很多孔洞,这非常适用于酶分子的固定化及酶催化反应过程中酶分子与底物的结合,对于提高传感器性能十分有利.从图3(b)中可见,所制备的聚苯胺为球形纳米粒子,尺寸均匀,平均粒径约为80 nm,表面高度差较小,表明聚苯胺薄膜表面光滑平整.

图3 聚苯胺/CNTs纳米复合物的扫描电子显微镜及原子力显微镜照片Fig.3 SEM and AFM micrographs of composites of PANI/CNTs
2.2 PANI纳米复合物修饰叉指电极的电化学行为
以Fe(CN)63/4-为氧化还原探针,研究了聚苯胺修饰电极的电化学行为,如图4所示.
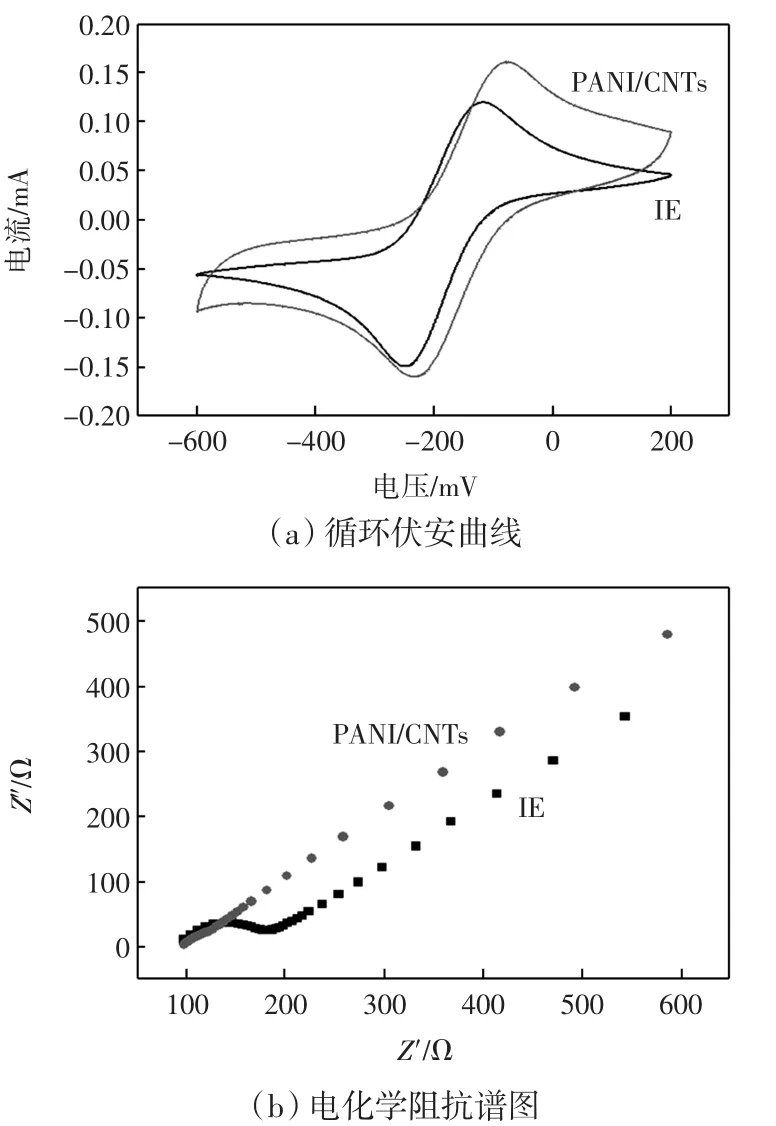
图4 叉指电极(IE)和PANI/CNTs(GO)修饰电极在2.5 mmol/LFe(CN)63/4-(1∶1)+0.1 mol/L KCl中的循环伏安曲线和电化学阻抗谱图Fig.4 CVs and electrochemical impedance spectra of IE and PANI/CNTs modified IE in 0.1 mol/L KCl containing 2.5 mmol/L Fe(CN)63/4-(1∶1)
图4(a)为叉指电极(IE)和PANI/CNTs的循环伏安曲线.从图中可见,PANI/CNTs修饰电极后,修饰电极的峰电流比裸电极明显增加,而峰间距稍有增加,表明PANI/CNTs纳米复合物具有良好的导电性.电化学阻抗谱是反映电极/电解质界面上的导电性最直接有效的参数[21],Nyquist图高频区的半圆与电子传递阻抗Ret有关,而低频区的斜线与传质过程有关.从图4(b)可知,当PANI/CNTs修饰在IE上,Nyquist图高频区的半圆明显降低,表明PANI/CNTs大大降低了电极电荷转移电阻Ret,加速了Fe(CN)64-/3-在溶液与电极表面的电子传递,这与循环伏安测试的结果相符.
2.3 PANI纳米复合物修饰叉指电极对葡萄糖的响应
图5给出了在pH为6.8,工作电位为+0.6 V vs. SCE时,PANI和PANI/CNTs修饰叉指电极对连续加入的葡萄糖的电流-时间曲线,图6给出了PANI修饰电极对葡萄糖的工作曲线.

图5 PANI修饰电极对葡萄糖的电流-时间曲线FIg.5 Amperometric response of PANI and PANI/CNTs modified IE electrode upon successive addition of glucose
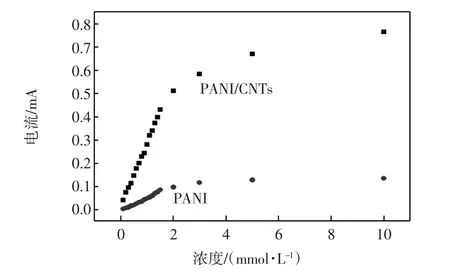
图6 PANI修饰电极对葡萄糖的工作曲线Fig.6 Calibration curve of modified IE electrode
从图5可以看出,随着葡萄糖浓度增大,两种酶电极的响应电流值均逐渐增大.两种酶电极均在5 s内达最大响应电流的95%,这种快速响应归功于所制备纳米复合物表面具有大量的孔洞(见图3),对于过氧化氢和葡萄分子具有良好的通透性,且通过对甲苯磺酸掺杂制备的聚苯胺具有良好的导电性,提高了酶与电极之间的电子传递速率.然而,由图5和图6可知,PANI修饰的酶电极对葡萄糖的响应灵敏度远低于PANI/CNTs修饰的酶电极,这主要是因为一方面CNTs修饰的酶电极的导电性优于未修饰的电极,极大地促进了酶催化反应的电子传递效率[9-10];另一方面,PANI/CNTs纳米复合物表面粗糙程度增加,比表面积增加,提高了酶分子的负载量,因此响应灵敏度较大.经计算可得PANI/CNTs纳米复合物修饰的酶电极对葡萄的响应灵敏度为62.17 μA/(mmol·L-1),线性范围为0.5~30 mmol/L,线性相关系数为0.997,显著高于文献报道的聚苯胺-g-壳聚糖[22]、PANI-g-CNTs复合物[23-24]以及Au/PANI/CNTs/壳聚糖复合物[25],如表1所示.

表1 几种基于PANI的葡萄糖传感器性能的对比Tab.1 Comparison of performance of glucose biosensor based on PANI.
本文考察了酶电极测定的选择性和储存的稳定性.研究发现PANI/CNTs电极在pH 6.8,工作电位+0.6 V vs.SCE时,对3种生理浓度的干扰物质(0.1mmol/L抗坏血酸,0.1 mmol/L醋氨酚和0.5 mmol/L尿酸)的电流响应分别为1 mmol/L葡萄糖的5.3%、4.8%以及1.1%,表明所制备的传感器具有良好的抗干扰能力.
电极重复使用不影响其性能,并获得很好的重现性.例如,电极对1 mmol/L葡萄糖连续测定5次所得的相对标准偏差(RSD)为3.7%.对5支不同酶电极进行重复性测试所得RSD为6.2%,表明电极的重复性良好.传感器不用时置于4℃冰箱中,在干燥环境下保存.在30 d的时间内,每天测定酶电极对1 mmol/L葡萄糖的响应电流.实验表明30 d后,传感器的响应电流下降了初始电流的15.5%.由此说明,PANI/CNTs复合酶膜的稳定性好,CNTs与PANI之间的协同效应,不仅稳定了PANI的导电性,而且提供了一个生物相容性良好的微环境,很好地保持了葡萄糖氧化酶的活性,故制备的胆碱生物传感器稳定性良好.
3 结束语
本文采用自组装原位生长技术,在叉指电极表面制备了聚苯胺/CNTs纳米复合物,克服了聚苯胺难以成型的缺点,并制备了葡萄糖生物传感器.研究结果表明聚苯胺/CNTs纳米复合物不仅为酶分子的固定化提供了生物相容性微环境,有利于酶催化反应,而且聚苯胺与CNTs之间的协同效应有利于酶催化反应中的电子传递,提高了传感器的整体性能.同时,本文聚苯胺/CNTs的制备方法也为聚苯胺纳米材料在电容器、化学传感器、防腐等其他领域的应用奠定了基础.
参考文献:
[1]TANNE J,DIETZEL B,SCHELLER F W,et al.Nanohybrid materials consisting of poly[(3-aminobenzoic acid)-co-(3-aminobenzenesulfonic acid)-co-aniline]and multiwalled carbon nanotubes for immobilization of redox active cytochrome c [J].Electroanalysis,2014,26(4):732-738.
[2]XIONG G P,MENG C Z,REIFENBERGER R G,et al. Graphitic petal electrodes for all-solid-state flexible supercapacitors[J].Adv Energy Mater,2014,4(3):1-9.
[3]YIN Z S,HU T H,WANG J L,et al.Preparation of highly active and stable polyaniline-cobalt-carbon nanotube electrocatalyst for oxygen reduction reaction in polymer electrolyte membrane fuel cell[J].Electrochim Acta,2014,119:144-154.
[4]XU Q,GU S X,JIN L Y,et al.Graphene/polyaniline/gold nanoparticles nanocomposite for the direct electron transfer of glucose oxidase and glucose biosensing[J].Sens Actuat B,2014,190:562-569.
[5]CHOWDHURY A D,GANGOPADHYAY R,DE A.Highly sensitive electrochemical biosensor for glucose,DNA and protein using gold-polyaniline nanocomposites as a common matrix[J].Sens Actuat B,2014,190:348-356.
[6]KAUSAITE-MINKSTIMIENEA,MAZEIKOV,RAMANAVICIENE A,et al.Evaluation of amperometric glucose biosensors based on glucose oxidase encapsulated within enzymatically synthesized polyaniline and polypyrrole[J].Sen Actuat B,2011,158(1):278-285.
[7]TANG N,ZHENG J B,SHENG Q L,et al.A novel H2O2sensor based on the enzymatically induced deposition of polyaniline at a horseradish peroxide/aligned single-wall carbon nanotubes modified Au electrode[J].Analyst,2011,136(4):781-786.
[8]DHIBAR S,BHATTACHARYA P,HATUI G,et al.Transition metal-doped polyaniline/single-walled carbon nanotubes nanocomposites:Efficient electrode material for high performance supercapacitors[J].Acs Sustainable Chem Eng,2014,2(5):1114-1127.
[9]SHARMA A L,KUMAR P,DEEP A.Highly sensitive glucose sensing with multi-walled carbon nanotubes-polyaniline composite[J].Polymer-PlasticsTechnolEng,2012,51(13):1382-1387.
[10]POORAHONG S,THAMMAKHET C,THAVARUNGKUL P,et al.Cauliflower polyaniline/multiwalled carbon nanotube electrode and its applications to hydrogen peroxide and glucose detection[J].Pure Appl Chem,2012,84(10):2055-2063.
[11]CHEN X J,CHEN Z X,ZHU J W,et al.A novel H2O2amperometric biosensor based on gold nanoparticles/self-doped polyaniline nanofibers[J].Bioelectrochem,2011,82(2):87-94.
[12]GERMAN N,RAMANAVICIUS A,VORONOVIC J,et al. Glucose biosensor based on glucose oxidase and gold nanoparticles of different sizes covered by polypyrrole layer[J].Colloids Surf A,2012,413:224-230.
[13]KULKARNI M V,VISWANATH A K,AIYER R C,et al. Synthesis,characterization,and morphology of p-toluene sulfonic acid-doped polyaniline:A material for humidity sensing application[J].J Polym Sci,Part B:Polym Phys,2005,43(16):2161-2169.
[14]YIN W S,RUCKENSTEIN E.Soluble polyaniline co-doped with dodecyl benzene sulfonic acid and hydrochloric acid[J]. Synth Met,2000,108(1):39-46.
[15]朱明智,蒋庄德,景蔚萱.基于多层叉指超微带电极阵列的葡萄糖传感器[J].分析化学,2005,33(10):1509-1511.
[16]ZOSKIC G.Ultramicroelectrodes:Design,fabrication,and characterization[J].Electroanalysis,2002,14(15/16):1041-1051.
[17]BOUIX M,GOUZI J,CHARLEUX B,et al.Synthesis of amphiphilic polyelectrolyte block copolymers using"living"radical polymerization:Application as stabilizers in emulsion polymerization[J].Macromol Rapid Commun,1998,19(4):209-213.
[18]GABASTON L I,FURLONG S A,JACKSON R A,et al.Direct synthesis of novel acidic and zwitterionic block copolymers via TEMPO-mediated living free-radical polymerization[J]. Polymer,1999,40(16):4505-4514.
[19]KONYUSHENKO E N,STEJSKAL J,TRCHOVÁ M,et al. Multi-wall carbon nanotubes coated with polyaniline[J].Polymer,2006,47(16):5715-5723.
[20]WU T M,LIN Y W,LIAO C S.Preparation and characterization of polyaniline/multi-walled carbon nanotube composites [J].Carbon,2005,43(4):734-740.
[21]GUO H L,WANG X F,QIAN Q Y,et al.A green approach to the synthesis of graphene nanosheets[J].ACS Nano,2009,3(9):2653-2659.
[22]XU X H,REN G L,CHENG J,et al.Self-assembly of polyaniline-grafted chitosan/glucose oxidase nanolayered films for electrochemical biosensor applications[J].J Mater Sci,2006,41:4974-4977.
[23]KOMATHI S,GOPALAN A I,LEE K P.Fabrication of a novel layer-by-layer film based glucose biosensor with compact arrangement of multi-components and glucose oxidase[J].Biosens Bioelectron,2009,24:3131-3134.
[24]GOPALAN A I,LEE K P,RAGUPATHY D,et al.An electrochemical glucose biosensor exploiting a polyaniline grafted multiwalled carbon nanotube/perfluorosulfonate ionomer-silica nanocomposite[J].Biomaterials,2009,30:5999-6005.
[25]WAN D,YUAN S J,LI G L,et al.Glucose biosensor from covalent immobilization of chitosan-coupled carbon nanotubes on polyaniline-modified gold electrode[J].Acs Appl Mater Interfaces,2010,2(11):3083-3091.
Glucose biosensor based on self assembled-in situ polymerized polyaniline/CNTs nanocomposite modified interdigitalelectrode
SUN Jian-dong1,MA Zhen-hua2,YAO Xiao-xia2,ZHAO Xiu-qing2,LI Hai-tao2,WANG Jian-wei2,CHAI Xiu-qin3,WANG Hui-cai1,2,3
(1.Lanlike Chemical Electronic High Technology Co Ltd,Tianjin 300143,China;2.School of Environmental and Chemical Engineering,Tianjin Polytechnic University,Tianjin 300387,China;3.The State Key Laboratory Cultivation Base of Hollow Fiber Membrane Materials and Membrane Process,Tianjin Polytechnic University,Tianjin 300387,China)
Glucose biosensors based on self assembled-in situ polymerized polyaniline/CNTs nanocomposite modified interdigitalelectrode were prepared.Firstly,CNTs modified interdigital electrode was prepared by self assembling process,and PANI/CNTs was prepared using p-toluene sulfonic acid doped polyaniline in situ polymerized aniline on the electrode surface;then glucose biosensor was prepared by immobilization of glucose oxidase on the as prepared modified electrode surface.The PANI/CNTs nanocomposites were characterized by Raman spectra analysis,scanning electron microscopy and atomic force microscopy;electrochemical behaviors of the modified electrode were characterized by cyclic voltammetry and electrochemical impedance method.The results showed that under the optimum conditions,glucose concentration and the response current showed a good linear relationship in the range of 0.5-30 mmol/L with the response sensitivity of 62.17 μA/(mmol·L-1),the linear correlation coefficient of 0.997,and the detection limit of 0.15 mmol/L(S/N=3).The biosensor also showed good stability and reproducibility.
polyaniline;carbon nanotube;glucose oxidase;biosensor;self assembled
TB332;O657.1
A
1671-024X(2015)01-0017-05
2014-10-29
国家自然科学基金(30900325);天津市以及科技部中小企业创新基金(13ZXCXSY14200,13C26211200305)
孙建东(1963—),男,高级工程师,主要研究方向为电化学传感器.
王会才(1979—),男,博士,副教授.E-mail:wanghuicai@tjpu.edu.cn

