IL-23/IL-17轴与大肠肿瘤关联性研究进展
陈晓龙,张淑英(综述),许岸高※(审校)
(1.广东医学院研究生学院,广东 湛江 524023; 2.惠州市医学研究所,广东 惠州 516003)
IL-23/IL-17轴与大肠肿瘤关联性研究进展
陈晓龙1△,张淑英2(综述),许岸高2※(审校)
(1.广东医学院研究生学院,广东 湛江 524023; 2.惠州市医学研究所,广东 惠州 516003)
摘要:白细胞介素2(IL-23)/IL-17轴是炎症免疫反应中的重要信号通路,大量研究表明IL-23/IL-17轴在多种疾病中起重要作用。近年蛋白质组学研究证实IL-23/IL-17轴中的重要因子IL-23、IL-17在人类大肠癌细胞中呈过表达现象,并认为IL-23、IL-17的表达与大肠肿瘤的发生、发展密切相关。近年来,随着大肠癌研究逐渐深入,许多与大肠癌的相关的信号通路已经被发现,其中IL-23/IL-17 信号通路在大肠癌的发生发展过程中可能担当着重要角色。进一步深入研究IL-23/IL-17信号通路轴中重要因子及它们的基因多态性等与大肠癌的关系,对筛选大肠癌高危人群、预防发病风险及治疗等有重大意义。
关键词:大肠癌;白细胞介素23/白细胞介素17信号通路轴;基因多态性
大肠癌是最常见的恶性肿瘤之一。在全世界范围内其发病率居第3位、病死率居第4位[1]。而大肠癌在我国亦是高发病率的恶性肿瘤之一,近年来大肠癌的发病率也有逐年升高的趋势[2]。近年的研究发现,白细胞介素23(interleukin 23,IL-23)和IL-17在人类和动物模型的大肠癌组织中存在高表达,被认为与大肠癌的发生、发展密切相关[3],研究表明IL-23/IL-17信号通路轴可能参与大肠癌发生和发展,通过动物组织标本的实验发现,对该信号轴中重要因子进行阻断或者功能抑制等可以防治大肠癌的发生及发展,为大肠癌的治疗指明了新的方向[4]。现将IL-23/IL-17轴信号通路与大肠癌的关系方面的研究综述如下。
1IL-23/IL-17通路及辅助性T细胞分化机制
辅助性T细胞(T help cell 17,Th17细胞)是一种新发现的CD4+效应T细胞, Th17细胞生成的通路称为IL-23/IL-17炎症反应轴。Th17细胞可以分泌IL-17A、 IL-17F、IL-22等细胞因子。树突状细胞及巨噬细胞位于Th17细胞分化途径的上游。初始T细胞在转化生长因子β(transforming growth factor β,TGF-β)和IL-6共同作用下[5],通过激活信号转导和转录因子3( signal transducer and activator of transcription 3,STAT3)以诱导短暂表达维甲酸相关核孤儿受体γt的表达,从而促使CD4+细胞分化成为Th17细胞,当IL-23缺乏时,Th17细胞的分化及IL-17的分泌明显减少[6]。Th17细胞可以分泌IL-21,起到自反馈作用。TGF-β可诱导T细胞IL-23R的表达,从而使Th17细胞对IL-23产生反应。IL-23属于IL-12家族,主要由活化的树突状细胞分泌,是由p19亚基和p40亚基共构成的一种异源二聚体分子。IL-23与其特异性受体IL-23R结合后诱导下游的Janus络氨酸激酶(Janus tyrosine kinase,JAK)分子的激活,并磷酸化受体细胞内的STAT3结合位点,STAT3分子以二聚体的形式,再由JAK将其磷酸化,磷酸化的STAT3二聚体入核,诱导靶基因[IL-17A信使RM(messenger RNA,mRNA)、IL-17F mRNA、IL-22 mRNA]的转录。由此可见,IL-23在Th17细胞适应内部新环境及分泌IL-17的过程中起重要作用[7]。另外研究表明,IL-17能结合于树突状细胞的IL-17R,使其分泌大量的IL-23,促进Th17细胞的分化及IL-17 的分泌。IL-17 是一个细胞因子家族,包括6个家族成员(IL-17A-F),IL-17A,即一般意义上的IL-17,IL-17F与IL-17A同源性最高,并有相似的调控、信号通路及功能[8]。目前研究已经证明在许多肿瘤性疾病中均发现存在有IL-17表达水平的升高, IL-17 在肿瘤发生、发展过程中发挥双重作用,IL-17 既可以通过促进血管生成和肿瘤细胞的迁移促进肿瘤的生长,又可以促进细胞毒性T细胞免疫应答抑制肿瘤的生长[9]。体外实验证实, IL-17 可以上调 LoVo 细胞株血管内皮生长因子、尿激酶纤溶酶活化因子、神经纤毛蛋白2、基质金属蛋白酶9、IL-6 和结合抑制因子3 等促血管生成相关因子的表达[10]。由此可得IL-23/IL-17轴信号通路的大致过程为:“IL-23-IL-23R-Th17-IL-17-血管生成因子-肿瘤”。
2IL-23、IL-17及其受体在大肠癌的表达
2.1IL-23及其受体在大肠癌组织的表达在上皮细胞肿瘤中,IL-23的生成增多,它具有上调炎性过程的作用,包括上调基质金属蛋白酶的表达与血管生成并减少细胞毒性T淋巴细胞的浸润,从而促进大肠癌细胞的生长[11-12]。另有发现,IL-23 可促进人大肠癌的发展,与大肠癌患者预后差密切相关。在小鼠肿瘤模型中IL-23具有抗肿瘤活性;事实上IL-23/p19缺陷的小鼠完全抗致癌物诱导肿瘤,这种小鼠无法形成肿瘤的原因是多种肿瘤相关的炎症标志物缺乏[13],这进一步证实了IL-23可能在促进肿瘤生长的相关炎症中发挥重要作用。Lan等[11]使用实时荧光定量聚合酶链反应、酶联免疫吸附试验、免疫印迹、免疫组织化学方法和免疫细胞化学方法来测定毗邻癌症的正常组织(n=13)、腺瘤性息肉(n=26)、大肠癌(n=13)中IL-23A、IL-23R和叉头翼状螺旋转录因子3的水平,发现IL-23表达从正常组织到大肠癌逐渐增加,IL-23A 的mRNA及蛋白的表达在大肠癌和腺瘤性息肉组织比正常大肠组织显著增高。免疫组织化学染色显示, IL-23R在大肠癌组癌细胞高度阳性,而在其他分组中却是部分阳性,IL-23R阳性的腺瘤更加不典型。几乎所有的癌症细胞为IL-23R 阳性,所有大肠癌组织中的癌细胞产生IL-23R蛋白,针对于肿瘤微环境的各种因素可能增强IL-23R表达。这些表明IL-23/IL-23R 可能直接影响肿瘤细胞,并且调节它们的生长和局部的免疫过程,从而增强腺瘤性息肉向大肠癌的恶变。
2.2IL-17及其受体在大肠癌组织的表达人大肠癌组织中,IL-17主要来源于肿瘤间质的CD4+T 细胞和巨噬细胞,IL-17在人大肠癌组织内高表达,与不良预后显著相关,是独立的预后预测因子。有研究提示外周血IL-17表达水平可用作大肠肿瘤血清标志物[14]。Wang等[15]发现Th17细胞百分比在大肠腺瘤及大肠癌患者的血清中增加。循环中Th17细胞增加在早期,而肿瘤组织中Th17增加发生在晚期,随着大肠癌级别的升高,IL-1β、 IL-17A 和 IL-23也发生了类似的改变,而大肠癌中IL-6的表达水平伴随着Th17细胞却显示了相反的改变。此外,在肿瘤组织而不是在正常组织中TGF-β和 IL-17A 的水平升高。Cui等[16]采用实时定量聚合酶链反应和半定量免疫组织化学检测50例人大肠腺瘤组织、50例大肠癌组织和15例正常大肠组织中IL-17A的表达,结果显示IL-17A mRNA 水平从大肠腺瘤到癌的顺序逐渐增高,起初在大肠腺瘤增高,之后大肠癌更高。尤其是大肠腺瘤组织IL-17A mRNA 水平增高与其异型增生的程度有关。免疫组织化学分析核实了实时定量聚合酶链反应结果,并且显示了从间质细胞到腺瘤/癌上皮中IL-17A细胞水平逐渐增加。此外,实时定量聚合酶链反应结果也显示Th17刺激因子的表达增高贯穿这个顺序。可见从结肠腺瘤到结肠癌的次序,IL-17A 和Th17被高度激活。然而,Wagsater等[17]发现大肠癌组织和血清样品的IL-17蛋白水平和临床特点如分期、性别、位置及 Dukes 分期无关。另外,IL-17F 对大肠癌细胞的发展具有抑制作用。在 IL-17F 过表达的大肠癌肿瘤中没有明显的白细胞浸润,相反,血管内皮生长因子水平和 CD31+细胞减少[8],说明IL-17F 对大肠癌细胞发展具有抑制的作用,这种抑制作用有可能是通过抑制肿瘤血管生成来实现的。这些结果表明IL-17在大肠癌中扮演的角色仍然不清。
国外的一项研究发现,产肠毒素脆弱拟杆菌可引起大肠炎且强烈诱导肠道多发性腺瘤(Min)小鼠形成结肠癌。此过程诱导激活结肠选择性的STAT3,使Th17细胞反应增强。给予抗体阻断IL-17与IL-23,可以抑制产肠毒素脆弱拟杆菌导致的结肠炎、黏膜增生和肿瘤形成,表明通过STAT3途径诱导的Th17细胞分化和激活在一些人类共生菌的致癌过程中起重要的作用[4]。另外,通过制作大肠癌CPC-APC小鼠模型(携带转基因Cdx-Cre的小鼠,该小鼠的大肠癌多发生于远端结肠),研究人员发现,CPC-APC小鼠模型中的IL-23p19亚基和IL-17A的mRNA也是升高的,另外发现,小鼠模型中肠系膜淋巴结细胞中的TH17细胞及其他分泌IL-17的细胞表现出IL-23的依赖性[3]。通过对CPC-APC小鼠敲除IL-23R之后,上皮中的STAT3明显减少。IL-23信号对于内生性肿瘤组织中产生下游的细胞因子有重要作用,如直接的细胞因子(IL-6、IL-22)和间接的细胞因子STAT3(IL-17A)。为了进一步明确IL-17和大肠肿瘤的关系,研究者用CPC-APC小鼠与敲除IL-17R的小鼠(既不对IL-17A也不对IL-17E有反应)进行杂交,研究表明在缺少IL-17R的情况下,肿瘤的发生是减少的[3]。炎症免疫反应“IL-23/IL-17”轴与大肠肿瘤的关系,见图1[18]。
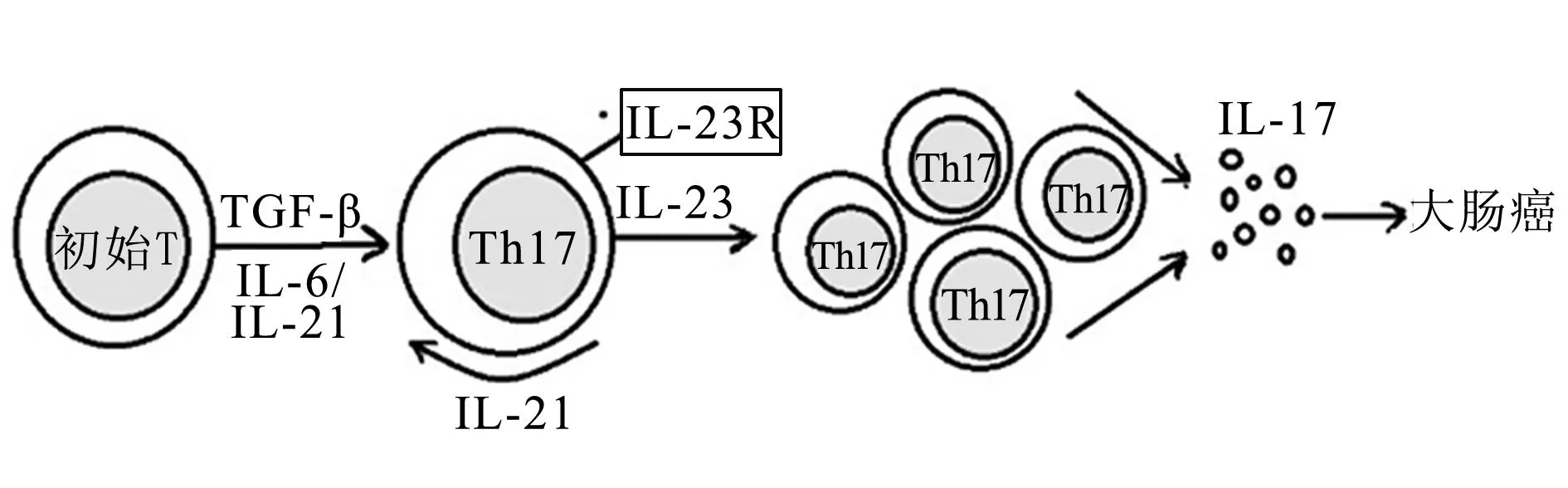
初始T:初始T细胞;TGF-β:转化生长因子β;Th17:辅助性T细胞17;IL-23R:白细胞介素23受体;IL:白细胞介素
图1IL-23/IL-17信号轴与大肠癌关系示意图
从上述可知,IL-23/IL-17信号轴可能与大肠癌的发生相关。单核苷酸多态性(single nucleotide polymorphisms,SNPs)是目前肿瘤的关联研究中最常用的遗传学标记,IL-23/IL-17信号轴中关键因子的SNP可改变RNA转录的半衰期,引起基因表达和蛋白质水平的改变;也导致同义(不影响氨基酸序列)或者非同义(影响氨基酸序列)突变,细胞因子或其受体中单个氨基酸的变化可引起功能的巨大改变或者丧失[19]。大量的研究已证实,细胞因子基因的SNPs与诸多消化道肿瘤密切相关。因此,IL-23/IL-17信号通路轴中的重要因子的SNPs与肿瘤的关联性研究受到重视:通过对3组病例对照研究(腺瘤组、结肠癌组和直肠癌组)的研究发现,IL-23R基因的SNPs可能在直肠癌的发病进程有关,特别是在TP53和KRAS2基因突变的个体中[20]。IL23R rs1884444TT基因型是胃癌的遗传易感性,尤其肠型胃癌[21]。但也有研究发现,IL23R rs10889677 CC基因型是肠型胃癌的保护因素[22]。国外有研究发现,IL23R rs10889675(C> A)和rs7542081(C>A)SNPs降低直肠癌的整体危险(P-趋势分别为0.04和0.05),尤其含TP53突变直肠癌更明显[20]。目前认为SNPs导致了IL-23R对不同疾病的易感性[23]。
有研究发现,IL-17A的SNPs是乳腺癌的遗传易感因素[24];IL-17A rs2275913、IL-17F rs763780的SNPs与膀胱癌的发展、性别、肿瘤分期相关[25];在胃癌的研究中发现,IL-17A rs3748067 T 多态性和肠型胃癌风险降低有关(P=0.037),并且与淋巴结转移呈负相关。 IL-17F rs763780的GA与GG基因型是胃癌遗传易感因素,且GA基因型与高龄非贲门癌关联更紧密,IL-17A rs2275913AG与胃癌预后差相关[26]。而日本的研究则发现,IL-17A rs2275913的GA 与AA促进胃癌发展,尤其肠型胃癌;IL-17F rs763780的SNP与胃癌无关[27]。
3结语
大量的研究表明,IL-23/IL-17轴在大肠癌细胞中的表达与大肠癌的发生、发展有关。近年来,随着大肠癌信号通路网络的逐渐被明确,许多新的治疗方案被提出,对IL-23/IL-17轴信号通路及该通路的抑制药物的研究也越来越多并运用于临床,但IL-23/IL-17轴引起大肠癌发生的具体机制仍未完全明确,现阶段距应用于临床诊断、治疗大肠癌还有很长的路要走。进一步从分子水平阐明IL-23/IL-17信号轴及其中重要因子的SNPs与大肠癌的关系,对筛选大肠癌高危人群、预防发病风险及治疗等有重大意义。
参考文献
[1]Jemal A,Bray F,Center MM,etal.Global cancer statistics[J].Cancer J Clin,2011,61(2):69-90.
[2]许岸高,姜泊,余志金,等.广东地区大肠癌临床特征研究[J].中华消化杂志,2007,27(7):450-453.
[3]Grivennikov SI,Wang K,Mucida D,etal.Adenoma-linked barrier defects and microbial products drive IL-23/IL-17-mediated tumour growth[J].Nature,2012,491(7423):254-258.
[4]Wu S,Rhee K J,Albesiano E,etal.A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cell responses[J].Nat Med,2009,15(9):1016-1022.
[5]Bettelli E,Carrier Y,Gao W,Kom T,etal.Reciprocal developmental pathways for the generation of pathogenic effector Th17 and regulatory T cells[J].Nature,2006,441(7090):235-238.
[6]Murugaiyan G,Saha B.Protumor vs antitumor functions of IL-17[J].J Immunol,2009,183(7):4169-4175.
[7]Shen W,Durum SK.Synergy of IL-23 and Th17 cytokines:new light on inflammatory bowel disease[J].Neurochem Res,2010,35(6):940-946.
[8]Tong Z,Yang XO,Yan H,etal.A protective role by interleukin-17F in colon tumorigenesis[J].PLoS One,2012,7(4):e34959.
[9]Ji Y,Zhang W.Th17 cells:positive or negative role in tumor?[J].Cancer Immunol Immunother,2010,59(7):979-987.
[10]Liu J,Duan Y,Cheng X,etal.IL-17 is associated with poor prognosis and promotes angiogenesis via stimulating VEGF production of cancer cells in colorectal carcinoma[J].Biochem Biophys Res Commun,2011,407(2):348-354.
[11]Lan F,Zhang L,Wu J,etal.IL-23/IL-23R:potential mediator of intestinal tumor progression from adenomatous polyps to colorectal carcinoma[J].Int J Colorectal Dis,2011,26(12):1511-1518.
[12]Teng MW,Andrews DM,Mclaughlin N,etal.IL-23 suppresses innate immune response independently of IL-17A during carcinogenesis and metastasis[J].Proc Natl Acad Sci U S A,2010,107(18):8328-8333.
[13]Langowski JL,Zhang X,Wu L,etal.IL-23 promotes tumour incidence and growth[J].Nature,2006,442(7101):461-465.
[14]Radosavljevic G,Ljujic B,Jovanovic I,etal.Interleukin-17 may be a valuable serum tumor marker in patients with colorectal carci-noma[J].Neoplasma,2010,57(2):135-144.
[15]Wang J,Xu K,Wu J,etal.The changes of Th17 cells and the related cytokines in the progression of human colorectal cancers[J].BMC Cancer,2012,12:418.
[16]Cui G,Yuan A,Goll R,etal.IL-17A in the tumor microenvironment of the human colorectal adenoma-carcinoma sequence[J].Scand J Gastroenterol,2012,47(11):1304-1312.
[17]Wagsater D,Lofgren S,Hugander A,etal.Expression of interleukin-17 in human colorectal cancer[J].Anticancer Res,2006,26(6B):4213-4216.
[18]赵青霞,王燕,底婷婷,等.IL-23/IL-17轴在银屑病免疫发病机制中的作用[J].基础医学与临床,2012,32(4):453-456.
[19]杨永强,王巍杰,徐长波,等.单核苷酸多态性研究进展[J].化学与生物工程,2009,26(8):19-21.
[20]Poole EM,Curtin K,Hsu L,etal.Genetic variability in IL23R and risk of colorectal adenoma and colorectal cancer[J].Cancer Epidemiol,2012,36(2):e104-110.
[21]Chen J,Lu Y,Zhang H,etal.A nonsynonymous polymorphism in IL23R gene is associated with risk of gastric cancer in a Chinese population[J].Mol Carcinog,2010,49(10):862-868.
[22]Chen B,Zeng Z,Xu L,etal.IL23R +2199A/C polymorphism is associated with decreased risk of certain subtypes of gastric cancer in Chinese:a case-control study[J].Cancer Epidemiol,2011,35(2):165-169.
[23]Yao J,Liu L,Yang M.Interleukin-23 receptor genetic variants contribute to susceptibility of multiple cancers[J].Gene,2014,533(1):21-25.
[24]Wang L,Jiang Y,Zhang Y,etal.Association analysis of IL-17A and IL-17F polymorphisms in Chinese Han women with breast cancer[J].PLoS One,2012,7(3):e34400.
[25]Zhou B,Zhang P,Wang Y,etal.Interleukin-17 gene polymorphisms are associated with bladder cancer in a Chinese Han population[J].Mol Carcinog,2013,52(11):871-878.
[26]Wu X,Zeng Z,Chen B,etal.Association between polymorphisms in interleukin-17A and interleukin-17F genes and risks of gastric cancer[J].Int J Cancer,2010,127(1):86-92.
[27]Tahara T,Shibata T,Nakamura M.Association between IL-17A,-17F and MIF polymorphisms predispose to CpG island hyper-methylation in gastric cancer[J].Int J Mol Med,2010,25(3):471-477.
Research Progress in Relation between IL-23/IL-17 Axis Signaling Pathway and Colorectal CarcinomaCHENXiao-long1,ZHANGShu-ying2,XUAn-gao2. (1.GraduateCollegeofGuangdongMedicalCollege,Zhanjiang524023,China; 2.HuizhouMedicineInstitute,Huizhou516003,China)
Abstract:Interleukin(IL)-23/IL-17 axis signaling pathway is an important signaling pathway in inflammatory immune response,a large number of studies have shown that IL-23/IL-17 axis play an important role in many diseases.Recent proteomics studies confirm that IL-23 and IL-17,the important factor in IL-23/IL-17 axis signaling pathway are overexpressed in human colorectal cancer cells,and the expression of IL-23 and IL-17 are correlated to the occurrence and development of colorectal tumor cells.In recent years, with the deepening of colorectal cancer research,many signaling pathways have been found associated with colorectal cancer.IL-23/IL-17 signaling pathway may play an important role in the process of development of colorectal cancer.Further research into the relation between important factors and their gene polymorphisms in IL-23/IL-17 axis signaling pathway and colorectal cancer and using it for screening of high-risk groups,prevention and treatment of colorectal cancer, have great significance.
Key words:Colorectal carcinoma; Interleukin-23/interleukin-17 axis signaling pathway; Gene polymorphism
收稿日期:2014-08-26修回日期:2014-11-21编辑:相丹峰
基金项目:广东省医学科研基金(A2013788)
doi:10.3969/j.issn.1006-2084.2015.11.020
中图分类号:R735.34
文献标识码:A
文章编号:1006-2084(2015)11-1972-03

